
施劍林,1989年畢業于中國科學院上海硅酸鹽研究所,現任上海硅酸鹽研究所研究員,博士生導師,國家杰出青年基金獲得者,教育部“長江學者”特聘教授,2019年當選中國科學院院士。· 介孔與其他無機納米材料的設計、可控合成及物化性能
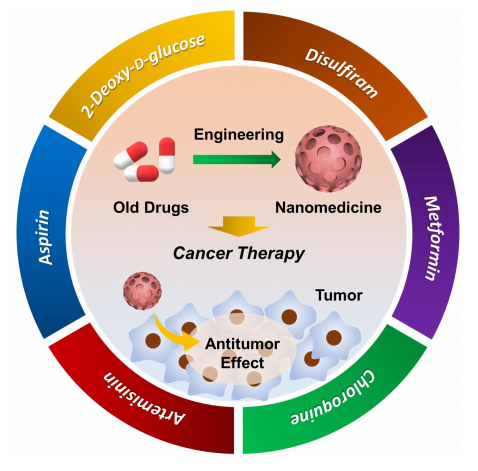
以下對施劍林研究團隊2020年來已發表的部分文章進行介紹,供大家學習交流。(因學識有限,如有疏漏或表述有誤,歡迎指正)癌癥的高發病率和高死亡率促使人們尋求創新療法。最近,美國食品藥品監督管理局(FDA)批準或正在進行臨床試驗的幾種舊藥物,例如2-脫氧-D-葡萄糖,雙硫侖,青蒿素,氯喹,二甲雙胍和阿司匹林,已被證明具有可靠的生物安全性,在臨床上廣泛用于治療其他疾病中,且有一些已被工程化到納米系統中以增強癌癥治療。這些舊藥物可以與納米系統或周圍生物環境的其他成分協同作用,通過無毒到有毒的過渡來促進腫瘤特異性治療。施劍林等人在這份小綜述里提供了該新興領域最新進展的集中總結,重點介紹了有利于下一代納米藥物建設的“舊藥物,新用途”策略。可以預期,通過重新使用舊藥物以提高癌癥的治療功效和特異性,可以加速納米藥物的臨床轉化。
Yang,B. and Shi, J. (2020), Developing New Cancer Nanomedicines by Repurposing OldDrugs. Angew. Chem. Int. Ed.. 2020.DOI:10.1002/anie.202004317https://doi.org/10.1002/anie.202004317中科院上海硅酸鹽研究所施劍林院士和陳雨研究員等人結合臨床狀況,提出老藥新用,即參考FDA批準的Doxil,通過在脂質體中共加載Dox和2-脫氧-d-葡萄糖(2DG)構建了復合脂質體納米系統,這使得癌癥和正常細胞之間的差異應激致敏能夠用于腫瘤特異性化療。
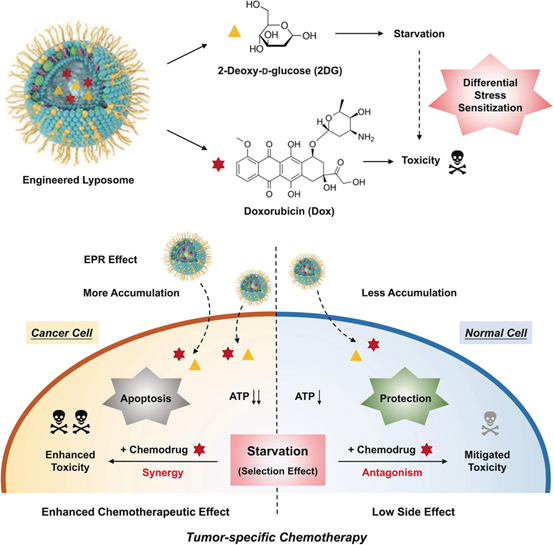
Yang,B., Chen, Y. and Shi, J. (2020), Tumor‐Specific Chemotherapy byNanomedicine‐EnabledDifferential Stress Sensitization.Angew. Chem. Int. Ed..
DOI:10.1002/anie.202002306https://doi.org/10.1002/anie.2020023063. AM: 富銅普魯士藍納米藥物用于原位戒酒硫中毒和增強光熱抗腫瘤活性毒性較低且在特定腫瘤組織上有效的抗癌劑已成為對抗癌癥的新范例。最近,人們致力于通過化學反應將臨床批準的藥物轉變為特定腫瘤微環境中的抗癌藥物。有鑒于此,中國科學院上海硅酸鹽研究所的施劍林課題組和陳雨課題組構筑了中空的普魯士藍(HMPB)基納米藥物DSF @ PVP / Cu-HMPB,實現了DSF的原位化學反應激活和高熱增強的化學療法。1)首先在PVP的保護下通過HCl刻蝕PBs得到了PVP/HMPBs過離子交換法得到了PVP/Cu-HMPB,而后通過將戒酒硫(DSF)封裝到PVP/Cu-HMPB得到了DSF@PVP/Cu-HMPB 。2)在腫瘤積累DSF@PVP/Cu-HMPB后,腫瘤條件下的內源性弱酸性觸發HMPB納米顆粒的生物降解以及DSF和Cu2+的共同釋放,從而通過DSF-Cu2+螯合反應形成具有細胞毒性的雙(N,N-二乙基二硫代氨基甲酸酯)銅(II)配合物(CuL2)。此外,PVP/Cu-HMPBs具有光熱轉化性能,在近紅外輻射下溫度升高增強了DSF的抗癌作用,從而誘導了顯著的體外細胞凋亡和體內皮下和原位腫瘤的清除。3)通過化學螯合反應和光熱增強的原位藥物傳輸策略為設計新型的癌癥治療納米藥物提供了有希望的范例。
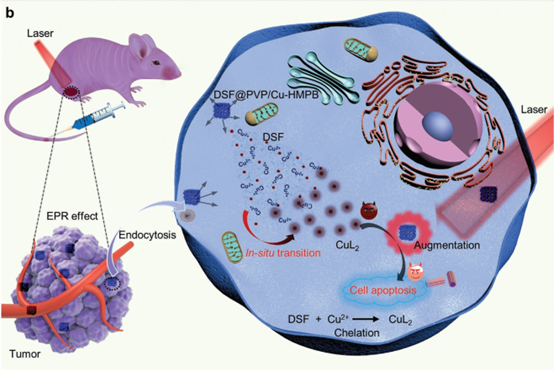
WenchengWu et al. Copper-Enriched Prussian Blue Nanomedicine forIn SituDisulfiram Toxification and PhotothermalAntitumor Amplification. Adv.Mater. 2020, 2000542.DOI: 10.1002/adma.202000542https://onlinelibrary.wiley.com/doi/full/10.1002/adma.202000542納米催化藥物可以在癌細胞中啟動類Fenton反應,特別是將H2O2不成比例地轉化為劇毒的·OH,它會瞬間氧化和滅活周圍的細胞蛋白質和細胞器。然而,癌細胞可以通過“吃掉”和“消化”這些有毒蛋白和受損的細胞器來抵消下游的鏈條效應,這種現象稱為自噬。自噬的細胞內循環功能被征用,癌細胞的抗藥性顯著提高,并促進癌細胞生存,使納米催化藥物在實現治療預期方面適得其反。有鑒于此,中國科學院上海硅酸鹽研究所施劍林研究員和陳雨研究員等人提出了一種聯合治療方法,通過使用藥物調節劑來同時抑制自噬和增強納米催化癌癥治療。1)利用納米金屬-有機骨架MOF(Fe) 作為過氧化物酶模擬物用于催化癌細胞內高氧化性?OH自由基的產生;2)發現氯喹可用于溶酶體脫酸和抑制自噬,切斷癌細胞嚴重氧化應激下的自我保護途徑;3)在納米催化藥物產生ROS的過程中,用一種藥物抑制自噬來增強ROS誘導的氧化損傷,以實現協同癌癥治療。
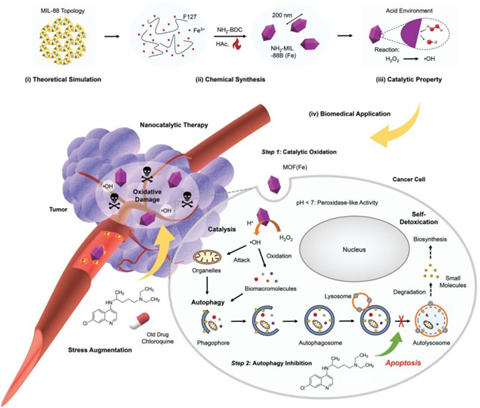
BowenYang, et al. A Metal-Organic Framework (MOF) Fenton Nanoagent-EnabledNanocatalytic Cancer Therapy in Synergy with Autophagy Inhibition, Adv. Mater.,2020.DOI:10.1002/adma.201907152https://doi.org/10.1002/adma.201907152最近人們認識到,癌癥的治療效果可能會因一種叫做自噬的內在保護機制而大打折扣,這種機制使癌細胞在饑餓等惡劣條件下生存。于此,中科院上海硅酸鹽研究所施劍林院士和陳雨研究員等人通過抑制這種增強腫瘤饑餓治療的保護機制,描述了癌癥治療的協同策略。協同治療是通過使用抗糖解劑抑制葡萄糖代謝,使癌細胞趨于嚴重能量缺乏;同時自噬抑制劑黑磷納米片阻斷下游自噬通量和代償能量供應。癌細胞無法提取自己的營養素來養活自己,最終屈服于治療干預并餓死了。體內外實驗結果表明,自噬抑制劑與抗溶血素具有協同作用,具有顯著的協同抗腫瘤作用。預計這種同時阻斷外源性和內源性營養供應的組合方法將有助于今后設計有效的腫瘤特異性治療方法。
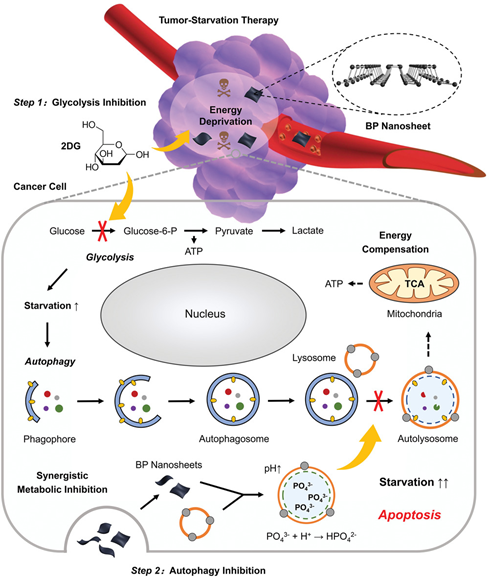
Yang, B., Ding, L., Chen, Y.,Shi, J., Augmenting Tumor‐Starvation Therapy by Cancer Cell AutophagyInhibition. Adv. Sci. 2020, 1902847.
https://doi.org/10.1002/advs.2019028476. ACS Nano:磁熱療聯合免疫治療原發性和轉移性腫瘤癌癥免疫療法在未來的癌癥治療中顯示出令人鼓舞的潛力,但不幸的是,由于療效低和可能的嚴重免疫毒性,臨床上不能令人滿意。于此,中科院上海硅酸鹽研究所施劍林院士和胡萍副研究員以及同濟大學吳慶生教授等人展示了通過聯合磁熱療(MHT)和檢查點阻斷免疫療法,用于消融原發性腫瘤和抑制轉移瘤。研究人員合成了單分散的高性能超順磁性CoFe2O4@MnFe2O4納米顆粒,并將其用于有效的MHT誘導的原發性腫瘤熱消融。同時,產生了許多腫瘤相關抗原,以促進樹突狀細胞(DCs)和細胞毒性T細胞的成熟和活化,從而在荷瘤小鼠模型中有效免疫治療遠距離轉移性腫瘤。MHT聯合檢查點阻斷免疫治療在原發性和轉移性腫瘤的治療中顯示出巨大的潛力。
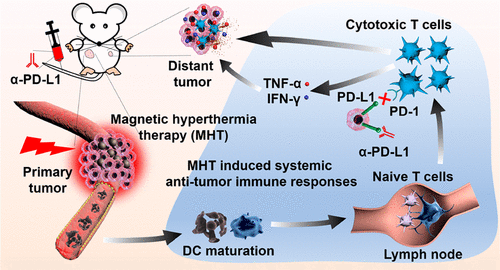
JiongPan, Ping Hu, QingshengWu, and Jianlin Shi, et al., Combined MagneticHyperthermia and Immune Therapyfor Primary and Metastatic Tumor Treatments.ACS Nano 2020.DOI:10.1021/acsnano.9b08550https://doi.org/10.1021/acsnano.9b085507. Science Advances:一種高靈敏度、高選擇性的近紅外鉀離子成像納米傳感器K+濃度是多種生物體過程中的重要指標,目前成功開發了多種光學K+離子探針用于監測生物體中的K+變化,但是目前的K+離子探針具有一定缺陷,比如靈敏度較低,難以對生物體中的信號變化清楚的表征。此外,對生物體中的深部組織的探測無法實現,這是因為目前大多數的K+探針使用波長較低的光激發。于此,中科院硅酸鹽研究所施劍林、步文博,中國科學院腦科學與智能技術卓越中心杜久林、熊志奇等報道了紅外K+離子納米探針實現了對生物組織和活體動物深層結構的高選擇性高響應度的成像監測。這種納米探針通過上轉換材料進行測試(在多孔SiO2納米粒子中裝載上轉換納米材料和K+指示劑)并在SiO2上包覆K+離子過濾膜,通過離子過濾膜對K+的選擇性過濾,上轉換納米粒子通過吸收紅外光并轉變為紫外光,激發K+指示劑,因此能夠對環境中的K+濃度變化進行表征。
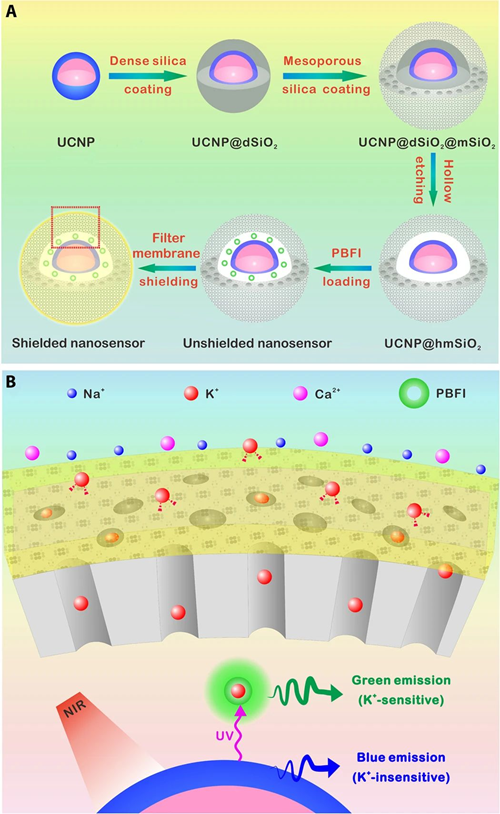
YCl3,YbCl3,TmCl3溶解于油酸和1-十八碳烯混合溶液中,Ar氣氛中加熱到156 ℃保持1 h,降低到室溫后加入NH4F和NaOH的甲醇溶液,隨后加熱到290 ℃保持1.5 h,得到NaYF4:Yb納米粒子。隨后在NaYF4:Yb界面上包覆一層NaYF4:Yb/Nd。通過將合成的NaYF4:Yb/Nd/NaYF4:Yb分散到Igepal CO-520環己烷溶液中,加入NH3水,緩慢加入TEOS原硅酸四乙酯,得到包裹有SiO2的材料。隨后再負載一層介孔SiO2膜,通過加入CTAC十六烷基三甲基氯化銨、TEA三乙醇胺,在80 ℃中加入TEOS,得到包覆介孔SiO2層的材料。在材料表面負載保護層:保護膜前驅液配制,將N-芐基水楊酰胺、K2CO3溶解于DMF中,加熱到90 ℃,隨后加入1,1,1-三(對甲苯磺酰氧基甲基)乙烷、2-氨基對苯二甲酸攪拌24 h。通過柱層析方法(石油醚/乙酸乙酯:2:1)得到白色固體保護膜原料。在乙腈溶液中將保護膜負載到上轉換復合納米材料表面。對150 mM K+,150 mM Na+, 2 mM Ca2+, 2 mM Mg2+, 50 μM Fe2+, 2 mM Zn2+, 50 μM Mn2+, 50 μM Cu2+監測性能顯示,K+離子指示劑對K+的選擇性較高。并且結果顯示界面上~2 nm厚度的過濾膜改善了監測性能。
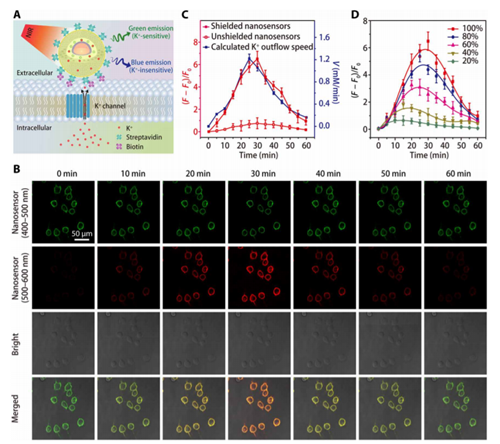
在納米顆粒界面上負載一層PEG膜結構防止對蛋白質的無選擇吸附、并改善探針的穩定性,結果顯示這種探針具有監測生物體中的K+變化能力。對鼠大腦和斑馬魚大腦中的K+和Ca2+監測。
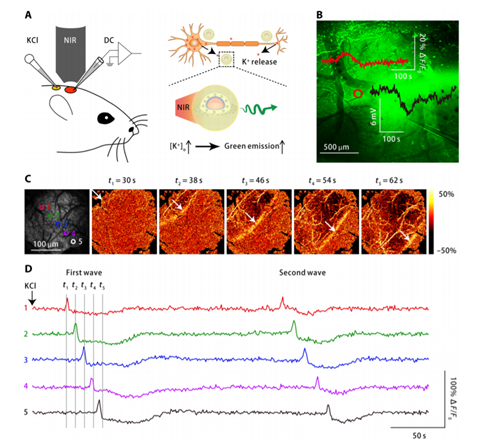
Jianan Liu, et al. Ahighly sensitive and selective nanosensor for near-infrared potassium imaging,Science Advance2020, 6, 16, eaax9757DOI: 10.1126/sciadv.aax9757https://advances.sciencemag.org/content/6/16/eaax9757.full8. JACS: 近紅外電壓納米傳感器能夠實時成像小鼠和斑馬魚的神經元活動 具有監視神經元活動能力的光學電壓傳感器是研究大腦信息處理的寶貴工具。但是,當前的遺傳編碼電壓指示器通常需要高功 率的可見光來激發,并且僅限于基因可尋址的模型動物。于此,中國科學院腦科學與智能技術卓越中心杜久林和中科院硅酸鹽研究所施劍林、步文博等人報道了近紅外(NIR)激發的非遺傳電壓納米傳感器,可在完整動物中實現穩定的神經元膜電位記錄。
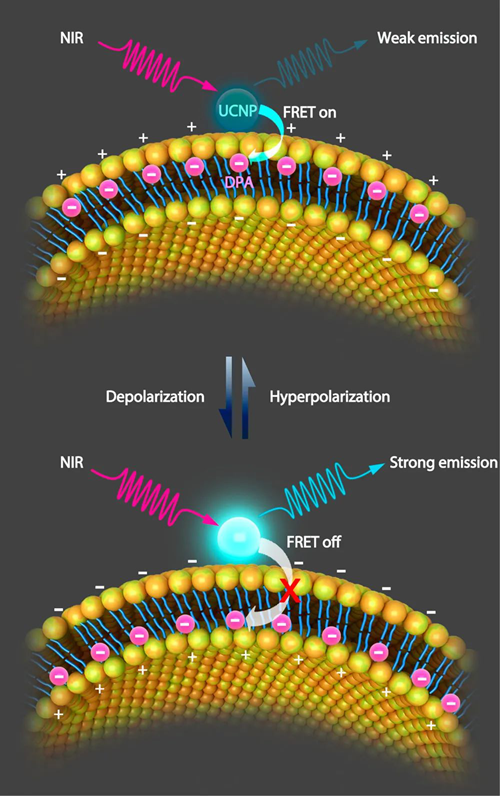
1)納米傳感器由F?rster共振能量轉移(FRET)對,外膜錨定的上轉換納米粒子(UCNP)和膜嵌入的六硝基二苯胺(Dipicrylamine,DPA)組成。DPA的負電荷會使膜電位波動而影響DPA與UCNP之間的距離,從而進一步改變FRET效率。因此,納米傳感器的發射強度可以報告膜電位。2)使用納米傳感器,不僅可以監測培養的細胞膜電位的電誘發變化,還可以監測完整斑馬魚中神經元的感覺反應以及完整小鼠中皮質神經元的腦部狀態調節閾下活性。

JiananLiu, et al. Near-Infrared Voltage Nanosensors Enable Real-Time Imaging ofNeuronal Activities in Mice and Zebrafish. Journal of the American ChemicalSociety 2020.https://doi.org/10.1021/jacs.0c01025

施劍林,博士,1989年畢業于中國科學院上海硅酸鹽研究所,現任上海硅酸鹽研究所研究員,博士生導師,國家杰出青年基金獲得者,教育部“長江學者”特聘教授,擔任國家重大基礎研究計劃和國家重點納米專項首席科學家,同時還承擔并負責多項國家自然科學重點基金、“863”材料高技術和科學院創新方向性等多項國家與地方科研項目,2019年當選中國科學院院士。曾從事先進陶瓷材料制備科學,燒結理論,結構陶瓷高溫可靠性評價透明陶瓷等研究(1983-2005),現主要從事無機納米材料,介孔材料與介孔主客體復合材料的合成、非均相催化性能與環境應用;介孔納米顆粒的可控合成及其生物相容性、多功能化、藥物輸運和納米診療劑等方面的研究(1998至今)。最近提出了“納米催化醫學”的全新研究前沿方向,使用無毒納米顆粒而不使用傳統的有毒化療藥物,通過引發瘤內原位的催化反應達到抗腫瘤目的。發表雜志SCI論文460余篇,SCI他人引用33,000余次,H-index為108,并被Thomson Reuters選為2015至2019年度全球高被引科學家。以第一完成人獲國家自然科學二等獎一項(2011年度)、上海市自然科學一等獎兩項(2008,2014)和上海市科技進步一等獎(2009)一項等科技獎勵。 另獲兩院院士評選中國十大科技進展(2005)、中國青年科技獎、中科院青年科學家獎、上海市自然科學牡丹獎、上海市科技精英等獎勵。(課題組網站:http://www.skl.sic.cas.cn/yjly/swyy/sjl/)




























