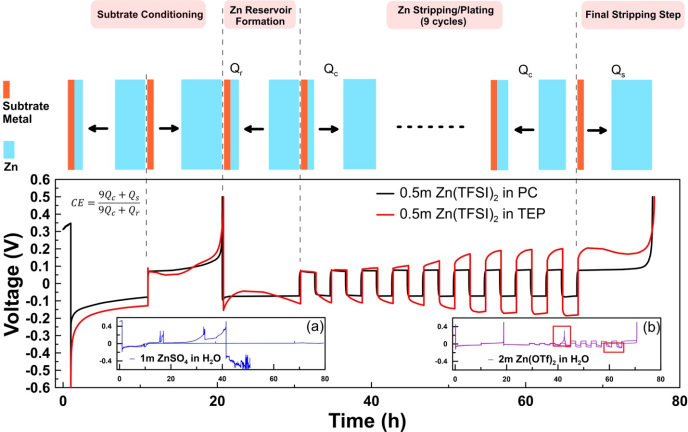
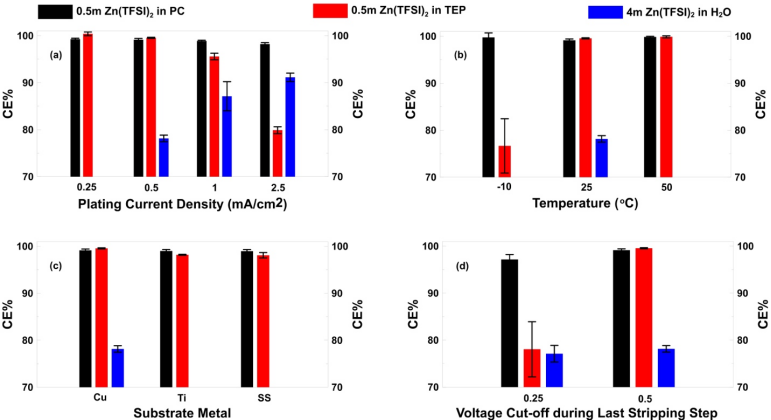
導讀:由于鋅(Zn)具有高能量密度和更高的安全性,Zn金屬負極可充電化學電池有希望替代基于鋰金屬或鋰離子嵌入/合金化的負極材料;然而,與水和非水電解質的副反應引起Zn的電鍍/剝離的不良電化學可逆性限制了這些系統(tǒng)的實用性。盡管最近針對可充電鋅金屬電池(RZMBs)的研究在鋅金屬可逆性方面取得了一些進展,用庫侖效率(CE)來量化,但是CE的標準模型尚未建立,跨越化學和系統(tǒng)的結果經常存在矛盾。更重要的是,對于決定鋅可逆性的關鍵因素仍然缺乏足夠的了解。近日,美國陸軍研究實驗室許康團隊在Energy & Environmental Materials上發(fā)表了題為“Critical Factors Dictating Reversibility of the Zinc Metal Anode”的開創(chuàng)性研究論文,該文章系統(tǒng)探索了決定鋅金屬負極可逆性的關鍵因素。本文第一作者為美國陸軍實驗室馬琳博士,通訊作者為美國陸軍實驗室 Marshall A. Schroeder博士和許康博士。在這項工作中,作者將一種可用于決定鋰金屬負極的嚴謹的CE模型借鑒到Zn化學,并用于系統(tǒng)地檢驗一系列因素,包括集流體化學,電流密度,溫度和剝離過程中的電壓上限,對不同Zn電解質的可逆性的影響。在密度泛函理論計算的支持下,該標準化的Zn CE模型隨后被用于確定電解質對Zn2+的溶劑化強度與相應電解質中測得的Zn CE之間的重要關系,從而為將來開發(fā)和評估Zn電解質提供新的指導。盡管Li和Zn化學性質之間存在根本性的差異,作者發(fā)現已發(fā)布的Li CE測定模型為建立Zn CE的類似模型提供了極好的指南。作者借鑒了Adams等人提出的恒電流技術來測量水性和非水性電解質中的鋅金屬電鍍/剝離的CE。在這種方法中,使用了一個Cu|Zn電池裝置,其中Cu為工作電極,Zn為對電極,Zn源和參比電極。Figure 1.Proposed galvanostatic cycling protocol for evaluating Zn stripping/plating CE. The plots show the voltage vs. time profile for Cu|Zn cells at 25°C with different typical Zn electrolytes. CE results are summarized in Table S1.圖1展示了該方法的示意圖,包括文獻中報道的一些最有希望的鋅電解質的初步結果。令人驚訝的是,由于寄生反應引起的電壓不穩(wěn)定,某些最常見的水性系統(tǒng)無法完成該模型實驗(圖1a-b,圖S3 a,b,f)。這些結果沒有得到有用的CE信息,表明這些電解質可能無法在實際條件下(速率,容量,負載等)支持Zn負極性能。對于成功實現該模型的電解質,非水相系統(tǒng)在CE方面比水性電解質表現出明顯的優(yōu)勢(圖S3 g)。有趣的是,在TEP-Zn(TFSI)2體系中,盡管實現了該模型,但是過電勢在剝離過程中隨著循環(huán)次數和極化濃度的增加而增加,說明該電解質的潛在傳輸受限制, CE對電鍍/剝離電流的依賴性需要了解。Figure 2. A summary on the effect of different factors: (a) current density, (b) temperature, (c) substrate metal, and (d) voltage cut-off during last stripping step on CE for three representative electrolytes A:0.5m Zn(TFSI)2 in PC, B: 0.5m Zn(TFSI)2 in TEP and C: 4m Zn(TFSI)2 in H2O. (a), (b) and (d) refer to Cu substrate.基于這些結果,作者選擇了一些電解質進一步研究:0.5m Zn(TFSI)2在PC(A)中,0.5m Zn(TFSI)2在TEP(B)和4m Zn(TFSI)2在H2O(C)中。除了使用標準模型對這些電解質進行嚴格測試之外,作者還探索了CE隨電流密度,溫度,襯底金屬化學性質以及用于剝離的截止電壓上限的變化趨勢。圖2顯示了這些測量的結果,誤差表示在相同條件下重復測試之間的差異。所有這三種電解質都顯示出CE對電流密度的顯著依賴性(圖2a),這可以歸因于相應的電壓極化程度和在工作電極電位達到預定的上限(0.5 V vs. Zn / Zn2+)之前有多少鍍鋅被剝離。高極化度(如在2.5 mA / cm2的電解質B的示例中)極大地限制了可恢復的容量。循環(huán)溫度對所選電解質在-10℃,25℃和50 ℃下測得的CE的影響如圖2b所示。雖然電解質C在-10℃和50 ℃具有優(yōu)越的離子電導率,但其CE缺失,因為該電解液沒能通過初始恒電流試驗。相反,除了在-10 ℃時電解質B的CE降低外,電解質A和B的CE并沒有表現出明顯的溫度依賴性,這歸因于與任何相變或離子電導率下降無關的電壓極化突然增加。電解質B和C的行為表明,電池極化似乎與體離子傳導脫鉤,更可能與沉積的Zn的界面/相間化學或形貌/粗糙度有關。研究者還使用銅,鈦和不銹鋼(SS)電極研究了襯底材料對Zn電鍍/剝離可逆性的影響,它們是Zn化學最常用的集流體(圖2c)。從這些實驗中,相比于水性體系,這些襯底金屬對非水電解質CE的影響似乎微不足道,因為電解質C無法完成SS或Ti集流體上的測試。這種差異歸因于金屬襯底析氫活性的不同,這些已經在鋅電解質中進行了研究。
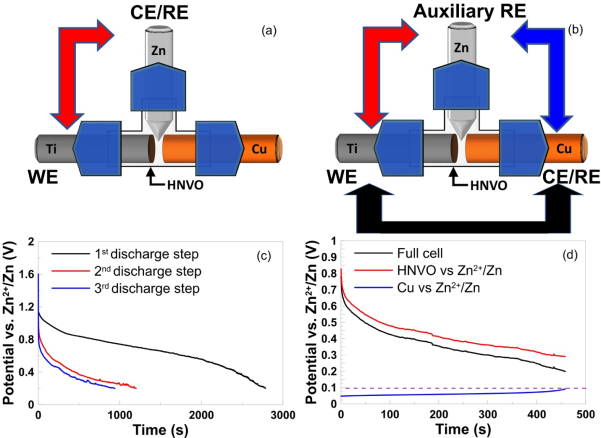
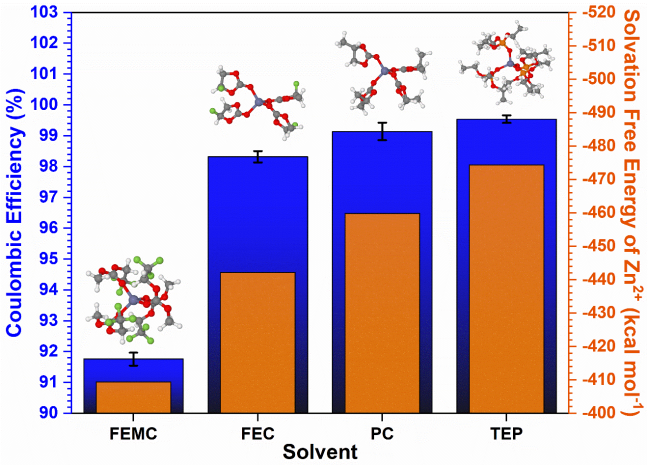
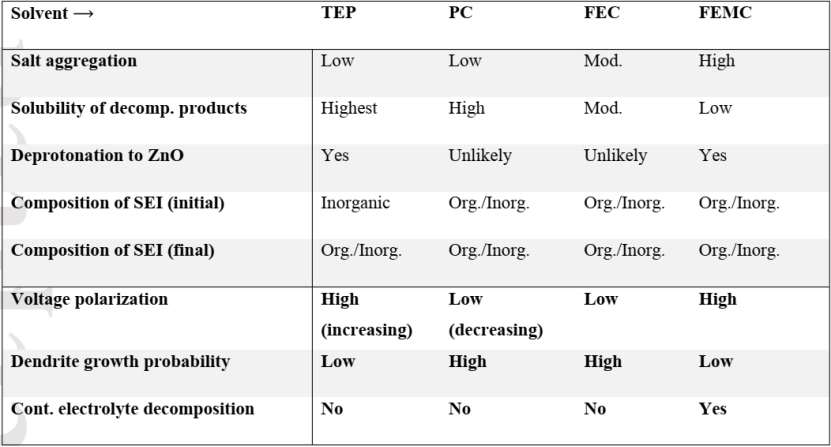
Figure 3. A Swagelok-based three-electrode cell set-up for (a) HNVO|Zn cell pre-cycling and (b) Zn stripping potential testing. Potential vs. time for (c) the first three discharge process of HNVO|Zn cell (shown in Figure 3a) and (d) discharge processes of HNVO|Cu cell (shown in Figure 3b) with a current of 300 mA/g between 0.2 and 1.6 V at 25℃. The electrolyte was 4m Zn(TFSI)2 in H2O.在一個“無負極”的全電池中,金屬襯底(如Cu vs Zn/Zn2+)可以達到的最高電勢決定于襯底材料,陰極化學和電池的放電截止電壓。在文獻報道中,這個上限經常被武斷地選擇為0.5V vs Zn,其動機來源于一種假設,即在這個電壓下所有可移動的Zn都被剝離。然而,這個數值在實際的全電池中可能根本無法實現,甚至無法接近。為了在全電池中準確地確定此值,研究者構建了一個三電極Swagelok電池,包括Na2V6O16·1.63H2O(HNVO)工作電極(WE),Cu對電極和Zn參比電極(RE)(圖3a- b),電解質為4m Zn(TFSI)2 的水溶液。由于HNVO是在沒有初始容量的“充電”狀態(tài)下制備的,因此首先使用Zn作為對電極以300 mA / g的恒定電流密度將其放電,然后在25 ℃下,0.2到1.6 V之間做2.5個循環(huán)(圖3c)。然后將放電的HNVO與Cu連接作為對電極,制成模擬的“無負極” Zn電池,帶有輔助Zn電極,可為HNVO(WE或模擬正極)和Cu(對電極或模擬負極)的電位提供準確的參考。令人驚訝的是,在單個充電和放電步驟之后,當HNVO|Zn全電池達到0.2 V放電電壓極限時(圖3d),Cu負極集流體上的最終Zn剝離電位(vs. Zn/Zn2+)僅為~0.1 V vs Zn,遠遠低于Zn CE模型中大多數報道的最高電勢極限(例如0.5 V,1 V等)。也就是說,文獻報道的CE值在實際RZMB操作中可能從來沒有接近過。為什么具有顯著電壓極化的電解質(如電解質B)或者有長期穩(wěn)定性問題的電解質(如電解質C)在全RZMB中性能特別差的原因清楚顯現:在負極上鍍的Zn從來沒有獲得足夠高的電壓在放電的最后實現完全剝離。這些在CE測試過程中Zn剝離不切實際的電壓上限是CE的期望值與平庸的全電池性能之間存在明顯差距的根本原因!針對RZMB的最終目標,設計嚴格的模型測試Zn電解質,可以在電化學性能和電解質基本特性之間建立關聯,從而指導未來電解質的發(fā)展。為從分子層面理解該關聯,作者使用DFT計算來預測Zn電解質的相對溶劑化強度,使用CCA計算TEP,PC,碳酸氟乙烯酯(FEC)和3,3,3-氟乙基甲基碳酸酯(FEMC)中Zn2+和ZnO的塊體溶劑化自由能。CCA中的溶劑化自由能反映形成具有溶質(X)的n溶劑(Sn)團簇的結合自由能,并添加近似修正以使XSn簇溶劑化。盡管這樣的計算缺乏明確的電極表面的顆粒處理和內亥姆霍茲層中的競爭性溶劑化效果,但圖4中總結的Zn2+溶劑化結果仍突出了溶劑化和CE之間的相關性(使用圖1所示的方法在25 ℃下測量)。Figure 4. Correlation between measured CE and solvation free energies of Zn2+-solvent tetramers from density functional theory calculations with implicit solvent. Jmol color scheme, visualized with VESTA.在所考慮的溶劑中,發(fā)現FEMC對Zn2+的溶劑化強度最低,并且隨著團簇尺寸的增加,CF3基團被驅除,會發(fā)生嚴重的溶劑重組。理論模擬結果表明多種競爭機制,如ZnO上的溶劑去質子化,分解和SEI形成,與天然鈍化膜的溶劑化和循環(huán)過程中的負極表面處理競爭,如表1所示。Table 1. A summary of the factors affecting CE and their relationship to observed behaviors during cycling. Abbreviations used above: Decomp. (decomposition), Cont. (continuous), Mod. (moderate), Org. (organic), Inorg. (inorganic, ZnF2).FEC和FEMC的較弱溶劑會促進更高程度的鹽聚集,因此更有可能生長出更厚,更均質的有機/無機SEI。導致PC中枝晶和電池失效的相同問題也可能擴展到FEC。但是,對于FEMC觀察到的大極化和較低的CE可能表明電解質不斷分解。這些因素共同表明,仔細選擇溶劑/鹽的組合可能會促進控制CE以外的性能,包括極化,枝晶生長傾向和自放電率。在這項工作中,作者將Li體系測定CE的恒電流模型借鑒到鋅化學中,探索了某些關鍵因素如何決定各種Zn電解質的可逆性。初步結果表明,非水電解質通常比大多數常見的水電解質具有更可逆的鍍鋅/剝離行為,但未考慮其支持RZMB全電池化學的能力。為了建立與實際RZMBs相關的嚴謹模型,作者使用基于Swagelok的三電極設置跟蹤了HNVO|Zn(Cu)全電池中的最終Zn剝離勢,并首次系統(tǒng)地研究了精確的上限截止電壓對Zn CE值的影響。基于這些結果和互補的DFT計算,確定了CE與溶劑結合能之間的內在聯系,從而將不同溶劑分子的溶劑化行為與相應電解質中Zn金屬負極的電化學性能聯系起來。對于RZMBs的持續(xù)發(fā)展而言,可以用來快速、準確地量化不同電解質體系中Zn金屬可逆性的標準模型至關重要。作者希望這項工作能為未來鋅研究提供更明確和嚴謹的經驗,可以根據實際的鋅金屬負極電池的要求更準確地評估該領域的新進展。Lin Ma, et al. Critical Factors Dictating Reversibility of the Zinc Metal Anode. Energy Environ. Mater. 2020.https://onlinelibrary.wiley.com/doi/full/10.1002/eem2.12077許康在Prof. Austen Angell的指導下獲得了亞利桑那州立大學的化學博士學位,目前是美國陸軍研究實驗室的研究員和極限電池化學小組負責人。許康博士從事電池電解質材料和相間化學領域的研究已有30余年。在這些領域,許康博士以2004年和2014年在Chemical Reviews上發(fā)表的兩篇經典評論而聞名。許康博士發(fā)表過250余篇論文,并獲得過諸多獎項,包括International Battery Association Technology Award (2017) 和Electrochemical Society Battery Research Award(2018)。除研究工作外,許康博士也是極限電池研究中心(CREB)的聯合創(chuàng)始人之一,同時也還是Energy & Environmental Materials (EEM)的副主編,ECS Interface的客座編輯以及ACS Applied Materials and Interface顧問委員會的成員。