之前,奇物論報(bào)道過(guò)關(guān)于納米藥物進(jìn)入實(shí)體瘤的新機(jī)制,里面提及納米藥物進(jìn)入腫瘤有可能是通過(guò)主動(dòng)途徑的,近日,Nature Materials雜志上對(duì)此文發(fā)表了社論,生物材料大牛David J. Mooney院士發(fā)表觀點(diǎn)和伊利諾伊大學(xué)聶書(shū)明教授發(fā)表評(píng)論文,于此,奇物論針對(duì)聶書(shū)明教授發(fā)表的評(píng)述進(jìn)行解讀,里面提及非常好的想法,值得學(xué)習(xí)!



首先,針對(duì)Warren C. W. Chan教授的文章,就不再此重復(fù),讀者可去雜志官網(wǎng)找出來(lái)收藏收藏,也可點(diǎn)擊下方標(biāo)題查看奇物論的解讀:
Nature Materials:挑戰(zhàn)傳統(tǒng)! 臨床30年后,腫瘤納米給藥機(jī)制新發(fā)現(xiàn)!
下面直接給大家分享聶書(shū)明教授在文中給出的重點(diǎn):
針對(duì)Chan及其同事的工作,他們僅使用了一種類型的納米粒子(膠體金),并且僅研究了三種納米粒子的尺寸(15 nm,50 nm和100 nm)。具體來(lái)說(shuō),他們發(fā)現(xiàn)對(duì)于15 nm的尺寸,EPR效應(yīng)占腫瘤內(nèi)部納米顆粒的12%,對(duì)于50 nm的顆粒,EPR效應(yīng)下降至3%,而對(duì)于100 nm的顆粒,EPR效應(yīng)上升至25%。尺寸依賴性的趨勢(shì)是違反直覺(jué)的,即當(dāng)納米顆粒尺寸變小時(shí),通過(guò)間隙的被動(dòng)EPR的貢獻(xiàn)有望增加。因此,可能存在更復(fù)雜的途徑,導(dǎo)致50 nm顆粒的EPR貢獻(xiàn)降低。
機(jī)制與觸發(fā)因素:
目前,關(guān)于主動(dòng)轉(zhuǎn)胞吞作用的機(jī)制細(xì)節(jié),或可能觸發(fā)細(xì)胞攝取、轉(zhuǎn)運(yùn)和釋放穿過(guò)血管內(nèi)皮的納米顆粒的結(jié)構(gòu)因素,知之甚少。還不清楚納米顆粒可通過(guò)轉(zhuǎn)胞吞作用穿越多少細(xì)胞層(即腫瘤組織穿透的深度)。Schnitzer的早期開(kāi)創(chuàng)性工作(DOI:10.1152/ajpheart.1992.262.1.H246)表明,受體與小窩糖蛋白(例如gp60)結(jié)合會(huì)導(dǎo)致小窩蛋白介導(dǎo)的內(nèi)吞作用,并通過(guò)轉(zhuǎn)胞吞作用使血白蛋白通過(guò)血管內(nèi)皮細(xì)胞主動(dòng)轉(zhuǎn)運(yùn)。
浙江大學(xué)申有青研究員和UCLA顧臻教授等人的最近的研究(Nature Nanotech. DOI:10.1038/s41565-019-0485-z)表明,電荷翻轉(zhuǎn)過(guò)程可以觸發(fā)小窩蛋白介導(dǎo)的聚合物-藥物納米顆粒的內(nèi)吞作用和胞吞作用,從而可以在整個(gè)實(shí)體瘤中進(jìn)行跨內(nèi)皮和跨細(xì)胞的轉(zhuǎn)運(yùn)和分布。重要的是,電荷翻轉(zhuǎn)后的正電荷類似于與帶正電的TAT肽-量子點(diǎn)。

圖|NatureNanotech.
據(jù)報(bào)道,這些類型的TAT肽涂層的量子點(diǎn)被細(xì)胞攝取后,沿微管軌道進(jìn)行主動(dòng)的細(xì)胞內(nèi)轉(zhuǎn)運(yùn),然后通過(guò)胞吐作用或囊泡脫落釋放。一個(gè)主要發(fā)現(xiàn)是分子馬達(dá)參與細(xì)胞內(nèi)運(yùn)輸,以及偽足參與動(dòng)態(tài)結(jié)構(gòu)重塑,最終將膜結(jié)合的量子點(diǎn)從細(xì)胞的一側(cè)改組到另一側(cè)。類似地,腫瘤穿透肽已被用于增加藥物、抗體和納米治療藥物在體內(nèi)實(shí)驗(yàn)?zāi)[瘤和體外人類腫瘤中的積累。因此,研究這類肽是否可用于觸發(fā)或促進(jìn)主動(dòng)轉(zhuǎn)胞吞作用將是一個(gè)有趣的課題。
除了正電荷外,配體-受體結(jié)合可能在主動(dòng)轉(zhuǎn)運(yùn)的早期階段很重要。與細(xì)胞表面受體的特異性相互作用通過(guò)細(xì)胞內(nèi)吞和隨后的細(xì)胞內(nèi)釋放治療藥物促進(jìn)納米顆粒內(nèi)吞。抗體、核酸、肽甚至碳水化合物等大分子可以附著在納米顆粒表面進(jìn)行選擇性靶向和轉(zhuǎn)運(yùn)。隨著有關(guān)細(xì)胞轉(zhuǎn)運(yùn)是納米顆粒進(jìn)入腫瘤的主要途徑的報(bào)道,配體-受體結(jié)合將重新引起人們的興趣。特別是,了解與空泡(vacuole)形成有關(guān)的配體-受體相互作用有助于合理設(shè)計(jì)用于癌癥納米藥物的納米粒。隨著對(duì)體內(nèi)納米顆粒遞送的新見(jiàn)解,我們應(yīng)該重新思考我們的策略,將我們的重點(diǎn)從僅考慮被動(dòng)EPR遞送的納米顆粒轉(zhuǎn)移到設(shè)計(jì)增強(qiáng)主動(dòng)遞送的納米顆粒。此外,進(jìn)一步研究細(xì)胞介導(dǎo)的遞送方法也可以提高納米粒子進(jìn)入實(shí)體腫瘤的效率(下圖c)。
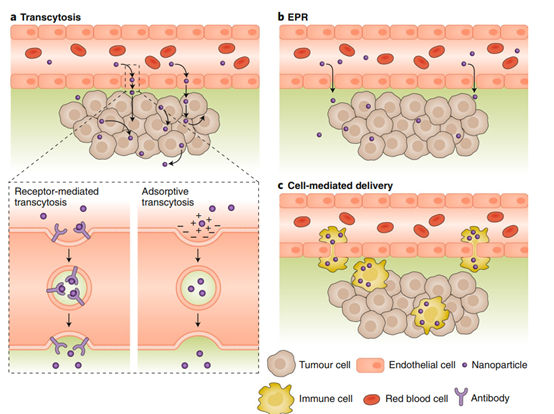
圖|Nature Mater.
癌癥治療新方式
除了轉(zhuǎn)胞吞作用之外,納米增強(qiáng)免疫療法可以為癌癥納米藥物提供完全不同的途徑。與其設(shè)計(jì)納米顆粒來(lái)克服血管內(nèi)皮的屏障,不如利用免疫細(xì)胞來(lái)破壞腫瘤。這種方法繞過(guò)了長(zhǎng)期存在的體內(nèi)給藥問(wèn)題,通過(guò)制備專門刺激免疫系統(tǒng)的納米顆粒,可以有效穿透實(shí)體腫瘤。
在癌癥治療中使用免疫療法有幾個(gè)優(yōu)勢(shì)。首先,少量免疫細(xì)胞的激活有效地增強(qiáng)了對(duì)腫瘤細(xì)胞的反應(yīng)。這與傳統(tǒng)的化療藥物形成了鮮明對(duì)比,這些藥物經(jīng)常大量使用,常常導(dǎo)致非惡性組織的毒性。其次,對(duì)腫瘤細(xì)胞的免疫反應(yīng)可以通過(guò)之后的免疫記憶來(lái)防止隨后的復(fù)發(fā)。第三,活化的免疫細(xì)胞可以定位遠(yuǎn)處的轉(zhuǎn)移灶,而這些轉(zhuǎn)移灶通常是常規(guī)療法無(wú)法達(dá)到的。
納米疫苗
目前癌癥免疫治療的方法包括注射免疫檢查點(diǎn)阻斷劑,例如單克隆抗體,或刺激先天免疫系統(tǒng)。如ipilimumab和atezolizumab等藥物已被批準(zhǔn)用于多種類型的癌癥。但是,這些藥物價(jià)格昂貴,容易產(chǎn)生耐藥性,患者反應(yīng)也很低。在這方面,免疫治療劑的靶向遞送仍然是有吸引力的。納米粒子與免疫系統(tǒng)的相互作用已被廣泛研究。事實(shí)上,以納米顆粒為基礎(chǔ)的疫苗已經(jīng)有了非常有前途的發(fā)展,這種疫苗可以將抗原輸送到淋巴腔,最終刺激T淋巴細(xì)胞產(chǎn)生抗腫瘤反應(yīng)。

納米粒子也適合作為與腫瘤微環(huán)境中的兩個(gè)或多個(gè)相關(guān)免疫成分進(jìn)行多特異性相互作用的平臺(tái),并與多個(gè)免疫伴侶結(jié)合以誘導(dǎo)免疫反應(yīng)。Yuan等人(Nature Nanotech. DOI:10.1038/nnano.2017.69)最近開(kāi)發(fā)了一種用于癌癥免疫療法的多價(jià)雙特異性納米生物共軛物接合劑(mBiNE)。作者將具有抗HER2受體和鈣網(wǎng)蛋白(CRT)對(duì)羧基化聚苯乙烯納米粒子進(jìn)行了功能化。當(dāng)抗HER2與腫瘤細(xì)胞上的HER2受體結(jié)合時(shí),鈣網(wǎng)蛋白與巨噬細(xì)胞相互作用以激活它們。納米粒子的作用就像一個(gè)平臺(tái),促進(jìn)癌細(xì)胞的參與并激活巨噬細(xì)胞,隨后還激活T細(xì)胞并誘導(dǎo)針對(duì)腫瘤細(xì)胞的免疫反應(yīng)。此外,用mBiNE處理導(dǎo)致記憶T細(xì)胞的形成,可以消除腫瘤細(xì)胞的任何進(jìn)一步復(fù)發(fā)。
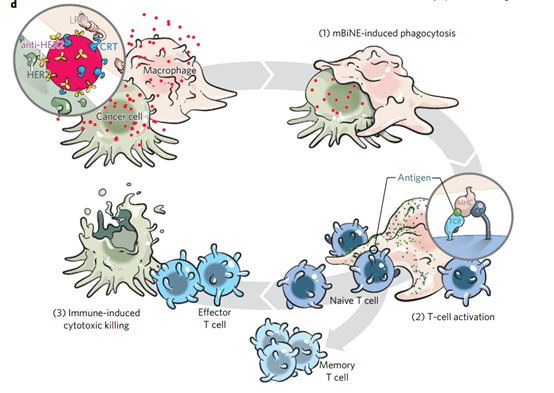
圖|Nature Nanotech.
納米靶向免疫細(xì)胞
此外,還開(kāi)發(fā)了一些策略,可以通過(guò)在納米顆粒表面附著特定的部分直接靶向T細(xì)胞。Schmid等人(Nature Commun. DOI:10.1038/s41467-017-01830-8)開(kāi)發(fā)了一種基于PLGA/ PEG的納米粒子系統(tǒng),該系統(tǒng)旨在以模塊化方式靶向T細(xì)胞上的多種受體。納米顆粒還載有可以持續(xù)釋放的小分子藥物。這些基于納米粒子的多特異性接合劑和靶向藥物釋放平臺(tái)的最新實(shí)例利用了用一種以上靶向配體對(duì)納米粒子表面進(jìn)行功能化的潛力
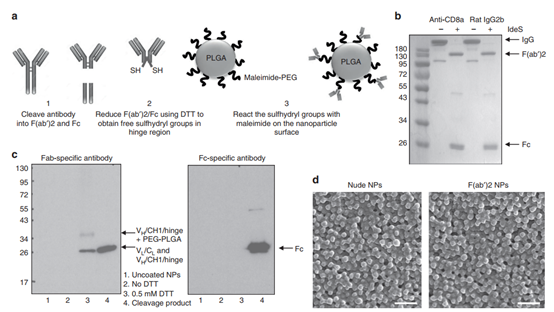
圖|Nature Commun.
納米光熱免疫
另外,納米顆粒獨(dú)特的光學(xué)特性可以與治療特性相結(jié)合,開(kāi)發(fā)用于癌癥免疫治療的多模式藥物系統(tǒng)。蘇州大學(xué)劉莊教授等人開(kāi)發(fā)了一種多模式納米顆粒系統(tǒng),該系統(tǒng)結(jié)合了光熱劑吲哚菁綠(ICG)和封裝在聚乳酸-乙醇酸(PLGA)中的toll樣受體-7激動(dòng)劑咪喹莫特(R837)。這種多模式PLGA-ICG-R837結(jié)構(gòu)被證明能夠在紅外激光照射下消融原發(fā)性腫瘤,并且在免疫檢查點(diǎn)阻斷的情況下,能夠進(jìn)一步消除腫瘤細(xì)胞。
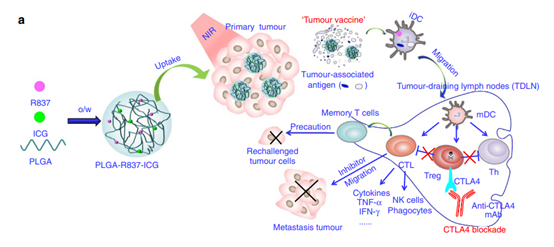
圖|Nature Commun.
還有,還開(kāi)發(fā)了強(qiáng)大的免疫記憶能力,可以為后續(xù)的腫瘤再?gòu)?fù)發(fā)提供保護(hù)。Kulkarni等人(PNAS, DOI: 10.1073/pnas.1603455113)最近報(bào)道稱,聚合納米顆粒系統(tǒng)能夠與報(bào)告模塊一起提供免疫治療有效載荷,以監(jiān)測(cè)所給免疫治療劑的療效。聚合物納米顆粒報(bào)告了從其治療負(fù)荷傳遞到的同一細(xì)胞中的caspase-3活性,因此是藥物活性的直接量化。但是,應(yīng)該指出的是,這些多功能或“多才多藝”的納米粒子通常具有復(fù)雜的結(jié)構(gòu)和化學(xué)組成,并且可能在臨床轉(zhuǎn)化中面臨其他挑戰(zhàn)。
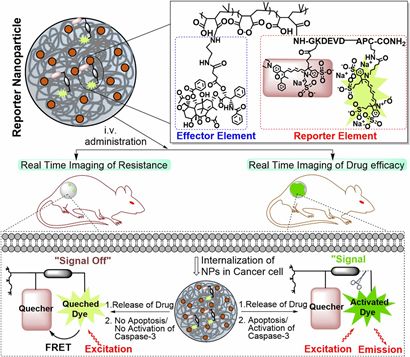
圖|PNAS
小結(jié):
總之,Chan和他的同事報(bào)道了令人信服的實(shí)驗(yàn)證據(jù),表明基于細(xì)胞轉(zhuǎn)運(yùn)的主動(dòng)機(jī)制可能比被動(dòng)EPR效應(yīng)更有效,因此可以作為一種主要機(jī)制,在實(shí)體腫瘤的血管內(nèi)皮上運(yùn)輸納米顆粒。這一發(fā)現(xiàn)為設(shè)計(jì)用于體內(nèi)腫瘤遞送和靶向的納米顆粒創(chuàng)造了新的可能性。然而,要了解主動(dòng)轉(zhuǎn)運(yùn)的詳細(xì)機(jī)制和觸發(fā)這種轉(zhuǎn)運(yùn)過(guò)程的因素,還有很多工作要做。此外,利用多功能納米顆粒靶向天然和適應(yīng)性免疫系統(tǒng)為癌癥納米醫(yī)學(xué)提供了新的途徑,從而繞過(guò)了納米顆粒進(jìn)入實(shí)體腫瘤的長(zhǎng)期瓶頸。就臨床轉(zhuǎn)化而言,目前尚不清楚主動(dòng)轉(zhuǎn)胞吞作用是否會(huì)促進(jìn)或阻礙這項(xiàng)任務(wù)。如果納米顆粒的遞送效率可以大大提高(例如,提高一個(gè)數(shù)量級(jí)),那么主動(dòng)的轉(zhuǎn)胞吞作用機(jī)制將通過(guò)減少納米顆粒的劑量來(lái)提高治療效果或減少副作用。
參考資料:
Pandit,S., Dutta, D. & Nie, S. Active transcytosis and new opportunities forcancer nanomedicine. Nat. Mater. 19, 478–480 (2020).
https://doi.org/10.1038/s41563-020-0672-1











