
第一作者:薛臣成,李孟桓,趙陽
通訊作者:俞書宏,羅忠
通訊作者單位:中國科學技術大學,重慶大學
研究亮點:
1. 報道了一種基于原位礦化組裝的無定形碳酸鈣基Fe2+-阿霉素復合配合物,用于腫瘤靶向化學凋亡與鐵死亡誘導。
2. 該納米制劑具有較強的鐵死亡作用,具有一定的臨床應用前景。
腫瘤細胞鐵死亡
鐵死亡(Ferroptosis)是一種與傳統細胞凋亡(Apoptosis)、細胞壞死(Necrosis)及其他已知細胞死亡信號通路明顯不同的細胞死亡信號通路。最近的研究表明,鐵死亡在腫瘤的發生和發展進程中扮演著重要作用,有望發展成為一種新的癌癥治療策略。然而,如何針對腫瘤細胞實施特異性靶向鐵死亡誘導仍然是一項需迫切解決的關鍵科學難題。
成果簡介
最近,中國科學技術大學俞書宏院士團隊和重慶大學羅忠教授課題組發現原位礦化組裝的碳酸鈣基Fe2+-阿霉素復合配合物可協同誘導腫瘤細胞鐵死亡和凋亡的現象。
俞書宏院士團隊基于在鈣基仿生生物材料的多年研究積累(Science 2016, 354, 107-110;Angew. Chem.Int. Ed. 2015, 54, 919;Small 2010, 6, 2436;Adv. Mater. 2005, 17, 1461等前期工作)與重慶大學羅忠教授緊密合作,構筑出生物可降解的腫瘤微環境響應性生物靶向含鐵碳酸鈣藥物組裝體,發現其能協同誘導腫瘤細胞鐵死亡和化學凋亡(圖1所示),展現出良好的臨床應用前景。
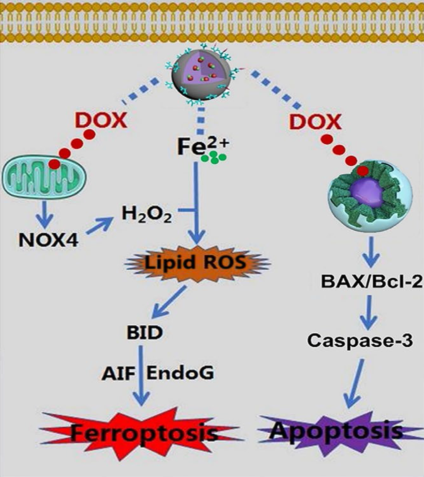
圖1. 無定形碳酸鈣納米制劑鐵死亡/化療協同誘導腫瘤細胞死亡的分子機制。
要點1:原位礦化組裝單分散的無定形含鐵碳酸鈣納米藥物組裝體
在該項研究中,研究人員首先通過控制環境介質二氧化碳濃度和pH值,調控鈣離子、二價鐵離子和阿霉素(DOX)在乙醇中的化學配位,原位礦化組裝成單分散的無定形含鐵碳酸鈣納米藥物組裝體(圖2所示)。含鐵無定形碳酸鈣藥物組裝體能在腫瘤細胞環境下自降解為鈣離子、二氧化碳、二價鐵離子和藥物分子。含鐵碳酸鈣復合組裝體在礦化組裝過程中,不引入外界其他物質,反應條件簡單,能根據個體需求實施藥物和鈣/鐵離子的精細調控和協同組合。含鐵碳酸鈣藥物組裝體的表面分級修飾PEG和葉酸分子,既提高血液循環時間并避免被免疫系統(單核吞噬細胞)識別攝入或與蛋白質發生作用,又能保護復合組裝體表面的靶向分子(葉酸)不會和體內生物分子或正常細胞發生接觸。復合組裝體通過EPR效應而遞送至腫瘤組織,微環境的MMP-2酶促使PEG從復合組裝體表面解離,暴露出葉酸分子而特異性識別腫瘤細胞,提高吞噬效率。
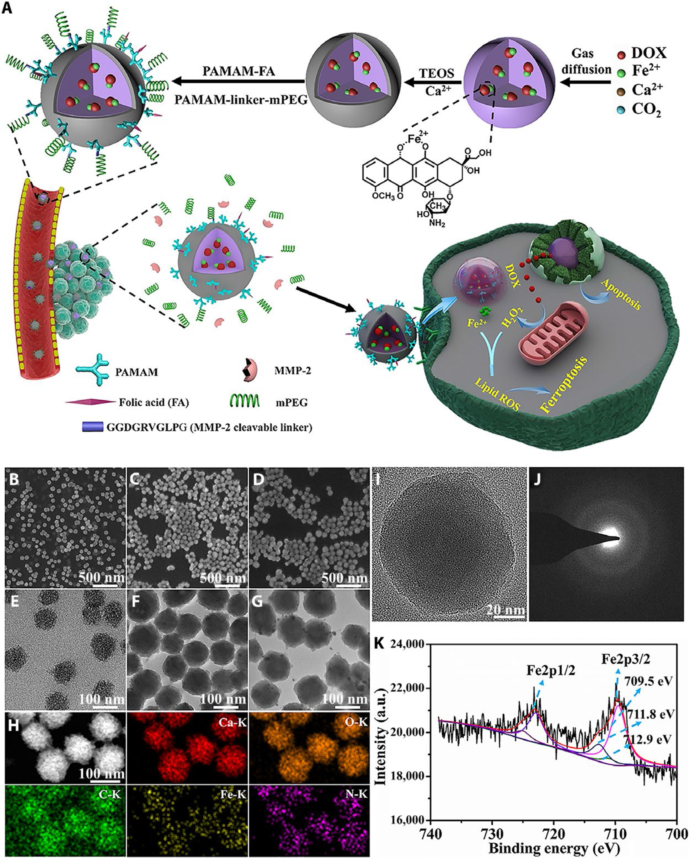
圖2. 腫瘤微環境響應性生物靶向含鐵碳酸鈣藥物組裝體的構筑及物理化學特性。
要點2:含鐵碳酸鈣藥物組裝體的藥物釋放及降解行為
含鐵碳酸鈣-阿霉素組裝體(ACC@DOX.Fe2+-CaSi-PAMAM-FA/mPEG)的抗腫瘤效應依賴于組裝體中DOX和Fe2+的釋放及其與腫瘤細胞內細胞器的相互作用。因此,研究人員考察了含鐵碳酸鈣-阿霉素組裝體在模擬體液中的釋放動力學行為(圖3)。
研究發現,無定形碳酸鈣載體在中性環境中,也極易水解,但是本研究中開發出的CaSi外殼包覆方法能顯著增強其穩定性。如圖3所示,所構筑的含鐵碳酸鈣-阿霉素組裝體置于生理環境下(pH=7.4),孵育36小時后DOX的釋放量仍然低于15%,證明其具有優異的穩定性。然而,含鐵碳酸鈣-阿霉素組裝體置于類溶酶體的酸性環境下(pH=5.5),孵育36小時后DOX的釋放量達到70%,證實具有較好的酸性響應性。電感耦合等離子體(ICP)證實Fe2+離子的釋放行為與DOX的釋放特性基本一致。透射電鏡(TEM)結果進一步證實含鐵碳酸鈣-阿霉素組裝體置于酸性環境中,24小時就可以較好的降解并呈現中空結構(圖3 C所示)。含鐵碳酸鈣-阿霉素組裝體釋放的DOX-Fe2+配合物的顏色逐漸從深紫色變為橙色,DOX的特征熒光量也明顯增加(圖2B所示)。DOX和Fe2+之間的絡合物能終止DOX的熒光效應,顏色變化和熒光恢復證實DOX-Fe2+復合物已經解離并還原為游離形式。DOX-Fe2+復合物的解離是由于DOX酸性條件下的苯酚質子化,能降低DOX化療的心臟毒性。
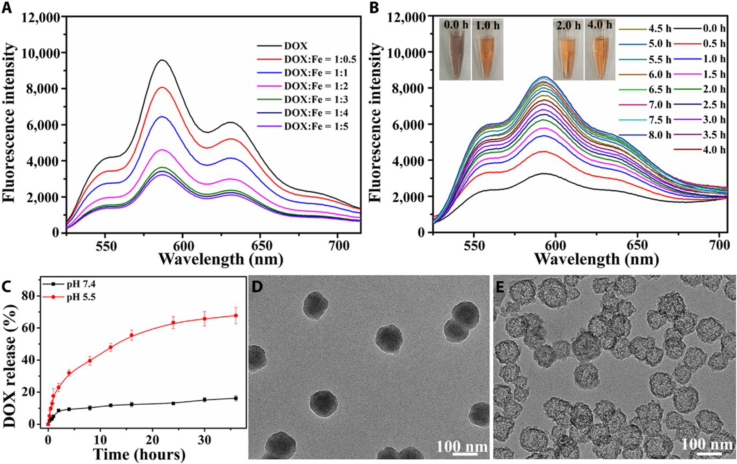
圖3. 含鐵碳酸鈣藥物組裝體的藥物釋放及降解行為。
要點3:含鐵碳酸鈣-阿霉素組裝體與腫瘤細胞的相互作用及誘導胞內脂質過氧化物的生物學效應
他們還研究了含鐵碳酸鈣-阿霉素組裝體與腫瘤細胞的相互作用及誘導腫瘤細胞產生的脂質過氧化物的生物學效應。研究發現,ACC@DOX.Fe2+-CaSi-PAMAM-FA/mPEG被金屬基質蛋白酶2(MMP-2,腫瘤組織過表達)體外刺激后,能夠暴露出葉酸分子而特異性的被腫瘤細胞所吞噬。共聚焦顯微鏡熒光分析和腫瘤細胞內ICP鐵離子測定均證實, ACC@DOX.Fe2+-CaSi-PAMAM-FA/mPEG被4T1乳腺癌細胞和黑色素瘤細胞吞噬的效率遠遠高于正常細胞(圖4 A, C)。含鐵碳酸鈣-阿霉素組裝體表面修飾的樹狀大分子賦予該組裝體具有非常強的正電荷,促使該組裝體能通過海綿效應而逃離并破壞溶酶體(圖4,B),進入細胞胞質內。生物降解出來的阿霉素和鐵離子相互作用,細胞流式(圖4,D)和共聚焦顯微鏡(圖4,E)證實其能協同高效誘導腫瘤細胞內脂質過氧化物的產生,進而破壞線粒體的膜電位(圖4F)而誘導腫瘤細胞的凋亡。
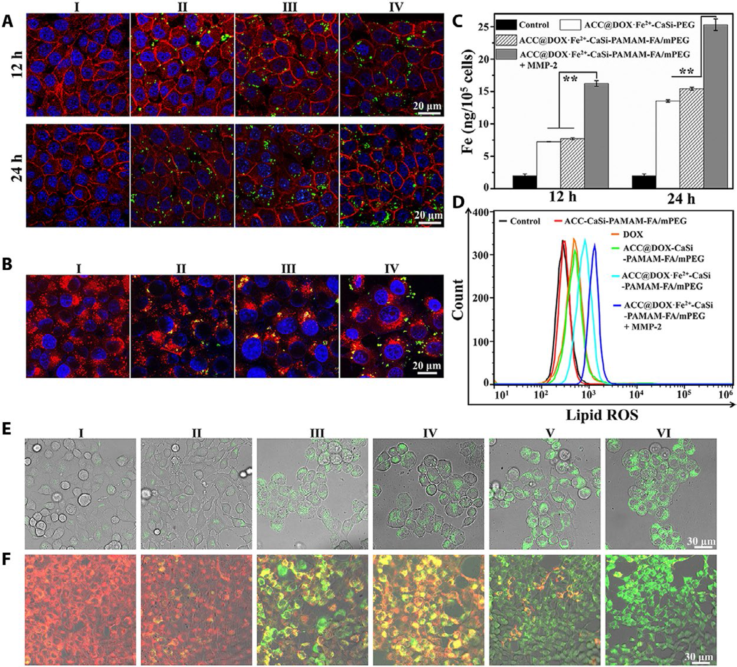
圖4. 含鐵碳酸鈣藥物組裝體與細胞的相互作用及誘導胞內脂質過氧化物的效應。
要點4:考察含鐵碳酸鈣-阿霉素組裝體誘導腫瘤細胞死亡的生物學效應及其分子機制
為了深入考察含鐵碳酸鈣-阿霉素組裝體誘導腫瘤細胞死亡的生物學效應及其分子機制,研究人員通過細胞流式、共聚焦、細胞活測定、特異性蛋白表達和DNA ladder等生物學實驗驗證其體外療效。
研究發現,ACC@DOX.Fe2+-CaSi-PAMAM-FA/mPEG被金屬基質蛋白酶2(MMP-2,腫瘤組織過表達)刺激后,能夠更加有效的誘導細胞死亡。細胞流式分析、共聚焦顯微鏡和光學顯微鏡結果表明ACC@DOX.Fe2+-CaSi-PAMAM-FA/mPEG誘導 4T1乳腺癌細胞和黑色素瘤細胞死亡的效率遠遠高于其他實驗室對照組(圖5 A,B,C,VI實驗組&其實實驗組),紅色代表細胞死亡,綠色是活細胞。隨后,通過蛋白質電泳和DNA ladder等發現阿霉素不僅能嵌入DNA抑制核酸合成,還能激活腫瘤細胞線粒體的NOX4蛋白產生雙氧水,進而與Fe2+發生相互作用而產生脂質過氧化物,誘導BID、AIF和EndoG等蛋白的表達,從而通過鐵死亡和損傷DNA 的組合效應而誘導腫瘤細胞死亡,展現出優越的臨床應用前景(圖5 D,E,F)。
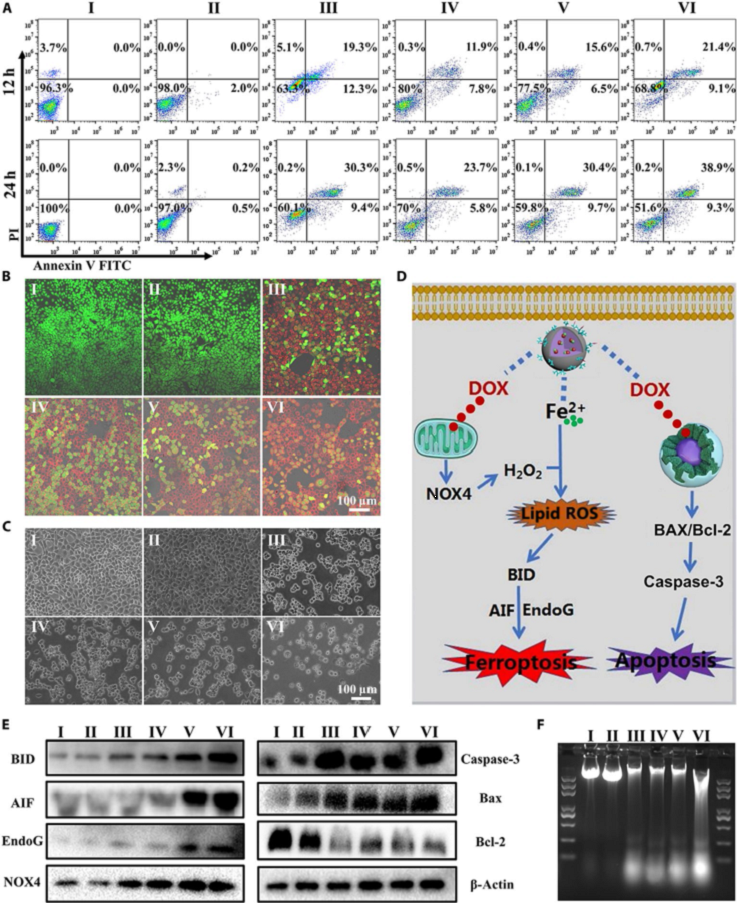
圖5. 含鐵碳酸鈣藥物組裝體體外誘導腫瘤細胞死亡效應及其分子作用機制。
要點5:考察含鐵碳酸鈣-阿霉素組裝體的體內蓄積及其靶向效應
為了進一步考察含鐵碳酸鈣-阿霉素組裝體的體內蓄積及其靶向效應,通過小動物活體成像考察了CY5標記的含鐵碳酸鈣-藥物組裝體在腫瘤組織以及體內重要組織的分布。研究結果表明,含鐵碳酸鈣-阿霉素組裝體(ACC@ DOX.Fe2+-CaSi-PAMAM-FA/mPEG)能夠更好的蓄積與腫瘤組織,其蓄積效果明顯高于其他實驗組(圖6)。這是因為PEG分子的修飾提高了含鐵碳酸鈣-阿霉素組裝體的體內循環時間;當該組裝體通過EPR效應到達腫瘤部位時,過表達的金屬基質蛋白酶2(MMP-2)能解離PEG并暴露出葉酸分子,從而提高了腫瘤組織蓄積量和腫瘤細胞的吞噬效率。

圖6. 含鐵碳酸鈣藥物組裝體的活體組織分布。
最后,研究人員還建立了4T1乳腺癌和A375黑色素瘤兩種腫瘤模型,考察了含鐵碳酸鈣-阿霉素組裝體的活體療效(圖7)。研究結果表明,含鐵碳酸鈣-阿霉素組裝體(ACC@DOX.Fe2+-CaSi-PAMAM-FA/mPEG)能夠更好的抑制活體腫瘤的生長并降低了DOX等藥物的毒副作用;患瘤老鼠經治療后,生存時間也得到了明顯的延長。研究結果證實含鐵碳酸鈣-阿霉素組裝體不僅具有很好的生物安全性和可降解性,療效也得到了最大程度的提升。
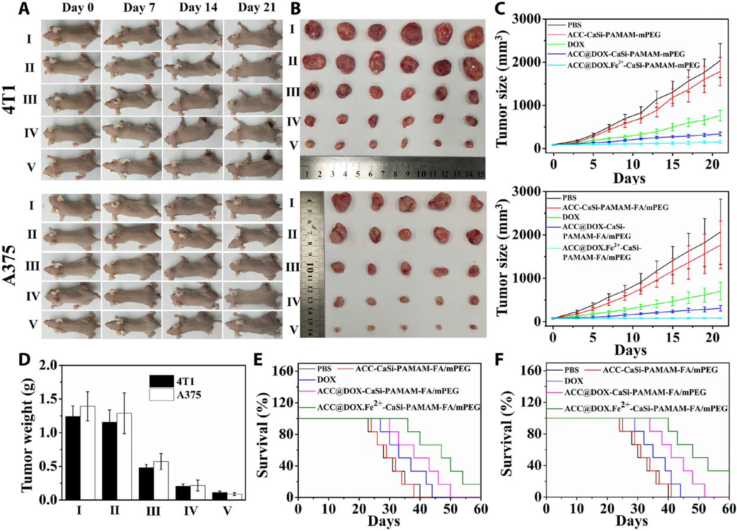
圖7. 含鐵碳酸鈣藥物組裝體的體內療效評價。
小結
阿霉素是最為經典的、廣泛應用于腫瘤臨床治療的化療藥物之一;該研究發現阿霉素和二價鐵離子的配位共傳輸能夠最大程度的增進其療效,不僅能維持其化學凋亡效應并能激發腫瘤細胞的鐵死亡,這對于今后臨床治療將具有非常重要的意義,也為其未來應用奠定了基礎。這項研究發展了通過無定形碳酸鈣和鐵離子-阿霉素的配位作用,一步法原位生長出腫瘤微環境響應性負載阿霉素-亞鐵離子的無定形碳酸鈣納米制劑,提出了靶向誘導腫瘤細胞化療凋亡和鐵死亡的協同治療策略,將具有非常重要的臨床應用前景。
論文鏈接
Chen-Cheng Xue, et al. Tumor microenvironment-activatable Fe-doxorubicin preloaded amorphous CaCO3 nanoformulation triggers ferroptosis in target tumor cells. Science Advances. 2020.
DOI: 10.1126/sciadv.aax1346
https://advances.sciencemag.org/content/6/18/eaax1346/tab-article-info











