
第一作者:Armido Studer
通訊作者:Armido Studer,Dennis P. Curran
通訊單位:明斯特大學,匹茲堡大學
核心內容:
1. 酸/堿催化和電子/空穴催化的區別和聯系。
2. 常見電子催化反應介紹。
研究背景
電子在多種自由基級聯反應中表現通過自由基/自由基離子中間體催化反應,由于電子無處不在的性質,通過電子催化的反應通常被大家所忽略。通常,電子的催化作用和氫在催化中的作用類似,“The electron is a catalyst”的概念在表觀的化學轉化過程中廣泛存在。多種自由基級聯反應,比如自由基取代反應,堿催化芳基取代反應,自由基Heck反應,自由基交叉脫氫偶聯反應,芳烴三氟甲基化反應,自由基烷氧羰基化反應等都可以歸納于電子催化反應。
常見催化反應種類:通常的催化包括酶催化,Lewis酸/堿催化,有機分子催化,過渡金屬催化,氫鍵催化。其中最簡單和基本的催化劑是氫(H+)和電子(e-),在酸/堿催化反應中加成/消除氫是普遍和有效的催化方法。
歷史上對電子催化反應的理解:現在的電子參與反應通常稱為還原反應,30年前Eberson, Chanon, Bauld等將這種過程理解為“電子傳輸催化”(Electron transfer catalysis, ETC)或“單電子引發雙分子活化”(double activation induced by single electron transfer, DAISET)。
目前光催化/電催化反應中通常可以設計為電子/空穴催化過程。
擬解決或者擬探索的關鍵問題
自由基反應控制。自由基和分子之間的反應非常快,因此反應的選擇性無法保證,會發生大量副反應。因此在催化反應過程中,電子催化通常以另外的方式進行。自由基通常情況中壽命較低,具有瞬態性和高反應活性,因此通過緩慢的生成自由基/自由基離子并引發反應是大部分反應中進行的方法。通過緩慢生成自由基,并將產生的自由基反應和消除,能夠對反應實現選擇性進行。
“電子催化”和常規催化反應的區分。作者認為一些“催化劑”的應用并未在催化循環過程中體現,這種“催化劑”的反應應該理解為電子催化反應。
成果簡介
有鑒于此,明斯特大學Armido Studer,匹茲堡大學Dennis P. Curran對酸/堿催化和電子催化進行比較,并對還原催化過程中典型電子催化反應進行總結(無過渡金屬催化Heck反應、自由基交叉脫氫偶聯反應、三氟甲基化反應、烷氧基羰基化反應)。研究發現,電子催化的過程,通過電子加成到反應物并從產物上脫除進行催化反應,電子的催化作用過程和方式和普通催化劑的作用類似。
要點1:催化反應/電子催化反應機理的區別
堿催化/空穴催化對比:總結了多種反應過程中生成帶電物種進行的反應。在通常的堿催化反應中,堿B:-通過釋放原料分子中的氫引發催化反應,并通過隨后的多步反應得到產物。與之類似,當引發反應的物種是電子而不是氫時,這種催化反應過程通常被稱為“空穴催化反應”。空穴催化過程通過原料分子在氧化劑作用中釋放電子,生成自由基中間物種。并在隨后的多步反應得到產物。常見的“空穴催化”例子:Diels-Alder周環反應。Diels-Alder周環反應通過三芳基銨陽離子氧化劑引發(Ar3N+·)。
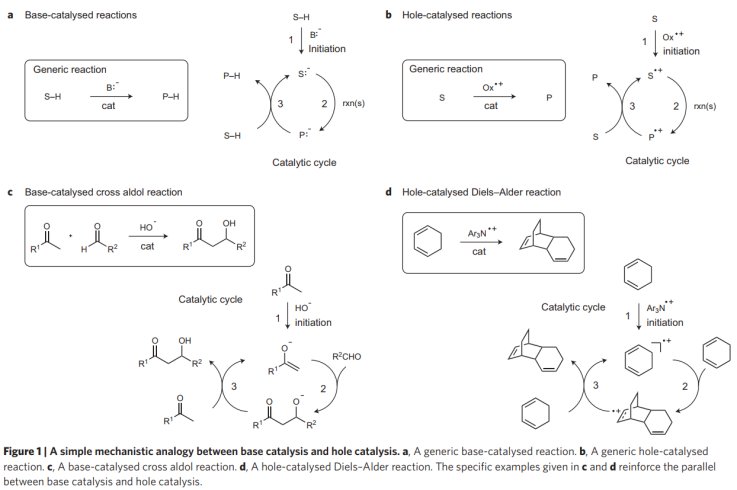
圖1. 堿催化/空穴催化反應對比。
酸催化和電子催化反應:在常見的堿催化反應過程中,中性底物在質子化后生成陽離子中間體,并隨后轉化為產物陽離子,隨后通過氫轉移過程得到產物。在電子催化反應過程中,電子通過還原劑與反應物反應,生成反應物自由基物種S·-,隨后經過單步/多步反應生成產物。通過常見的環加成作為例子進行闡述,比如[2+2]環加成反應,反應通過Na,NaI,叔丁醇鉀等引發。
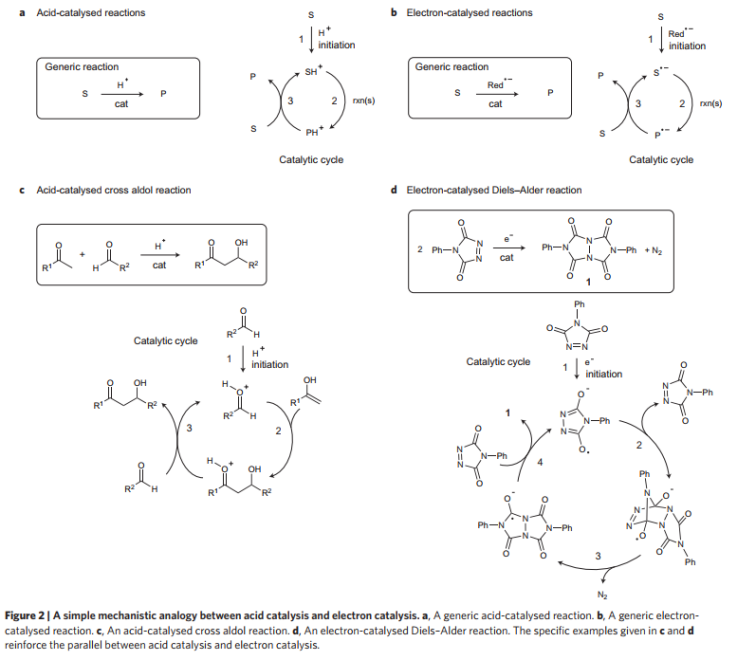
圖2. 酸催化/電子催還對比。
通過對酸/堿催化反應和還原催化反應中的機理進行比較,結果顯示酸催化過程和電子催化反應類似,堿性催化過程和空穴催化反應類似。
要點2:典型電子催化反應
自由基取代反應。對比二芳胺在NH3和光照作用中生成咔唑和傳統的分子內生成C-C鍵過程進行比較,從機理上進行區別。結果顯示,和傳統的取代反應相比,其中相同的步驟是芳基/烷基鹵代物的親電化,區別是傳統的取代反應中生成產物步驟中,產物自由基前體和另一分子原料經過電子轉移過程反應;電子驅動的取代反應中產物自由基前體釋放電子生成產物,釋放的電子會繼續進行下一輪催化反應。
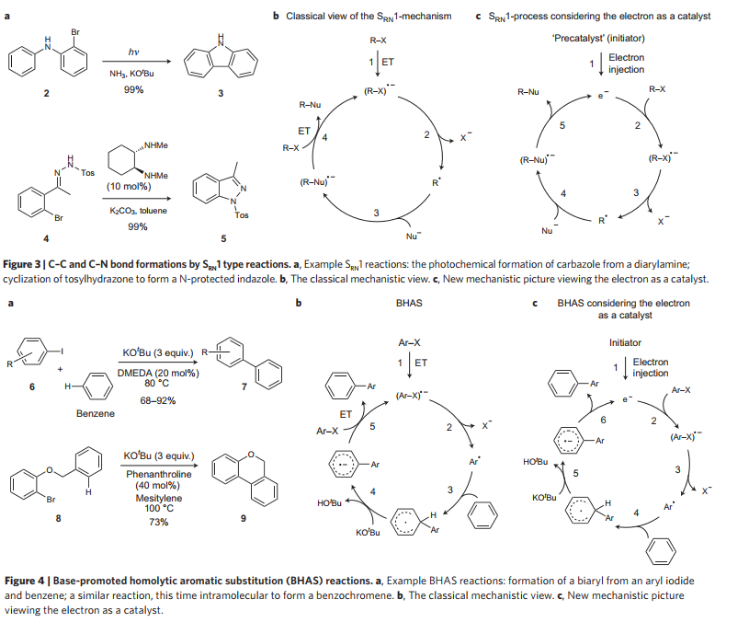
圖3. 芳烴自由基取代反應和反應機理研究。
堿促進均相芳基取代反應。無金屬催化的直接C-H鍵芳基化反應是傳統Pd/Rh催化反應的更好選擇。目前該領域較年輕,發展還處于前期。比如,通過該方法,能夠實現芳基碘化物和苯反應生成二芳基產物,通過分子間過程實現溴化物的轉化反應。2011年,直接C-H間芳基化反應的機理得到了進展,確立了“堿促進的均相芳基取代反應”。該過程中,KOtBu中的電子通過直接或間接的方法轉移到芳基鹵化物中,生成對應的芳基鹵化物自由基(Ar-X)·-,隨后生成Ar·和X-。生成的Ar·加成到芳烴上并產生環己二烯基自由基,并通過KOtBu反應生成二芳基自由基。通過將電子轉移到原料分子中,生成對應的產物。與之相比,電子引發的芳基取代反應中,引發劑產生電子并轉移到芳基化合物上,并且在最后生成產物的步驟中,產物自由基前體上的電子直接消除生成自由電子參與到下一輪催化反應中。
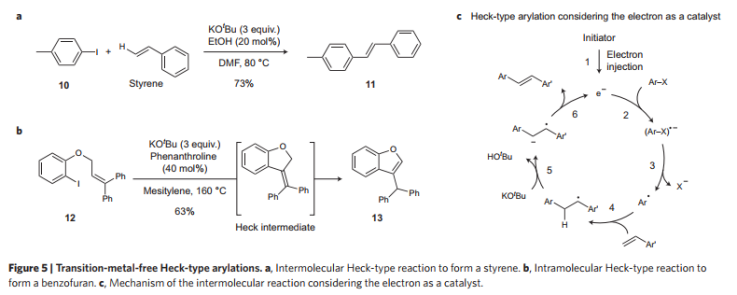
圖4. 無過渡金屬催化Heck反應。
作者對無過渡金屬催化Heck反應/自由基交叉脫氫偶聯反應/三氟甲基化反應/烷氧基羰基化反應中電子催化反應過程進行總結,發現催化過程類似,不同點在于起始步驟中和最終步驟電子的產生/流向過程。
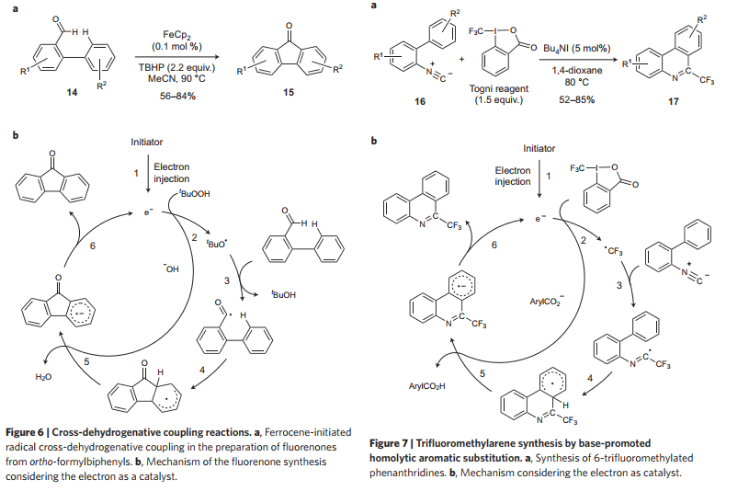
圖5. 反應底物拓展自由基交叉脫氫偶聯反應/三氟甲基化反應。
要點3:總結電子催化反應
作者從機理上對傳統電子催化反應進行研究,在這種反應過程中,自由基和陰離子中間體發生分離,并在隨后的反應中產生自由基陰離子,通過鏈傳遞過程進行下一輪催化反應,并得到對應的產物。作者認為電子催化反應的引發過程中,具有合適還原電極電勢并具有電荷傳輸能力的分子能夠引發自由基反應。作者認為一些“催化劑”的應用并未在催化循環過程中體現,這種“催化劑”的反應應該理解為電子催化反應。
要點4:反應機理的理解
對于理解電子催化反應和催化反應之間的區別。電子催化反應的發生可以通過電化學/光化學過程引發,在電化學中通過對法拉第效率和反應情況進行比較能夠很容易的理解反應是否為電子催化過程,在光反應中通過對量子效率進行測試能對反應是否為電子催化過程進行理解。“電子催化”對目前反應性較弱的反應提高催化活性、開發和設計新型反應有幫助。“電子催化”反應中,電子轉移過程(可能發生引發、終止)是關鍵步驟,從反應中可能抑制電子引發和引起終止反應過程進行分析是提高反應活性的關鍵點。
小結
電子的催化目前在光/電催化中應用廣泛,相關的工作更是受到審稿人和頂刊的青睞,這是由于電子催化的反應是更加綠色環保的過程,按照理論上來看,能達到接近~100 %的原子經濟性,并能盡量消除副反應。最近另外有一篇關于電子催化反應的綜述(Electrons and Holes as Catalysts in Organic Electrosynthesis,DOI: 10.1002/celc.201900432,https://doi.org/10.1002/celc.201900432),感興趣的話可以看一下。
參考文獻
Armido Studer, et al. The electron is a catalyst,Nature Chem 2014, 6, 765-773
DOI: 10.1038/nchem.2031
https://www.nature.com/articles/nchem.2031
作者簡介
Armido Studer教授,分別于1991年,1995年在瑞士聯邦理工學院獲得學士學位和博士學位,師從Dieter Seebach教授。曾在美國匹茲堡大學從事博士后研究工作,師從Dennis P. Curran教授。1996年開始在瑞士聯邦理工學院開展獨立工作。2000年受聘為德國菲利普斯大學副教授。2004年受聘為德國明斯特大學教授。Armido Studer教授曾獲得多項獎勵,包括Novartis Young Investigator Award in Chemistry (2006), the Solvias Ligand Contest Award (2007), and Research Award of the WWU Münsters (2014)等
主頁: https://www.uni-muenster.de/Chemie.oc/studer/studer.html
Dennis P. Curran教授,于1975年于波士頓學院(Boston College)獲得學士學位,于1979年于羅切斯特大學獲得博士學位,隨后在威斯康星大學麥迪遜分校進行博士后工作,并在1981年就職于匹斯堡大學。其主要研究領域是天然產物全合成、新型合成方法學、手性化學。
主頁:https://www.chem.pitt.edu/person/dennis-curran











