在上一期Science 期刊中(VOL 6, ISSUE 18),奇物論編輯部收集了生物(納米)材料用于治療腫瘤疾病和促進組織再生等相關的報道。
1. 俞書宏/羅忠Science Advances:仿生納米藥物誘導腫瘤細胞靶向鐵死亡(來源:納米人)
鐵死亡(Ferroptosis)是一種與傳統細胞凋亡(Apoptosis)、細胞壞死(Necrosis)及其他已知細胞死亡信號通路明顯不同的細胞死亡信號通路。最近的研究表明,鐵死亡在腫瘤的發生和發展進程中扮演著重要作用,有望發展成為一種新的癌癥治療策略。然而,如何針對腫瘤細胞實施特異性靶向鐵死亡誘導仍然是一項需迫切解決的關鍵科學難題。
最近,中國科學技術大學俞書宏院士團隊和重慶大學羅忠教授課題組發現原位礦化組裝的碳酸鈣基Fe2+-阿霉素復合配合物可協同誘導腫瘤細胞鐵死亡和凋亡的現象。
俞書宏院士團隊基于在鈣基仿生生物材料的多年研究積累(Science 2016, 354, 107-110;Angew. Chem.Int. Ed. 2015, 54, 919;Small 2010, 6, 2436;Adv. Mater. 2005, 17, 1461等前期工作)與重慶大學羅忠教授緊密合作,構筑出生物可降解的腫瘤微環境響應性生物靶向含鐵碳酸鈣藥物組裝體,發現其能協同誘導腫瘤細胞鐵死亡和化學凋亡(圖1所示),展現出良好的臨床應用前景。
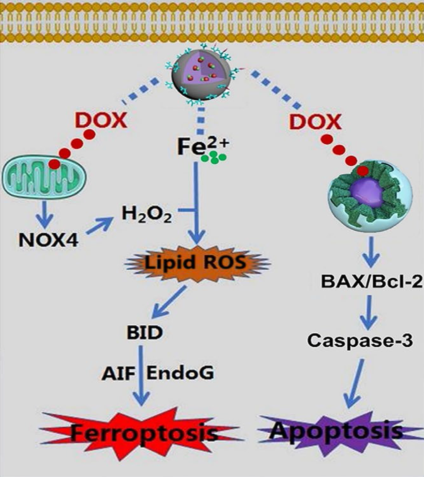
Chen-Cheng Xue, et al. Tumor microenvironment-activatable Fe-doxorubicin preloaded amorphous CaCO3 nanoformulation triggers ferroptosis in target tumor cells. Science Advances. 2020.
DOI: 10.1126/sciadv.aax1346
https://advances.sciencemag.org/content/6/18/eaax1346/tab-article-info
2. Mitragotri院士等Science Advances:用于巨噬細胞免疫治療的細胞背包(點擊深度解讀)
美國哈佛大學教授、美國工程院、醫學院雙院院士Samir Mitragotri等人創造了一種新型解決方案:為巨噬細胞背著一個可以分泌細胞因子的“背包”顆粒,使得巨噬細胞在到達腫瘤部位后,可以保持殺死腫瘤的狀態長達5天,并已經發現在具有侵襲性乳腺癌的小鼠中可以減緩腫瘤生長和減少轉移,
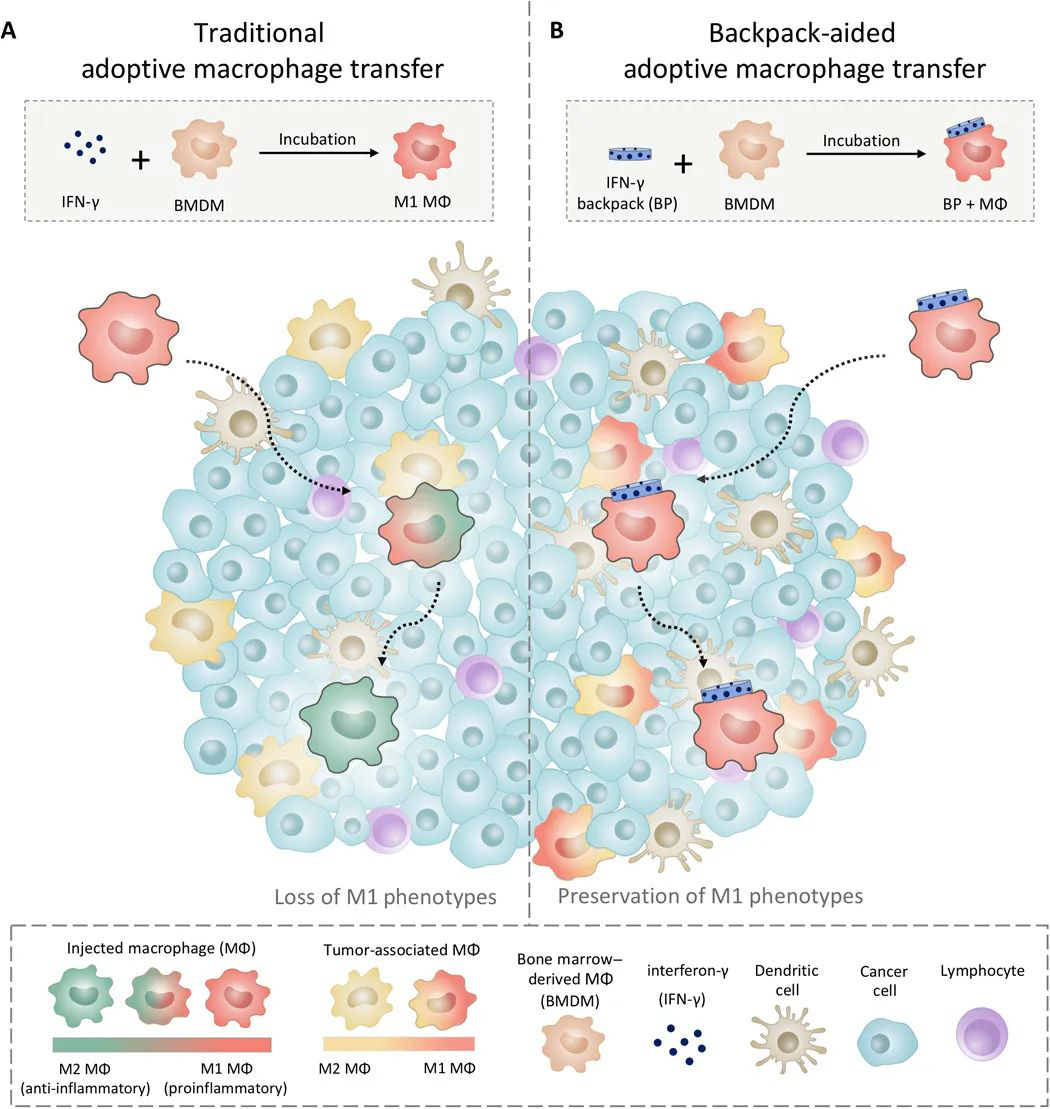
Shields C W, et al. Cellular backpacks for macrophage immunotherapy. Science Advances.2020;6(18):eaaz6579.
DOI:10.1126/sciadv.aaz6579
https://advances.sciencemag.org/content/6/18/eaaz6579
3. Science Advances:通過聚焦超聲增強腦腫瘤間質流促進腦穿透納米顆粒的分散和轉染
由于血腦屏障(BBB)和血液腫瘤屏障(BTB),將全身施用的基因療法遞送至腦腫瘤是特別困難的。另外,粘性的和納米孔的腫瘤細胞外基質阻礙治療分散。美國弗吉尼亞大學Richard J. Price和約翰霍布金斯大學Justin Hanes、Jung Soo Suk等人
本文要點:
1)首先通過遞送靶向全身施用的“腦穿透”納米顆粒(BPN)基因載體跨過BTB/BBB,開發了使用磁共振圖像(MRI)引導的聚焦超聲(FUS)和微泡作為轉染腦腫瘤的平臺方法。
2)接下來,使用基于MRI的傳輸分析,確定在FUS介導的BTB/BBB打開后,平均間隙流速幅度增加了一倍,“每體素”流動方向平均變化了約70°至80°。
3)最后,觀察到FUS介導的BTB/BBB開放使直接注射的BPN通過腫瘤組織的分散增加>100%。
由此可知,FUS介導的BTB/BBB開放性明顯增加了間質性腫瘤流量,其反過來在增強通過腫瘤組織的BPN轉運中起關鍵作用。
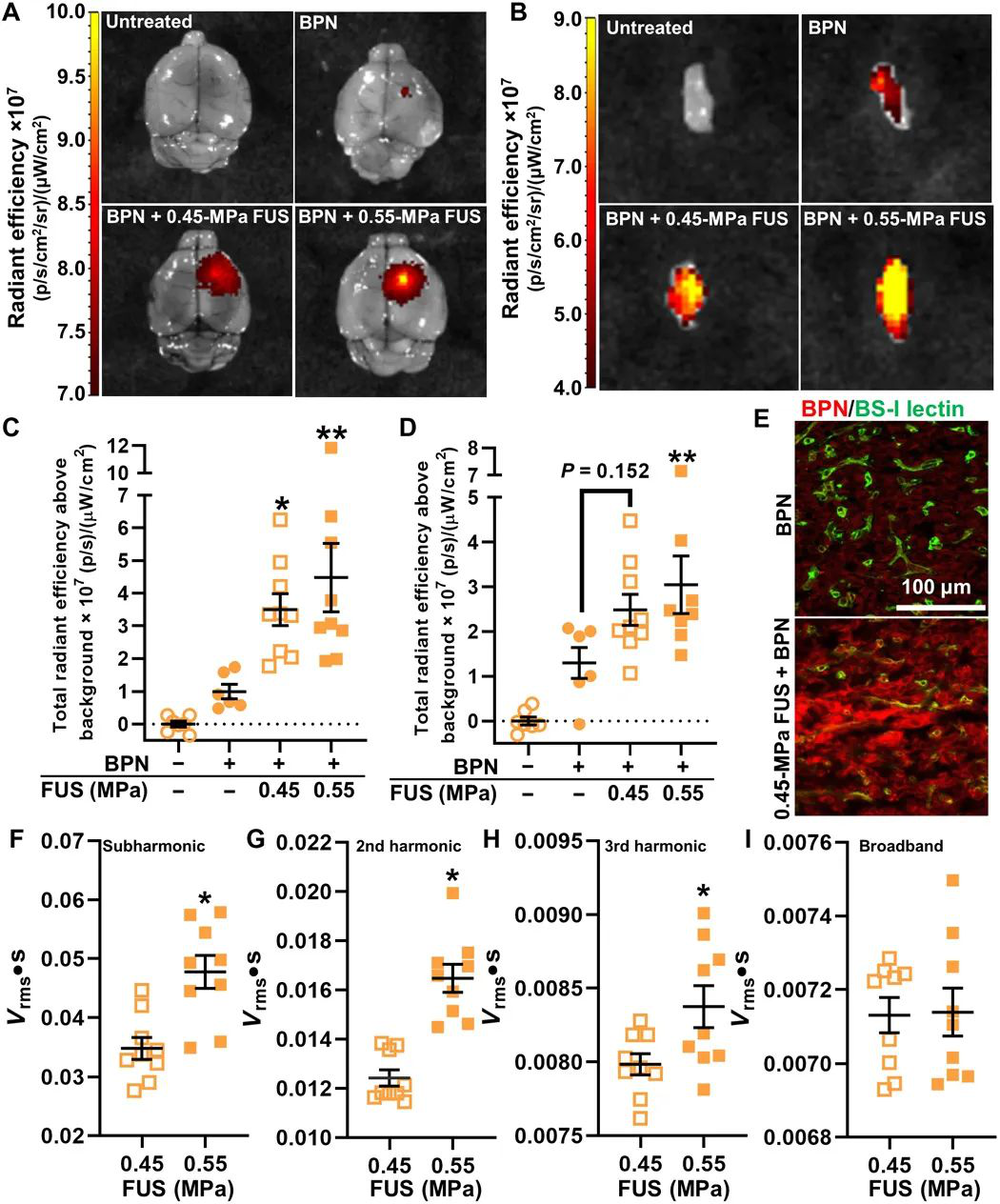
Curley CT, et al. Augmentation of brain tumor interstitial flow via focused ultrasound promotes brain-penetrating nanoparticle dispersion and transfection. Science Advances. 2020;6(18):eaay1344.
DOI: 10.1126/sciadv.aay1344
https://advances.sciencemag.org/content/6/18/eaay1344
4. Science Advances:靶向病理性膠原緩釋雷帕霉素預防異位骨化
肌腱和韌帶等結締組織中的異位骨化(HO)嚴重破壞了組織結構。HO的發病機制仍不清楚,但可能涉及mTOR(mammalian target of rapamycin,哺乳動物雷帕霉素靶蛋白,一種細胞生長和增殖的重要調節因子)。浙江大學陳曉、毛崢偉和周以侹等人開發了一種RAPA遞送系統靶向病理膠原蛋白,釋放緩釋雷帕霉素來防止異位骨化。
本文要點:
1)此處顯示的結果表明,當用基因敲除或用雷帕霉素(RAPA)處理使mTOR信號失活時,肌腱干/祖細胞不發生骨軟骨分化。同時,有必要將RAPA輸送到受傷部位,并避免干擾正常的肌腱。
2)通過使用膠原蛋白雜合肽(CHP)修飾聚乳酸-乙醇酸(PLGA)納米顆粒的表面,開發了一種RAPA遞送系統,特異性靶向于病理性肌腱膠原。CHP-PLGA-RAPA納米顆粒表現出優異的病理膠原親和力,持續釋放能力和生物活性。
3)在肌腱HO的小鼠模型中,CHP-PLGA-RAPA納米粒子與病理性肌腱特異性結合,并強烈抑制HO的進展。mTOR信號通路似乎是肌腱HO的可行治療靶標,而CHP-PLGA納米粒子可能對于治療與肌腱相關的疾病很有價值。

Chen Y, et al. Targeted pathological collagen delivery of sustained-release rapamycin to prevent heterotopic ossification. Science Advances. 2020;6(18):eaay9526.
DOI: 10.1126/sciadv.aay9526
https://advances.sciencemag.org/content/6/18/eaay9526
5. Science Advances:石墨烯量子點作為結腸炎的抗炎治療
盡管石墨烯及其衍生物在一些仿生模型中被認為是一種潛在的納米藥物,但它們在免疫紊亂中的具體作用仍然很難確定。石墨烯量子點(GQDs)具有體內毒性低、易清除等優點,可用于治療腸道疾病(IBDs)。于此,韓國首爾大學Kyung-Sun Kang和Byung Hee Hong等人采用右旋糖酐硫酸鈉(DSS)誘導的慢性和急性結腸炎模型,探索GQDs能否用于治療腸道疾病。
本文要點:
1)研究人員通過腹腔注射GQDs,證實了其有效性。特別是,GQDs通過抑制TH1/TH17極化,有效地預防組織變性,改善腸道炎癥。
2)此外,GQDs將巨噬細胞的極化從經典激活的M1轉變為M2,增強了調節性T細胞(Tregs)的腸道浸潤。因此,GQDs通過調節免疫細胞有效地減輕過度炎癥,表明它們可以作為治療自身免疫性疾病(包括IBDs)的有前景的替代治療藥物。
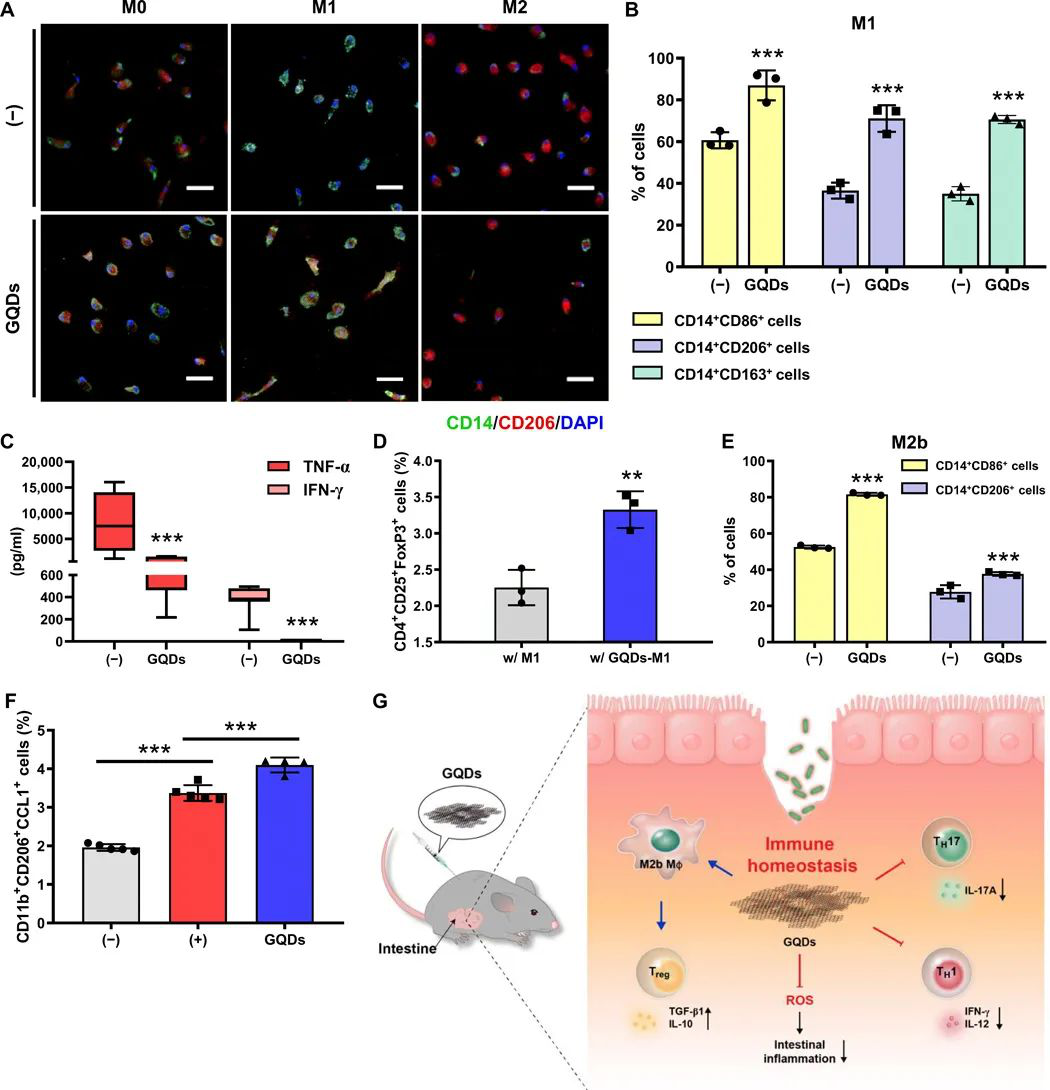
Lee B-C, et al. Graphene quantum dots as anti-inflammatory therapy for colitis. Science Advances. 2020;6(18):eaaz2630.
DOI: 10.1126/sciadv.aaz2630
https://advances.sciencemag.org/content/6/18/eaaz2630
6. Science Advances:通過增加對多藥耐藥細菌的安全性和活性來增強抗菌肽的治療指數
抗生素耐藥性的上升表明了對新型抗菌劑的迫切需求。抗菌肽(Antimicrobial peptides,AMPs)是破壞細菌膜的潛在有效療法,無論這細菌對傳統抗生素的耐藥性如何。美國匹茲堡大學Yuan-Pu(Peter) Di等人已經開發了工程化的陽離子AMP(eCAP),對多種藥物耐藥(MDR)細菌具有廣泛的活性,但是穩定性仍然是一個重要的問題。因此,該課題組尋求增強eCAP WLBU2在與呼吸道感染相關的生物基質中的臨床應用。
本文要點:
1)研究人員用D-Val設計取代L-Val導致對蛋白酶酶促降解的抗性增強。且觀察到多種功能,例如:在生物膜生長模式下對細菌具有更高的活性,與WLBU2相比,對紅細胞和白細胞的毒性顯著降低,并在小鼠中提高了安全性。
2)直接氣道遞送顯示所選對映異構體的治療指數>140,而WLBU2小于35。這些數據值得通過霧化輸送進行臨床探索,以減輕MDR相關的呼吸道感染。
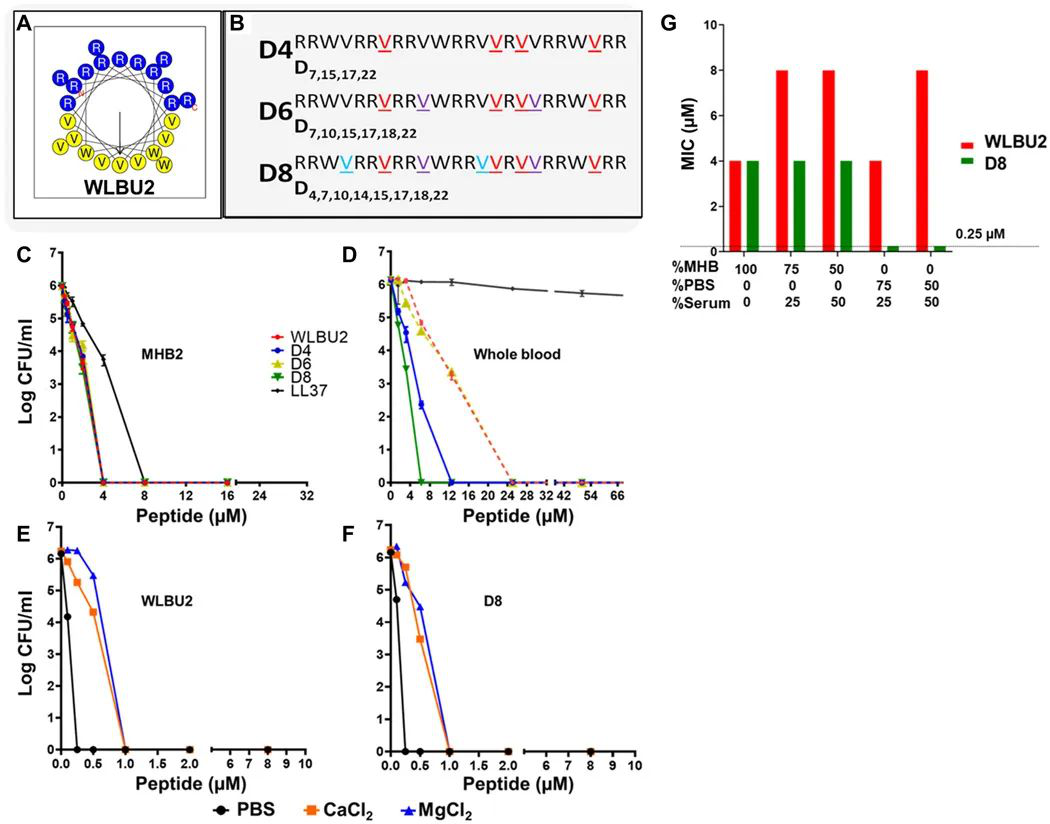
Di YP, et al. Enhanced therapeutic index of an antimicrobial peptide in mice by increasing safety and activity against multidrug-resistant bacteria. Science Advances. 2020;6(18):eaay6817.
DOI: 10.1126/sciadv.aay6817
https://advances.sciencemag.org/content/6/18/eaay6817
7. Science Advances:首次利用減毒白喉毒素介導siRNA遞送
毒素通過與細胞表面配體結合,啟動內吞作用并將內溶酶體途徑逃逸到細胞質中,從而有效地將貨物運送至細胞。加拿大多倫多大學Molly S. Shoichet等人利用這種傳遞途徑,將減毒白喉毒素與siRNA結合,從而在患者來源的膠質母細胞瘤細胞中實現基因下調。
本文要點:
1)研究人員遞送了針對整合素β1(ITGB1)(一種促進侵襲和轉移的基因)的siRNA,以及針對真核翻譯起始因子3亞基b(eIF-3b)(一種存活基因)的siRNA。
2)證明了這兩個基因的mRNA下調和相應的功能結果:用創新的3D水凝膠模型顯示ITGB1的敲低導致對侵襲的顯著抑制;eIF-3b的敲低導致明顯的細胞死亡。這是首例利用白喉毒素來遞送siRNA,并且首次顯示了基于毒素的siRNA遞送策略在癌細胞中誘導相關的基因型和表型效應。
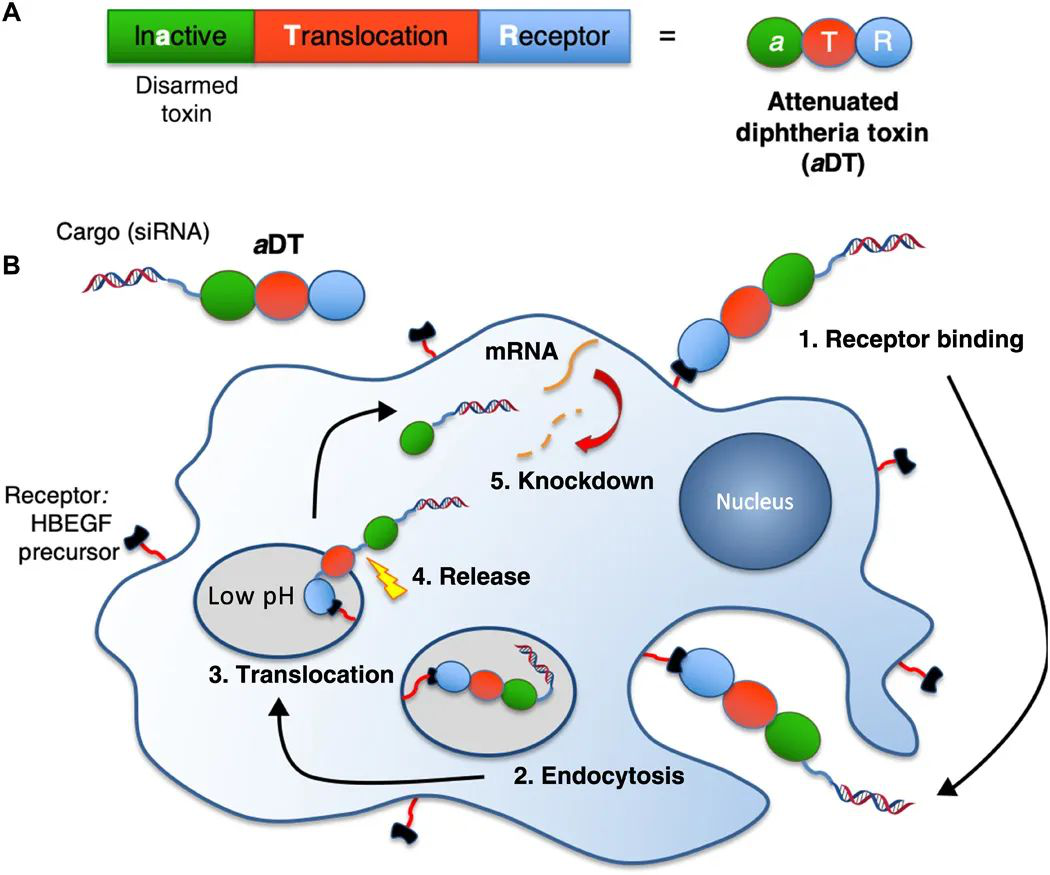
Arnold AE, Smith LJ, Beilhartz G, Bahlmann LC, Jameson E, Melnyk R, et al. Attenuated diphtheria toxin mediates siRNA delivery. Science Advances. 2020;6(18):eaaz4848.
DOI: 10.1126/sciadv.aaz4848
https://advances.sciencemag.org/content/6/18/eaaz4848
8. Science Advances:氧化鐵納米顆粒結合的間充質干細胞來源的納米囊泡用于心臟修復
由于間充質干細胞(MSC)治療的植入性差和安全性問題,MSC來源的外泌體已成為心肌梗死(MI)的一種替代性無細胞治療方法。然而,注射后外泌體從梗死心臟擴散出去和低生產力限制了其臨床應用的潛力。在此,韓國首爾國立大學Byung-Soo Kim、韓國加圖立大學Hun-Jun Park等人開發了由氧化鐵納米顆粒(IONPs) 結合的MSCs (IONP-MSCs) 衍生的模擬外泌體細胞外納米囊泡(NVs)。
本文要點:
1)注射的IONP-MSC來源的NVs(IONP-NVs)在梗死心臟內的滯留在磁引導下明顯增加。
2)此外,IONPs顯著增加了IONP-MSCs和IONP-NVs的治療分子水平,從而減輕了人們對外泌體生產力低下的擔憂。
3)在梗死心臟內注射IONP-NVs和磁引導可使心肌早期從炎癥期向修復期轉變,減少細胞凋亡和纖維化,促進血管生成和心功能恢復。這種方法可以提高MSC來源的NV治療的療效。
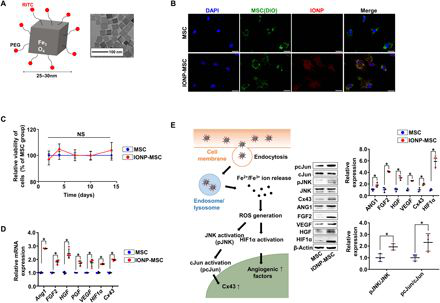
Ju-Ro Lee, et al. Nanovesicles derived from iron oxide nanoparticles–incorporated mesenchymal stem cells for cardiac repair, Science Advances, 2020.
DOI: 10.1126/sciadv.aaz0952
https://advances.sciencemag.org/content/6/18/eaaz0952
9. Science Advances:超分子前藥水凝劑可作為免疫增強劑
免疫檢查點阻斷劑(ICB)在利用免疫系統對抗癌癥方面顯示出巨大的潛力。然而,只有一小部分患者可以直接從抗程序性細胞死亡蛋白1(aPD1)治療中獲益,并且這種治療常常導致與免疫相關的不良反應。在這種情況下,美國約翰霍普金斯大學Honggang Cui和Fengyi Wan等人開發了一種用于局部遞送ICBs的前藥水凝膠劑,以增強宿主的抗腫瘤免疫系統。
本文要點:
1)研究人員發現這種無載體的治療系統可以作為一個儲庫,用于延長喜樹堿和aPD1抗體的腫瘤釋放,從而形成一個促進PD-1阻斷免疫應答的免疫刺激腫瘤微環境。
2)體內實驗結果表明,這種聯合化療免疫療法能誘導機體產生強大而持久的抗腫瘤免疫,誘導腫瘤消退,抑制腫瘤復發和轉移。這項工作為使用小分子前藥作為化療藥和載體喚醒和增強抗腫瘤免疫系統提供了重要的啟示,從而改善了ICBs療法。

Wang F, et al. Supramolecular prodrug hydrogelator as an immune booster for checkpoint blocker–based immunotherapy. Science Advances. 2020;6(18):eaaz8985.
DOI: 10.1126/sciadv.aaz8985
https://advances.sciencemag.org/content/6/18/eaaz8985
10. Science Advances:不同表型的巨噬細胞驅動工程組織的血管化
巨噬細胞是血管形成的關鍵因素,但其作用機制尚不清楚。于此,美國德雷塞爾大學K. L. Spiller和以色列理工學院S. Levenberg等人發現不同的巨噬細胞表型對內皮細胞行為有不同的影響,從而對工程組織的血管化產生影響。
本文要點:
1)在Transwell共培養中,促炎M1巨噬細胞導致內皮細胞上調與發芽血管生成相關的基因,而促愈合(M2a)、促重塑(M2c)和抗炎(M2f)巨噬細胞則促進與周細胞分化相關的基因的上調。
2)在體外三維組織工程人血管網絡中,短時間(1天)暴露于M1巨噬細胞可增加血管形成,而長時間(3天)暴露可導致血管消退。
3)當將人體組織工程血管網絡植入無胸腺小鼠中時,表達M1和M2表型標記的巨噬細胞包裹并橋接相鄰血管,并自身形成血管樣結構。最后,宿主巨噬細胞的耗竭抑制了工程血管的重塑,宿主血管的浸潤以及宿主血管的吻合。
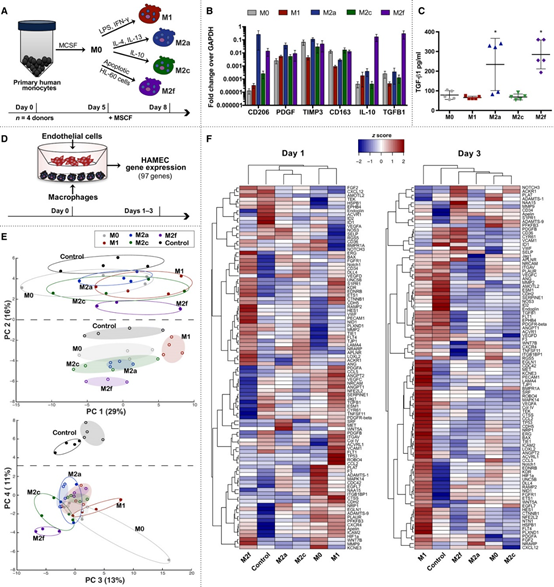
Graney PL, et al. Macrophages of diverse phenotypes drive vascularization of engineered tissues. Science Advances. 2020;6(18):eaay6391.
DOI: 10.1126/sciadv.aay6391
https://advances.sciencemag.org/content/6/18/eaay6391
11. Science Advances:檢查點抑制劑免疫治療晚期癌癥患者臨床預后的數學預測
美國休斯敦衛理公會研究所Vittorio Cristini和德州大學安德森癌癥中心Eugene J. Koay等人提出了一個免疫檢查點抑制劑治療的機械數學模型,以滿足腫瘤患者對免疫治療反應早期、廣泛適用的讀出(生物標記物)的需求。
本文要點:
1)該模型建立在免疫系統和癌癥之間復雜的生物和物理相互作用的基礎上,并且僅使用照護標準CT即可獲知。研究人員回顧性地將該模型應用于245例接受抗CTLA-4或抗PD-1/PD-L1抗體治療的患者。發現,模型參數清楚地識別了那些從這些單一療法中受益和未受益的常見(n=18)和罕見(n=10)惡性腫瘤類型的患者,在首次再分期(中位數53天)的準確率高達88%。
2)此外,這些參數成功地將假進展與真進展區分開來,為假進展的獨特生物物理學特征提供了先前未被確認的見解。該數學模型為個體化腫瘤學和工程免疫治療方案提供了一個臨床相關的工具。
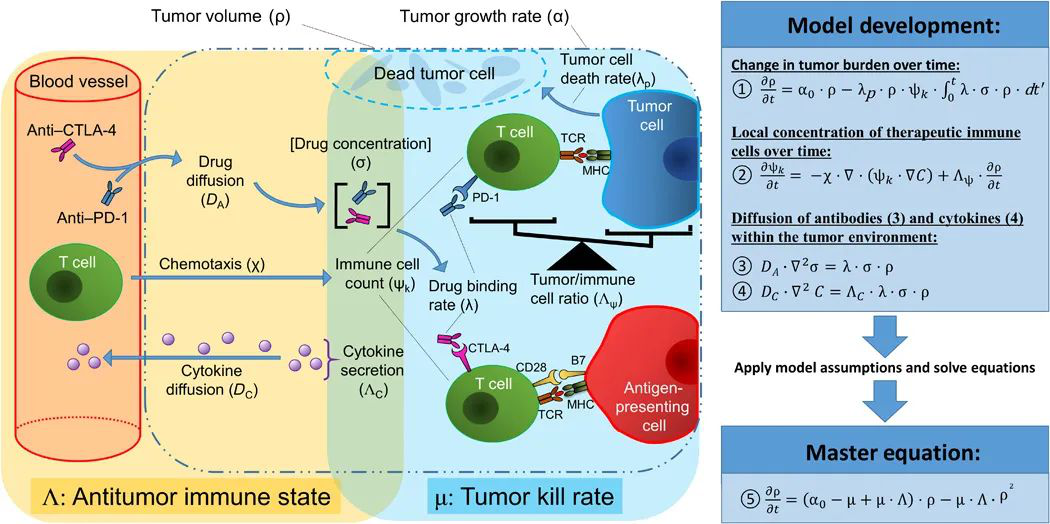
Butner JD, et al. Mathematical prediction of clinical outcomes in advanced cancer patients treated with checkpoint inhibitor immunotherapy. Science Advances. 2020;6(18):eaay6298.
DOI: 10.1126/sciadv.aay6298
https://advances.sciencemag.org/content/6/18/eaay6298











