第一作者:Shengyi Yan
通訊作者:Qiuling Song、譚斌
通訊單位:華僑大學、南方科技大學
研究亮點:
1. 作者使用BINOL衍生的亞磷酰胺作為手性配體,實現了首例銅催化的萘基偶氮化合物與芳基硼酸的邁克爾型加成反應。
2. 該反應具有良好的阻轉異構選擇性,可以高效且廣泛構筑單一軸手性的聯芳化合物。
3. 這一催化體系成功抑制了常規的1,2加成并促進了芳基-芳基手性軸的形成。與此同時,此策略避免了氧化劑的使用以及過渡金屬介導的芳烴碳氫鍵與芳基硼酸酯偶聯所需的苛刻條件,提供一種直接獲得軸手性聯芳基化合物的方法。
構建軸向手性聯芳基化合物發展挑戰
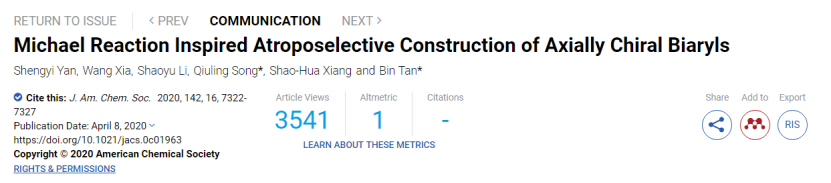
軸手性聯芳基骨架不僅在生物活性天然產物,藥物和尖端材料中廣泛存在,還在各種炙手可熱的手性配體和催化劑中構成了其必不可少的手性元素。在這些發展的策略中,鈀催化不對稱 Suzuki?Miyaura偶聯反應已被廣泛應用于構建非C2對稱的聯芳基阻轉異構體(圖 1a)。此外,過渡金屬催化的芳烴碳氫鍵與芳基硼酸的芳基化反應由于避免了預官能團化,提高了反應的原子經濟性,因此被認為是更有前景的一種選擇(圖1b)。盡管Yamaguchi, Itami等人嘗試通過鈀催化實現噻吩和芳基硼酸酯的交叉偶聯,但是該策略的不對稱轉化仍處于起步階段。而且這種偶聯方法需要外源性氧化劑,較高的反應溫度來活化低活性芳烴,這兩個條件都可能抑制對映體的軸手性控制。因此對這種策略而言,一種更加高效的軸手性轉化路徑亟待發展。
自Hayashi課題組的開創性工作之后,不少課題組已經廣泛探索了過渡金屬催化的有機硼化物對α,β-不飽和化合物的對映選擇性邁克爾加成反應。這些邁克爾受體是主要來自于不同形式的共軛烯烴,卻因為去芳構化的高能磊而很少涉及芳香型邁克爾受體。這種反應策略將提供統一解決上述提及的Suzuki型芳烴碳氫鍵與芳基硼酸的氧化偶聯中的問題,避免外源型氧化劑可以直接將兩個芳環組裝在一起得到單一軸手性的化合物(圖1c)。
成果簡介
近日,南方科技大學的譚斌教授報道了首例溫和的條件下銅催化的偶氮萘與芳基硼酸酯的對映選擇性邁克爾加成反應,該成果發表于近期J. Am. Chem. Soc.
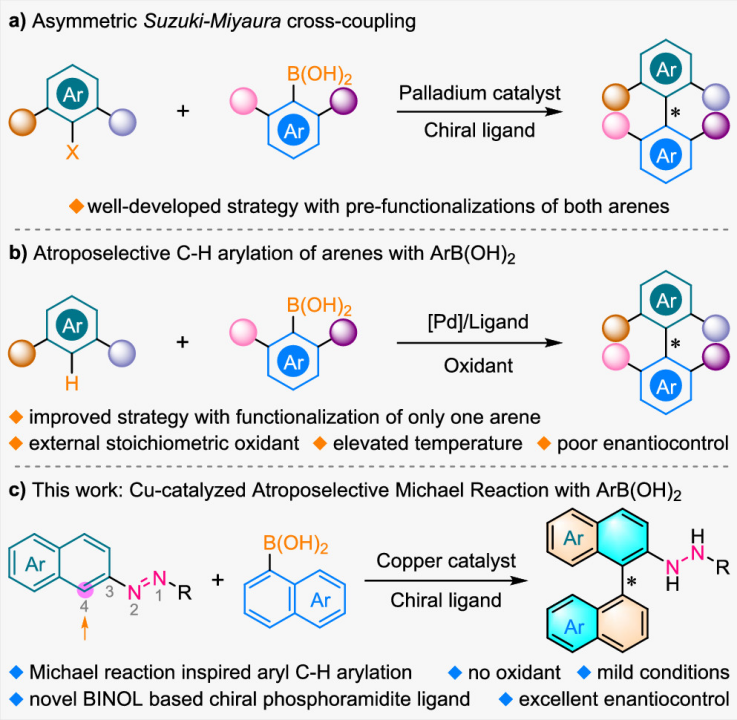
圖1. 對映選擇性金屬催化構建軸向手性聯芳基化合物的代表性策略用(圖片來源:J. Am. Chem. Soc.)。
要點1:提出合理的反應機理
根據先前有關銅介導的對映選擇性芳基硼酸共軛加成的報道以及作者對不對稱構筑阻轉異構聯芳基化合物的持續理解,作者提出來一個合理的反應機理(圖2):芳基硼酸經過轉金屬產生金屬有機化合物A,然后與萘基偶氮化合物1絡合生成中間體B。偶氮基團的活化作用以及與金屬中心的絡合作用協同增強化合物1萘環的親電性,這使得去芳構化的邁克爾加成得以順利進行。在此過程中,手性亞磷酰胺配體誘導產生了化合物C的手性。最后,從中心到軸向手性快速轉移得到了單一軸手性的聯芳基阻轉異構體,并且實現催化劑再生。
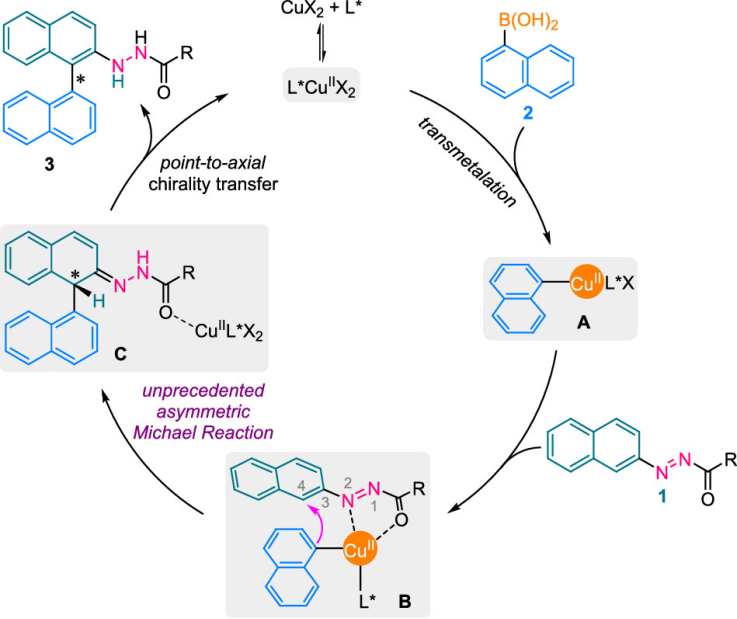

圖2. 設計的反應機理(圖片來源:J. Am. Chem. Soc.)。
要點2:實驗篩選手性配體
為了驗證該假設的可行性,作者選擇偶氮萘衍生物1a,1-萘基硼酸(2a)作為模型底物。經過一些初步試驗,作者發現當Cu(OTf)2作為催化劑,BINOL衍生的手性亞磷酰胺L115為配體,KHCO3為堿,在DCM溶劑中室溫下反應16個小時之后,反應以71:29的er值得到30%目標產物(圖3)。作者緊接著篩選了不同取代BINOL骨架(圖3,L1-L10)發現碘代的配體(L10)優于其他常用芳基化合物取代基并給出較高的產率和中等對映選擇性(80:20 er)。隨后,作者用不同的胺制備了一系列亞磷酰胺構架,篩選發現L19表現最為優異。
圖3. 手性配體的篩選(圖片來源:J. Am. Chem. Soc.)。
要點3:測試偶氮萘衍生物的底物兼容性
確定最佳反應條件后,作者首先測試了偶氮萘衍生物的底物兼容性(圖4)。和芐酯、芴甲氧羰基酯和甲酯相比,乙酯和異丙酯產率更高:。含溴的底物通常與常規鈀催化的不對稱Suzuki-Miyaura交叉偶聯反應不兼容,但是在該轉化中卻有很好的兼容性。不同電子效應取代基中,給電子基團有利于該反應(3g,3j和3k)。
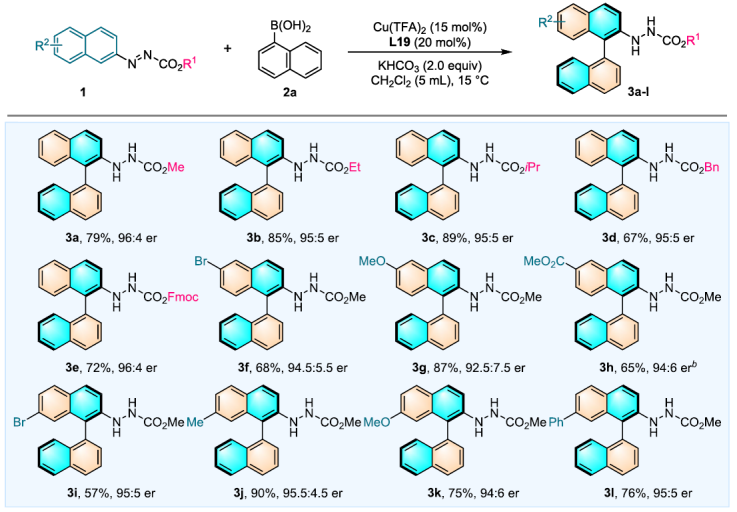
圖4. 偶氮萘衍生物的底物適用性測試(圖片來源:J. Am. Chem. Soc.)。
要點4:研究芳基硼酸的底物適用性
作者接下來又研究了芳基硼酸的底物范圍(圖5)。不僅各類型的芳基硼酸能參與反應。萘基硼酸,吡啶基硼酸作為邁克爾供體時也能高效參與反應當(圖5,3s,3u,3v,3t)該反應同時存在一定局限性,異喹啉基硼酸和鄰位取代的1-萘基硼酸酯無法參與轉化。
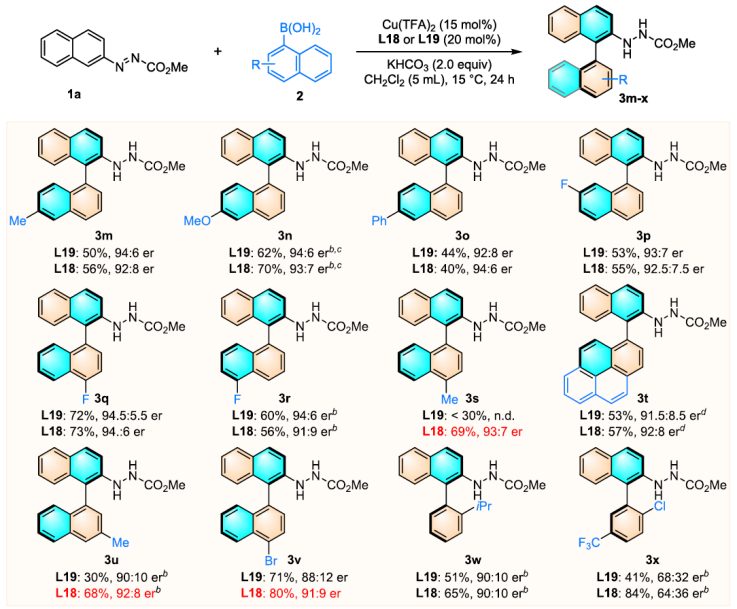
圖5. 芳基硼酸的底物適用性測試(圖片來源:J. Am. Chem. Soc.)。
要點5:克級合成證明方法的實用性
為了證明這種方法的合實用性,作者成功實現進行了克級合成。為了進一步拓展該反應的效用,軸向手性2-氨基聯萘4可以輕松地轉化為一系列聯芳基骨架的配體,催化劑和其他功能分子(圖6)。
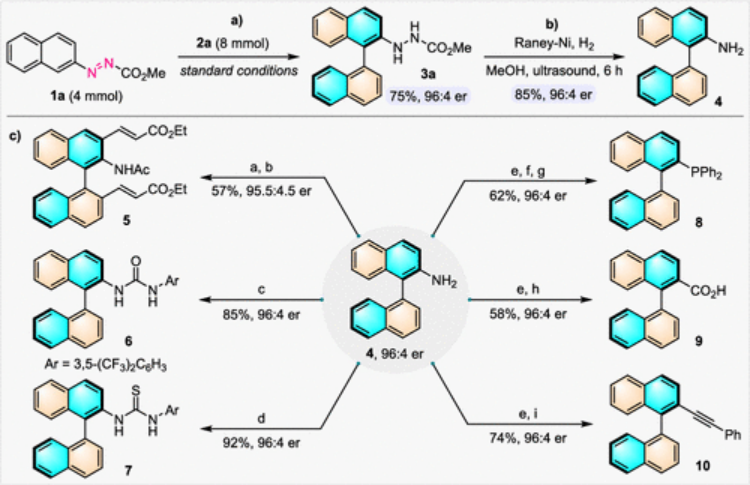
圖6. 克級反應和反應產物衍生化應用(圖片來源:J. Am. Chem. Soc.)。
小結
譚斌課題組成功實現了首例溫和的條件下銅催化的偶氮萘與芳基硼酸酯的對映選擇性邁克爾加成反應。新穎的BINOL衍生的手性亞磷酰胺配體經驗證具有優良的軸手性對映體控制效果。該策略將為合成含芳基結構阻轉異構體提供新的選擇。
參考文獻
Yan S, Li S, Song Q, et al. Michael Reaction Inspired Atroposelective Construction of Axially Chiral Biaryls. Journal of the American Chemical Society, 2020.
DOI: 10.1021/jacs.0c01963
https://pubs.acs.org/doi/abs/10.1021/jacs.0c01963











