隨著人們?nèi)找嬖鲩L(zhǎng)健康的需求,生物功能性材料不僅為材料涉及領(lǐng)域提供應(yīng)用啟發(fā),更為人類生命健康提供廣闊的應(yīng)用前景,作為交叉領(lǐng)域,生物功能材料方面沒(méi)有明確的分類,涵蓋非常廣泛,但可以抓住“功能”和“仿生”兩詞,來(lái)對(duì)相關(guān)的材料進(jìn)行物理化學(xué)和應(yīng)用研究。
于此,奇物論編輯部針對(duì)近年來(lái)發(fā)表在Nature、Science上的與生物功能性材料相關(guān)的進(jìn)行歸納總結(jié),供大家學(xué)習(xí)和交流。具體內(nèi)容涉及:遞送材料、可穿戴設(shè)備、3D打印、人工器官、水凝膠、蛋白質(zhì)工程等領(lǐng)域。(注:由于學(xué)識(shí)有限,如有表述不當(dāng)或選文有誤,還望批評(píng)指出!)
1. Science:可口服自定向系統(tǒng)用于遞送大分子
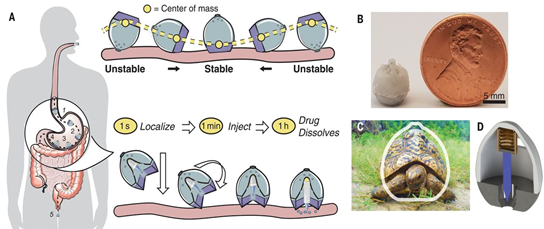
生物大分子改變了我們有效治療疾病的能力;然而,它們的快速降解和在胃腸道中的吸收差通常限制了其以腸胃外途徑給藥。口服生物給藥系統(tǒng)必須有助于定位和滲透,以實(shí)現(xiàn)全身性藥物吸收。受豹龜被動(dòng)重新定向的能力啟發(fā),麻省理工學(xué)院Robert Langer和Giovanni Traverso等人開發(fā)了一種可口服的自定向的給藥器(SOMA),它可以從任何起始位置自行重新定向,從而附著在胃壁上,同時(shí)避免穿孔。研究人員在大鼠和豬中進(jìn)行了體內(nèi)研究,以證明其安全性,并使用胰島素作為模型藥物,表明SOMA提供的活性藥物成分血漿水平可與皮下注射后達(dá)到的水平相媲美。
2. 鮑哲南等Science:功能材料實(shí)現(xiàn)在動(dòng)物體內(nèi)靶向聚合組裝【點(diǎn)擊查看深度解讀】
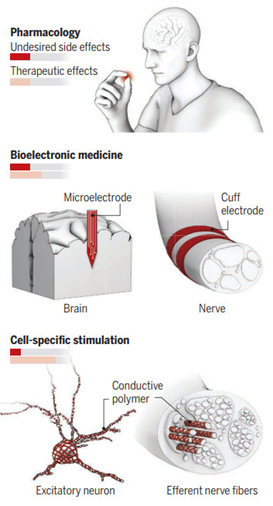
常用的導(dǎo)電聚合物包括聚(3,4-乙撐二氧噻吩(PEDOT),聚苯胺(PANI)和聚吡咯。導(dǎo)電聚合物傳統(tǒng)上是作為獨(dú)立的生物材料合成的,可用于培養(yǎng)細(xì)胞或體內(nèi)植入,將導(dǎo)電聚合物整合到組織中。而已報(bào)道的電活性材料和正在開發(fā)的可注射神經(jīng)界面都尚未能靶向特定細(xì)胞的。
有鑒于此,斯坦福大學(xué)光遺傳學(xué)之父Karl Deisseroth和鮑哲南院士等人展示了根據(jù)特定細(xì)胞類型制造的聚苯胺(PANI)導(dǎo)電聚合物的體內(nèi)聚合,并改變了細(xì)胞膜的電性能。在活細(xì)胞、組織和動(dòng)物體內(nèi)的基因特定的細(xì)胞元素上實(shí)現(xiàn)了電活性聚合物的化學(xué)組裝。這種方法可以在生物系統(tǒng)中創(chuàng)建多樣化、復(fù)雜和功能化的結(jié)構(gòu)和材料。
LiuJ, et al. Genetically targeted chemicalassembly of functional materialsinliving cells, tissues, and animals.Science. 2020;367(6484):1372-6.
https://science.sciencemag.org/content/367/6484/1372
3. 鮑哲南Science:納米限域助力可穿戴電子器件!
可穿戴電子器件是科幻小說(shuō)中未來(lái)科技產(chǎn)物的代表。多年研究發(fā)現(xiàn),電子器件隨著人體運(yùn)動(dòng)而發(fā)生變形,這就要求可穿戴電子器件同時(shí)具有優(yōu)異的力學(xué)性能和電學(xué)性能。電子器件中大部分半導(dǎo)體材料都是基于Si,這種剛性材料在彎曲時(shí)很容易就折斷了。雖然通過(guò)精確控制三維形狀可提高Si電子器件的柔性,有可能實(shí)現(xiàn)可穿戴。但是,高昂的成本使得柔性可穿戴Si電子器件難以最終實(shí)現(xiàn)商業(yè)化。
以共軛聚合物為代表的有機(jī)半導(dǎo)體,則為可拉伸電子器件的發(fā)展帶來(lái)了光明。這些共軛高分子由相同重復(fù)單元通過(guò)單雙鍵交替形成的長(zhǎng)鏈組成,離域的π電子確保其導(dǎo)電性。雖然已經(jīng)可以制備出和Si的導(dǎo)電性相當(dāng)?shù)墓曹椌酆衔铮窃谄骷用妫瑢?dǎo)電性還是會(huì)有所下降。
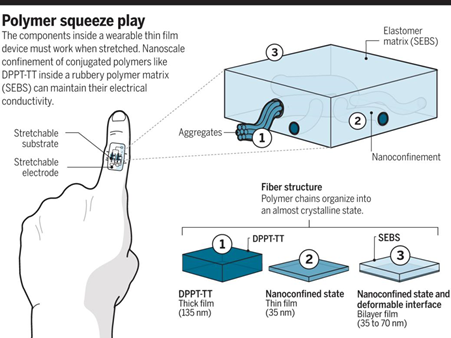
如何在器件層面實(shí)現(xiàn)高度可拉伸性和高導(dǎo)電性是可穿戴電子器件面臨的一個(gè)主要問(wèn)題。有鑒于此,斯坦福大學(xué)鮑哲南等人報(bào)道了一種對(duì)半導(dǎo)體聚合物進(jìn)行納米限域的方法,利用納米尺寸效應(yīng)和界面效應(yīng)使導(dǎo)電高分子在器件層面的力學(xué)性能和導(dǎo)電性同時(shí)得到增強(qiáng)。
本文要點(diǎn)
要點(diǎn)1. 研究人員通過(guò)相分離的方法將納米纖維狀的導(dǎo)電高分子限域包裹于納米尺度的三維高彈性橡膠基質(zhì)中。納米纖維由于團(tuán)聚形成的相互連接,具有良好的導(dǎo)電性。同時(shí),納米纖維和變形橡膠之間的界面作用避免了裂縫蔓延。
要點(diǎn)2. 研究表明,納米限域效應(yīng)起到增強(qiáng)分子動(dòng)力學(xué)、抑制結(jié)晶的作用。納米尺寸效應(yīng)和界面效應(yīng)力學(xué)性能和導(dǎo)電性同時(shí)得到增強(qiáng),制成的柔性電子器件在雙軸拉伸度100%的情況下仍然具有和非晶硅相當(dāng)?shù)膶?dǎo)電性。基于以上發(fā)現(xiàn),研究人員制備了一種仿皮膚的手指可穿戴電子器件模型。
利用基礎(chǔ)研究對(duì)納米限域效應(yīng)的認(rèn)識(shí),解決了柔性電子器件中力學(xué)性能和電學(xué)性能的平衡問(wèn)題,并將對(duì)電子皮膚的進(jìn)一步發(fā)展提供借鑒。不管是這種研究方法,還是這項(xiàng)重量級(jí)成果,都是值得學(xué)習(xí)的!
JieXu, Sihong Wang, Jong WonChung, Zhenan Bao et al. Highly stretchable polymersemiconductor films throughthe nanoconfinement effect. Science 2017, 355,59-64.
DOI:10.1126/science.aah4496
https://science.sciencemag.org/content/355/6320/59
4. 鮑哲南/徐文濤等Science:讓機(jī)器人有觸覺(jué)
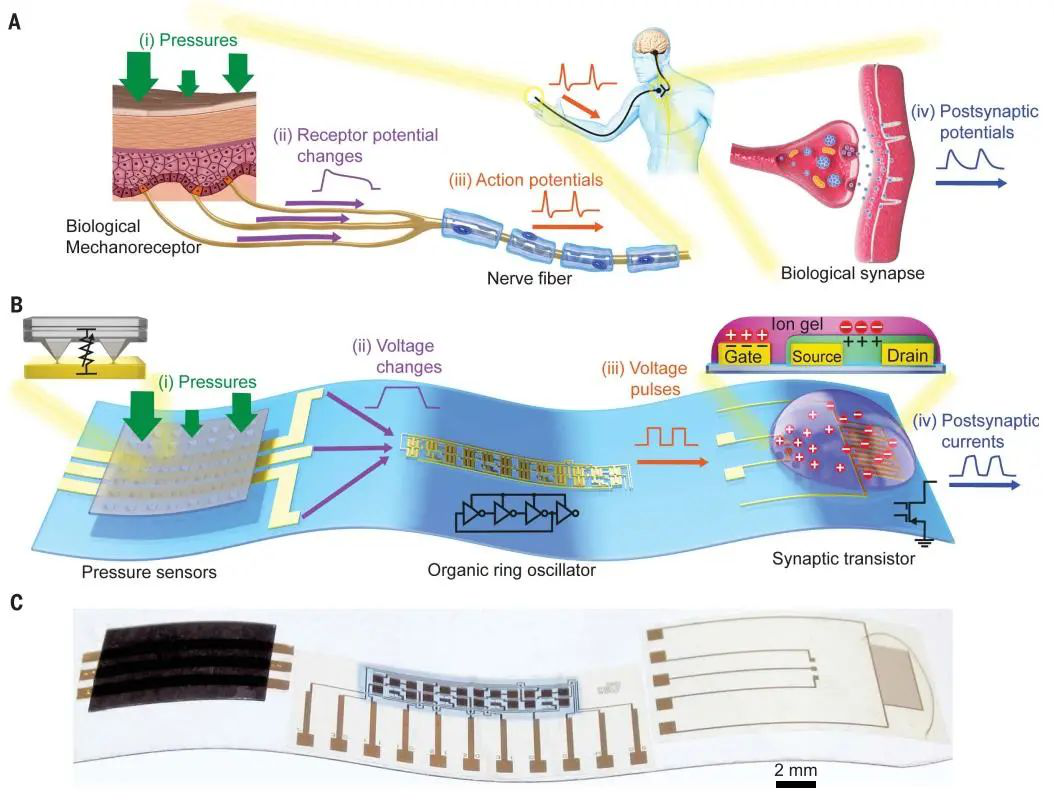
如果說(shuō)機(jī)器人和人類之間最本質(zhì)的區(qū)別,那就是七情六欲以及感官知覺(jué)了。斯坦福大學(xué)鮑哲南、首爾大學(xué)Tae-Woo Lee以及南開大學(xué)徐文濤團(tuán)隊(duì)合作報(bào)道了一種基于柔性有機(jī)電子器件的高靈敏度仿生觸覺(jué)神經(jīng)系統(tǒng),可以從多個(gè)觸感接收器接受信息,然后將這種信息運(yùn)輸?shù)絺鞒觯R達(dá))神經(jīng),完成一種復(fù)合的生物電子反射弧。這種人工神經(jīng)觸覺(jué)系統(tǒng)具有高靈敏度,即便是蟑螂腿的運(yùn)動(dòng),也能快速感知。
Yeongin Kim, et al. Abioinspired flexibleorganic artificial afferent nerve. Science 2018, 360,998-1003.
https://science.sciencemag.org/content/360/6392/998
5. Science:可穿戴柔性透明觸摸屏出爐!
作為計(jì)算機(jī)的顯示窗口,透明觸摸屏,無(wú)論是在大型的信息交互面板領(lǐng)域,還是在新一代手機(jī)領(lǐng)域,都變得越來(lái)越不可或缺。現(xiàn)代社會(huì),人與計(jì)算機(jī)的關(guān)系越來(lái)越親密,科幻電影中不乏將觸摸屏集成到人體的例子,這也是未來(lái)科技發(fā)展的趨勢(shì)。然而,現(xiàn)有觸摸屏大多是基于硬質(zhì)或易碎電極材料制備,不具有可拉伸性和生物兼容性,難以很好地實(shí)現(xiàn)將觸摸屏集成到人體的想法。
有鑒于此,Kim等人利用含LiCl的聚丙烯酰胺水凝膠(經(jīng)水膨脹的交聯(lián)高分子材料)發(fā)明了一種柔性可拉伸的、高透明度的、具有生物兼容性的離子觸摸屏。
本文要點(diǎn):
要點(diǎn)1. 這種水凝膠具有較好的柔性,可以在大幅拉伸變形的同時(shí)保持觸摸靈敏度。研究人員利用表面電容式觸摸系統(tǒng)來(lái)辨別觸摸位置,實(shí)現(xiàn)了在1000%區(qū)域應(yīng)變條件下的正常功能性操作。
要點(diǎn)2. 由于水凝膠是透明的,觸摸屏對(duì)可見光的透光率達(dá)到98%,可以有效傳遞光學(xué)信息。其中,LiCl用于增強(qiáng)導(dǎo)電性。
要點(diǎn)3. 進(jìn)一步,研究人員在皮膚上集成了一種表皮觸摸屏,可用于寫字、彈琴和打游戲等功能操作,實(shí)現(xiàn)了觸摸屏的可穿戴功能。
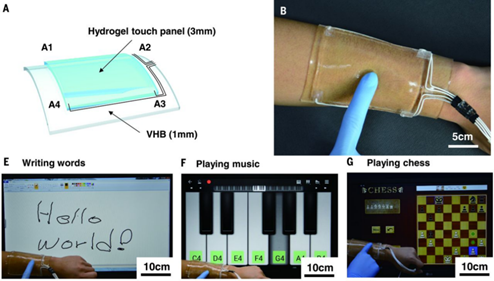
Chong-ChanKim1,et al. Highly stretchable, transparentionic touch panel. Science 2016,353, 682-687.
DOI:10.1126/science.aaf8810
https://science.sciencemag.org/content/353/6300/682
6. Nature:首次實(shí)現(xiàn)將復(fù)雜的觸摸感融合到VR和AR中
VR/AR的一個(gè)重要未來(lái)在于發(fā)展一種全面的、身臨其境的體驗(yàn),這種體驗(yàn)不僅包括交互式圖像和聲音,還包括觸摸感。具有這類多感官能力的技術(shù)將產(chǎn)生深遠(yuǎn)的影響,涉及領(lǐng)域從社交媒體和通信到游戲和娛樂(lè),再到臨床醫(yī)學(xué)、康復(fù)和恢復(fù)。
皮膚是人體最大的器官,機(jī)械感受器分布在皮膚和真皮層內(nèi),構(gòu)成我們與世界物理交互作用的基礎(chǔ)。具體來(lái)說(shuō),對(duì)皮膚上力的時(shí)空模式的響應(yīng)會(huì)作為信號(hào)傳遞到大腦,這些信號(hào)定義了我們對(duì)周圍環(huán)境的機(jī)械感覺(jué)。然而,由感覺(jué)受體檢測(cè)到的刺激被編碼成電信號(hào),該信號(hào)沿著神經(jīng)通路移動(dòng)到大腦的特定部位,然后被解碼成有用的信息。整個(gè)過(guò)程非常復(fù)雜。例如,觸摸感是包括壓力、疼痛和溫度在內(nèi)的多種感覺(jué)的集合,且觸覺(jué)感受器更由機(jī)械、化學(xué)和熱能的組合所刺激。 然而,到目前為止,將觸摸感融合到VR和AR中一直是一個(gè)巨大的挑戰(zhàn)。
有鑒于此,美國(guó)西北大學(xué)黃永剛院士和John A·Rogers院士等人首次實(shí)現(xiàn)將復(fù)雜的觸摸感融合到VR和AR中。他們發(fā)展了一種無(wú)線,無(wú)電池的電子系統(tǒng)平臺(tái)和觸覺(jué)界面,能夠輕柔地層壓在皮膚的曲面上,以通過(guò)時(shí)空可編程的局部機(jī)械振動(dòng)模式來(lái)傳遞信息。觸覺(jué)致動(dòng)器通過(guò)無(wú)線供電和控制,以及能壓層貼合任何類型皮膚,使其具有低耗能和安全便捷性。研究團(tuán)隊(duì)詳細(xì)描述了用作此類平臺(tái)基礎(chǔ)所使用的材料,設(shè)備結(jié)構(gòu),功率傳輸策略和通信方案。由此產(chǎn)生的技術(shù)創(chuàng)造了許多使用機(jī)會(huì),如通過(guò)在社交媒體和個(gè)人參與、假肢控制和反饋、游戲和娛樂(lè)中的應(yīng)用,皮膚向身體提供電子可編程通信和感官輸入通道。
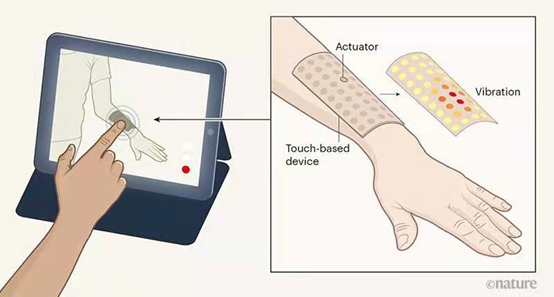
Yu,X., et al. Skin-integrated wireless haptic interfaces for virtualandaugmented reality. Nature 2019,575, 473–479.
https://www.nature.com/articles/s41586-019-1687-0
7. Nature:用于光遺傳學(xué)調(diào)節(jié)末梢神經(jīng)的無(wú)線閉環(huán)系統(tǒng)
快速發(fā)展的生物電子醫(yī)學(xué)領(lǐng)域旨在設(shè)計(jì)出通過(guò)刺激末梢神經(jīng)系統(tǒng)從而緩解臨床癥狀的裝置系統(tǒng)。這類技術(shù)很大程度上依賴于電流刺激來(lái)提供器官功能/疼痛的神經(jīng)調(diào)節(jié)。一個(gè)典型的例子是骶神經(jīng)電刺激——用于治療膀胱過(guò)動(dòng)癥,尿失禁以及間質(zhì)性膀胱炎(也稱膀胱疼痛綜合征)。傳統(tǒng)的連續(xù)刺激方法可能導(dǎo)致不舒適和疼痛感,特別是治療間歇性癥狀時(shí)(例如突發(fā)性尿急)。將電極直接物理連接到神經(jīng)上可能會(huì)導(dǎo)致患者受傷和產(chǎn)生炎癥。此外,典型刺激手段瞄準(zhǔn)了較大的神經(jīng)束,而神經(jīng)束由多重結(jié)構(gòu)組成,因此這些刺激不具有器官特異性。
有鑒于此,華盛頓大學(xué)圣路易斯分校Robert W. Gereau IV和美國(guó)西北大學(xué)John A. Rogers等人設(shè)計(jì)了一種微型生物光電植入裝置,該裝置通過(guò)以下手段避免了上述問(wèn)題:1. 利用微米尺度無(wú)機(jī)發(fā)光二極管來(lái)刺激視蛋白的光刺激界面;2. 允許連續(xù)測(cè)量器官功能的柔性高精度生物物理傳感器系統(tǒng);3. 能使系統(tǒng)協(xié)調(diào)閉環(huán)運(yùn)行,實(shí)時(shí)消除病理行為的控制模組和數(shù)據(jù)分析方法。在本文所報(bào)道的例子中,柔性應(yīng)變儀可對(duì)小鼠膀胱功能進(jìn)行實(shí)時(shí)監(jiān)測(cè);數(shù)據(jù)算法可以識(shí)別出病理行為,自動(dòng)化閉環(huán)光遺傳學(xué)可對(duì)膀胱感覺(jué)傳入進(jìn)行神經(jīng)調(diào)節(jié),使膀胱功能正常化。這種全光神經(jīng)調(diào)節(jié)方案提供了長(zhǎng)期穩(wěn)定性和刺激特定類型細(xì)胞的潛力。

Mickle, A.D., Won, S.M., Noh, K.N. et al. A wireless closed-loopsystemfor optogenetic peripheral neuromodulation. Nature 565, 361–365(2019)doi:10.1038/s41586-018-0823-6
https://www.nature.com/articles/s41586-018-0823-6
8. Science:DNA納米手臂
DNA折紙術(shù)可以將DNA組裝成各種不同的形狀,但是這并不能使之成為納米機(jī)器。如何使這種DNA組裝結(jié)構(gòu)動(dòng)起來(lái),才能真正成為納米機(jī)器人。德國(guó)慕尼黑工業(yè)大學(xué)Friedrich C. Simmel課題組開發(fā)了一種電場(chǎng)遙控的DNA納米手臂。他們DNA折紙平板作為基底,通過(guò)短鏈DNA將一個(gè)長(zhǎng)長(zhǎng)的DNA螺旋束(DNA手臂)固定在DNA基底上。當(dāng)DNA分子浸泡在水溶液緩沖液中時(shí),會(huì)帶一定的電荷。因此,通過(guò)足夠的電場(chǎng)作用力就可以控制DNA手臂在DNA面板上的定向旋轉(zhuǎn)。
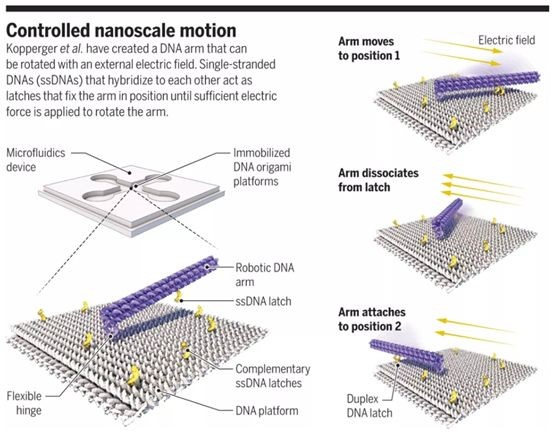
Enzo Kopperger, JonathanList,Friedrich C. Simmel et al. A self-assembled nanoscale robotic armcontrolled byelectric fields. Science 2018, 359, 296-301.
https://science.sciencemag.org/content/359/6373/296.full
9. Science:無(wú)規(guī)雜聚物保護(hù)蛋白質(zhì)在外界環(huán)境的功能
天然蛋白質(zhì)結(jié)合了一系列有用的特征,包括化學(xué)多樣性、在預(yù)先編程的形狀之間快速切換的能力以及結(jié)構(gòu)層次。美國(guó)加州大學(xué)伯克利分校徐婷教授等人利用蛋白質(zhì)中發(fā)現(xiàn)的許多特征,設(shè)計(jì)了具有極性和非極性基團(tuán)的無(wú)規(guī)共聚物。它們的結(jié)構(gòu)可以作為“廣譜”表面活性劑,能夠促進(jìn)蛋白質(zhì)在有機(jī)溶劑中的溶解,并有助于保持蛋白質(zhì)在水環(huán)境中的功能。
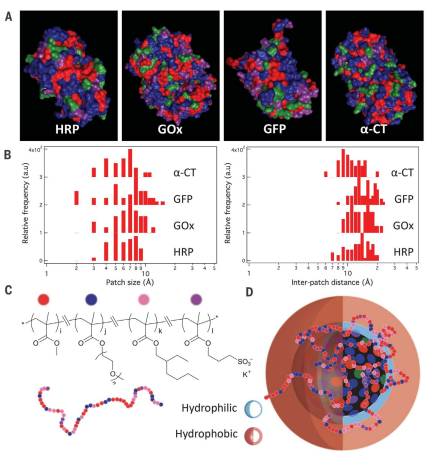
PanganibanB, et al. Random heteropolymers preserve protein function in foreignenvironments. Science. 2018;359(6381):1239-43.
DOI:10.1126/science.aao0335
https://science.sciencemag.org/content/359/6381/1239
10. Science:可編程CRISPR響應(yīng)智能材料
美國(guó)麻省理工學(xué)院James J. Collins等人在Science發(fā)表文章,報(bào)道了一種CRISPR關(guān)聯(lián)核酸酶控制的DNA水凝膠,該水凝膠的功能可根據(jù)用戶自定義的目標(biāo)核酸序列進(jìn)行調(diào)整。這類刺激響應(yīng)材料可用于小分子的可控釋放、電子設(shè)備的控制以及與微流體設(shè)備結(jié)合實(shí)現(xiàn)病毒的檢測(cè)。譚蔚泓院士等人對(duì)此進(jìn)行點(diǎn)評(píng)和展望。
JamesJ. Collins等人創(chuàng)造性地將CRISPR-Cas (CRISPR-associated)系統(tǒng)整合到DNA水凝膠中,提高了反應(yīng)靈敏度。具體來(lái)說(shuō),CRISPR-Cas12a技術(shù)包含一個(gè)目標(biāo)DNA效應(yīng)物核酸酶Cas12a以及互補(bǔ)的向?qū)NA (gRNA)間隔序列。在該系統(tǒng)中,堿基配對(duì)成功能夠激活Cas12a核酸酶,進(jìn)而切割目標(biāo)雙鏈DNA(dsDNA)或任意單鏈DNA(ssDNA)。通過(guò)在水凝膠系統(tǒng)內(nèi)部構(gòu)建Cas12a-gRNA和目標(biāo)dsDNA匹配對(duì),可以獲得一個(gè)智能、通用、多功能、靈敏的水凝膠系統(tǒng)。
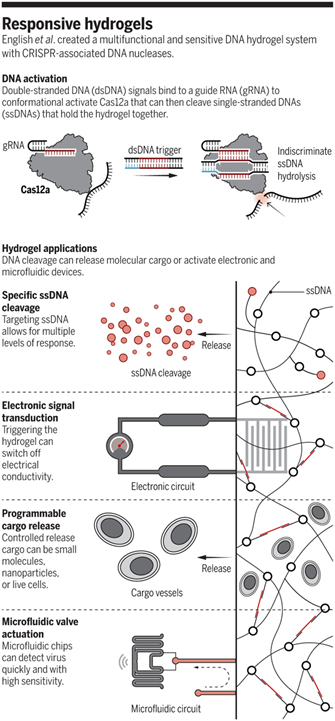
MaxA. English, et al. Programmable CRISPR-responsive smart materials. Science.2019
DOI:10.1126/science.aaw5122
https://science.sciencemag.org/content/365/6455/780
11.龔劍萍Science:?jiǎn)l(fā)于健身肌肉,該水凝膠可自增強(qiáng)
自愈性聚合物試圖在變形后恢復(fù)機(jī)械強(qiáng)度。聚合物凝膠往往太軟,無(wú)法發(fā)生這種情況。日本北海道大學(xué)龔劍萍教授和TasukuNakajima等人制備了由雙網(wǎng)絡(luò)材料組成的自愈性水凝膠。機(jī)械應(yīng)力破壞了兩個(gè)網(wǎng)絡(luò)中更脆弱的部分,而另一個(gè)網(wǎng)絡(luò)則保持穩(wěn)定。斷裂時(shí),斷裂的鏈產(chǎn)生自由基引發(fā)劑,聚合新的網(wǎng)絡(luò)材料。隨著重復(fù)的網(wǎng)絡(luò)斷裂和單體的供應(yīng),凝膠變得更強(qiáng)。
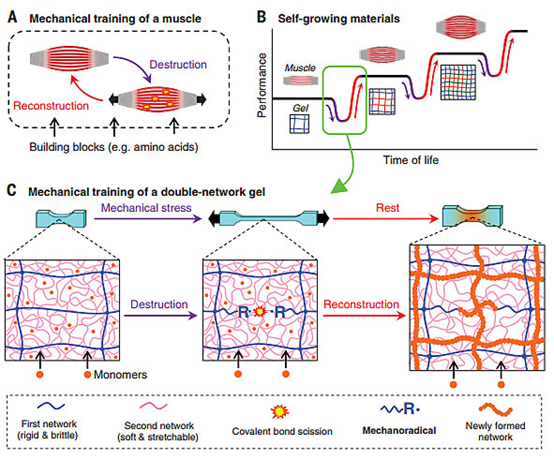
TakahiroMatsuda, et al. Mechanoresponsive self-growing hydrogels inspired by muscletrainingScience, 2019, 363, 504-508.
DOI:10.1126/science.aau9533
https://science.sciencemag.org/content/363/6426/504
12. Science:收縮凝膠實(shí)現(xiàn)納米材料三維組裝!
3D打印技術(shù)雖然已經(jīng)能適用于大量材料,但是實(shí)現(xiàn)納米尺度的精確控制依然并非易事。麻省理工學(xué)院的Edward S. Boyden團(tuán)隊(duì)及其合作者發(fā)展了一種全新的三維納米加工策略,利用可收縮的凝膠實(shí)現(xiàn)了多功能的三維納米制造。研究人員首先通過(guò)光學(xué)方法對(duì)聚丙烯酸酯/聚丙烯酰胺水凝膠進(jìn)行三維圖案化處理,然后引入金屬、半導(dǎo)體、生物分子等功能材料,最后經(jīng)過(guò)脫水處理,體積縮小10倍后得到納米尺度的三維組裝體。
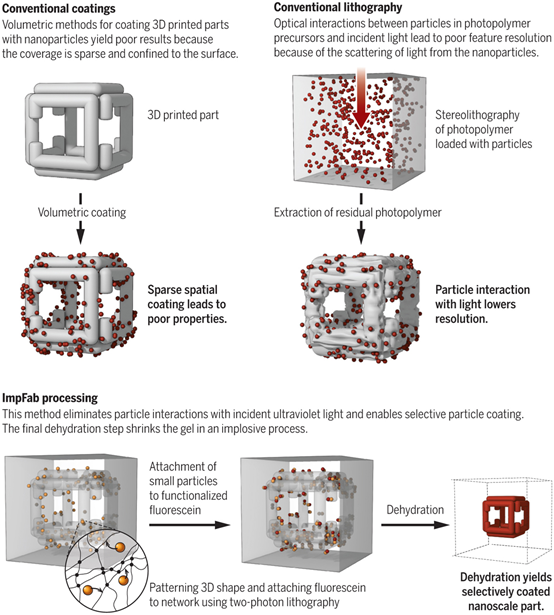
OranD, Rodriques S G, Tillberg P W, et al.3D nanofabrication by volumetricdeposition and controlled shrinkage ofpatterned scaffolds[J]. Science, 2018.
DOI:10.1126/science.aau5119
http://science.sciencemag.org/content/362/6420/1281
13. Science:3D生物打印膠原蛋白重建心臟
美國(guó)卡內(nèi)基梅隆大學(xué)A. W. Feinberg等人基于自由可逆懸浮水凝膠包埋(freeformreversible embedding of suspended hydrogels,F(xiàn)RESH)方法提出了一種三維打印方法,用于構(gòu)建用于生物組織工程的復(fù)合膠原支架,可打印出20微米分辨率的膠原支架,細(xì)胞可以包埋在膠原蛋白中,或者可以通過(guò)包埋明膠球?qū)⒖滓胫Ъ苤校晒κ褂迷?D打印技術(shù)打印了人類心臟的五個(gè)組成部分的,涵蓋了從毛細(xì)管到完整器官的比例,并對(duì)組織和器官功能進(jìn)行了驗(yàn)證。
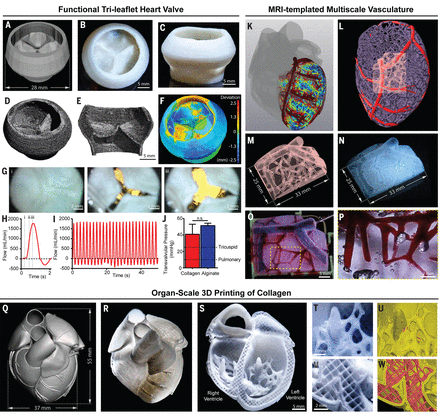
A.Lee el al. 3D printing of collagen to rebuild components of the human heart.Science, 2019,
DOI:10.1126/science.aav9051
https://science.sciencemag.org/content/365/6452/482
14. Science:3D打印出會(huì)“呼吸”的肺
美國(guó)萊斯大學(xué)的Jordan S. Miller和華盛頓大學(xué)Kelly R. Stevens教授等人利用投影立體光刻3D打印技術(shù),以食品染料添加劑作為生物相容的光吸收劑,只需數(shù)分鐘就可在透明光聚合水凝膠中制備具有3D內(nèi)部功能結(jié)構(gòu)的血管系統(tǒng),可在血管內(nèi)實(shí)現(xiàn)混合功能和二尖瓣功能。基于空間填充數(shù)學(xué)拓?fù)湓O(shè)計(jì)并制備了互相纏繞的血管網(wǎng)絡(luò),并模擬肺泡結(jié)構(gòu)實(shí)現(xiàn)了流動(dòng)人類血液中紅細(xì)胞的氧氣交換。此外,他們還以這種具備血管網(wǎng)絡(luò)的可生物降解水凝膠為肝細(xì)胞的組織工程載體,并在慢性肝損傷的小鼠模型中證實(shí)了這種血管系統(tǒng)很有希望用于人工器官的構(gòu)建。

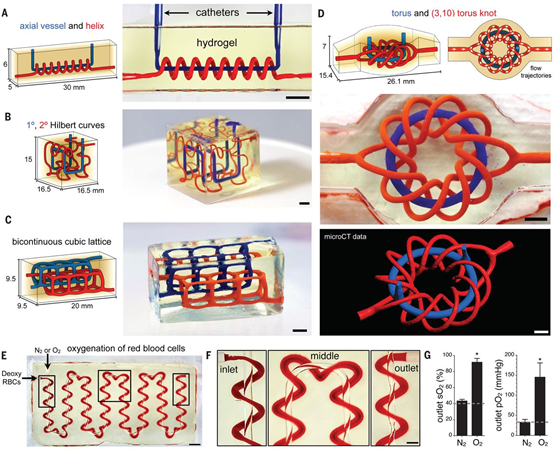
BagratGrigoryan et al. Multivascular networks and functional intravascular topologieswithin biocompatible hydrogels. Science, 2019, 364, 458-464.
DOI:10.1126/science.aav9750
15. Nature:晶體也可以實(shí)現(xiàn)自修復(fù),伸縮自如!
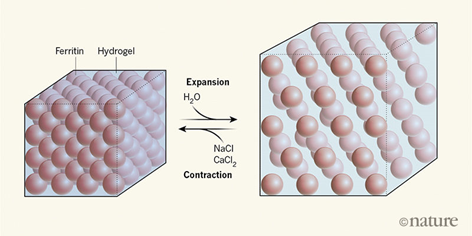
自然界中,有一種普遍存在的鐵蛋白(ferritin)晶體。鐵蛋白分子具有由24個(gè)構(gòu)筑單元自組裝形成的球形籠狀結(jié)構(gòu)。在其空腔內(nèi)部,儲(chǔ)存著以水合鐵礦的形式存在的鐵元素,一旦生物體有需要,鐵蛋白就會(huì)及時(shí)釋放出Fe2+。更重要的是,鐵蛋白的內(nèi)部空腔常常被用作納米反應(yīng)器,制備具有優(yōu)異光、磁、催化性能的礦化納米顆粒。除此之外,它還可以對(duì)納米顆粒進(jìn)行有3D組裝,實(shí)現(xiàn)光電、醫(yī)藥、傳感等多種優(yōu)異性能的集成。有鑒于此,美國(guó)加州大學(xué)圣地亞哥分校的F.AkifTezcan課題組基于鐵蛋白開發(fā)了一種具有高膨脹性、可自修復(fù)的鐵蛋白-水凝膠復(fù)合材料。
本文要點(diǎn):
要點(diǎn)1.研究人員首先選擇了一種全新形式的鐵蛋白:利用鈣離子將兩個(gè)鐵蛋白分子的氨基酸側(cè)鏈橋連到一起。每個(gè)鐵蛋白分子和相鄰的12個(gè)分子連接,組裝成數(shù)十微米長(zhǎng)程有序的立方結(jié)構(gòu)晶體。至于柔性材料,研究人員選擇了高分子水凝膠,一種吸水的交聯(lián)高分子網(wǎng)狀結(jié)構(gòu)。這兩種材料本身都不具有良好的自修復(fù)性能,但是聯(lián)姻之后實(shí)現(xiàn)了1+1>2的效果。
要點(diǎn)2.研究人員先將鐵蛋白晶體浸漬于水凝膠前驅(qū)體溶液中,使前驅(qū)體充分?jǐn)U散到鐵蛋白晶格中填滿水的空腔中。然后,將晶體轉(zhuǎn)入含有聚合物引發(fā)劑的高鹽溶液中,使前驅(qū)體發(fā)生聚合反應(yīng),并不至于產(chǎn)生過(guò)度膨脹。不到2分鐘,鐵蛋白晶體空腔內(nèi)就形成了連續(xù)、彈性的水凝膠網(wǎng)絡(luò)。當(dāng)把這種復(fù)合材料放在水中時(shí),幾分鐘內(nèi)就可以膨脹達(dá)到200%,且向各個(gè)方向均勻擴(kuò)展。在50分鐘以內(nèi),晶體晶面形貌都保持不變,也不會(huì)將鐵元素釋放出來(lái)。當(dāng)然,繼續(xù)過(guò)度膨脹還是會(huì)導(dǎo)致晶體發(fā)生變形,甚至出現(xiàn)裂痕。
要點(diǎn)3.神奇的是,當(dāng)研究人員將部分膨脹的鐵蛋白晶體-水凝膠復(fù)合物依次轉(zhuǎn)移到濃的NaCl溶液和CaCl2中時(shí),晶體開始脫水收縮變小,自修復(fù)到它原先的形貌和尺寸大小。X-射線分析表明,這種復(fù)合的鐵蛋白比普通鐵蛋白具有更精確的有序結(jié)構(gòu),這可能是因?yàn)榫酆衔镒⑷雽?dǎo)致晶體質(zhì)量提高。
總之,這項(xiàng)研究發(fā)明了一種具有高度可膨脹性的自修復(fù)蛋白質(zhì)-聚合物復(fù)合材料,為納米顆粒3D組裝,蛋白晶體質(zhì)量的提升帶來(lái)了幫助!
Ling Zhang,et al. Hyperexpandable,self-healing macromolecular crystals withintegratedpolymer networks. Nature 2018, 557, 86–91.
DOI: 10.1038/s41586-018-0057-7
https://www.nature.com/articles/s41586-018-0057-7
16. Nature:以DNA折紙為模板的復(fù)雜二氧化硅復(fù)合材料
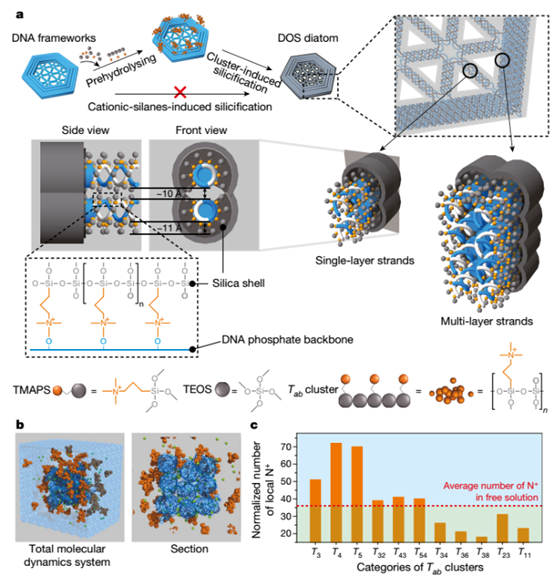
DNA納米技術(shù)雖然在形貌控制組裝方面取得了較大的進(jìn)步,但是仍然存在一個(gè)關(guān)鍵問(wèn)題:用于維持DNA折紙結(jié)構(gòu)的高離子強(qiáng)度溶液,會(huì)導(dǎo)致DNA表面帶電荷,抑制其他組分的材料沉積。有鑒于此,中科院上海應(yīng)用物理研究所樊春海和美國(guó)亞利桑那州立大學(xué)Hao Yan等人合作,利用St?ber法解決了DNA折紙術(shù)的這個(gè)重大難題。
研究人員發(fā)現(xiàn),SiO2前驅(qū)體分子不會(huì)直接沉積在DNA組裝結(jié)構(gòu)表面,而是形成團(tuán)簇。這樣,通過(guò)復(fù)制各種復(fù)雜DNA折紙的幾何信息,最終可以得到DNA-SiO2復(fù)合材料。基于這種策略,研究人員實(shí)現(xiàn)了各種DNA折紙結(jié)構(gòu)的組裝。在尺度上,可以從10-1000 nm;在形貌上,可以實(shí)現(xiàn)框架結(jié)構(gòu)、多孔結(jié)構(gòu),彎曲結(jié)構(gòu)等等;在維度上,可以實(shí)現(xiàn)1-3 D各種維度。研究人員發(fā)現(xiàn),包裹SiO2之后,DNA-SiO2折紙復(fù)合結(jié)構(gòu)的柔韌性幾乎不變,但是強(qiáng)度比包裹前提高了10倍。這項(xiàng)研究為DNA納米技術(shù)的研究開辟了新道路,為仿生SiO2納米結(jié)構(gòu)的研究指明了方向。
Xiaoguo Liu, et al. Complex silicacompositenanomaterials templatedwith DNA origami. Nature 2018.
https://www.nature.com/articles/s41586-018-0332-7
17. Nature綜述:加速干細(xì)胞治療的生物工程策略
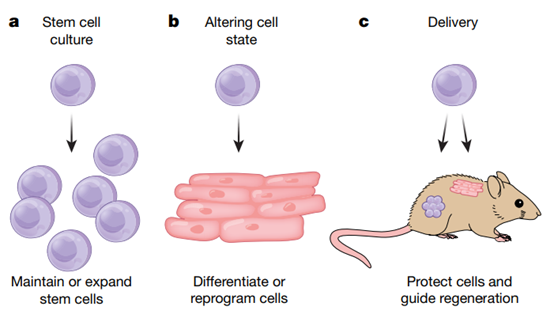
盡管目前只有少數(shù)干細(xì)胞療法可用于患者,但干細(xì)胞具有巨大的再生潛力,一些令人興奮的臨床應(yīng)用也正在興起。斯坦福大學(xué)Helen M. Blau等人發(fā)表對(duì)如何加快干細(xì)胞治療進(jìn)行綜述,表明具有可調(diào)機(jī)械和生化特性的生物材料可以在培養(yǎng)過(guò)程中保持干細(xì)胞功能,提高移植細(xì)胞的存活率,并指導(dǎo)組織再生。
三維水凝膠培養(yǎng)平臺(tái)的快速發(fā)展為培養(yǎng)患者特異性器官提供了機(jī)會(huì),并導(dǎo)致了刺激內(nèi)源性組織特異性干細(xì)胞的藥物的發(fā)現(xiàn),并為治療疾病的藥物篩選提供了可能。因此,生物工程技術(shù)正準(zhǔn)備克服目前的瓶頸,徹底改變?cè)偕t(yī)學(xué)領(lǐng)域。
Madl,C.M., Heilshorn, S.C. & Blau, H.M. Bioengineering strategies to acceleratestem cell therapeutics. Nature 557, 335–342 (2018).
https://doi.org/10.1038/s41586-018-0089-z
18. Nature:干式雙面膠帶用于粘接濕組織和植入設(shè)備
通過(guò)分子間的作用力,如氫鍵、靜電相互作用和范德華相互作用,兩個(gè)干燥的表面可以瞬間附著在一起。然而,當(dāng)涉及到身體組織等濕表面時(shí),這種瞬間粘附是具有挑戰(zhàn)性的,因?yàn)樗畬蓚€(gè)表面的分子分開,阻止了相互作用。雖然與縫合或吻合術(shù)相比,組織粘接劑具有潛在的優(yōu)勢(shì),但現(xiàn)有的液體或水凝膠組織粘接劑存在著粘接力弱、生物相容性差、與組織機(jī)械匹配差、粘接形成緩慢等缺陷。
近日,美國(guó)麻省理工學(xué)院趙選賀研究小組,開發(fā)出一種替代的組織粘合劑,其形式為干式雙面膠帶(DST),由生物聚合物(明膠或殼聚糖)和接枝有N-氫琥珀酰亞胺酯的交聯(lián)聚丙烯酸組成。這種DST的粘附機(jī)制取決于從組織表面去除界面水,從而導(dǎo)致與表面的快速臨時(shí)交聯(lián)。隨后與組織表面上的胺基進(jìn)行共價(jià)交聯(lián)進(jìn)一步改善了DST的粘附穩(wěn)定性和強(qiáng)度。體外小鼠、體內(nèi)大鼠和體外豬模型表明,DST可以在五秒鐘內(nèi)在各種濕動(dòng)態(tài)組織和工程固體之間實(shí)現(xiàn)強(qiáng)力粘附。DST可用作組織粘合劑和密封劑,以及將可穿戴和可植入設(shè)備粘附到濕組織上。
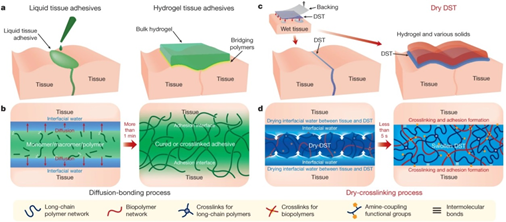
HyunwooYuk, Claudia E. Varela, Christoph S. Nabzdyk, et al.Dry double-sided tape foradhesion of wet tissues and devices. Nature, 2019.https://doi.org/10.1038/s41586-019-1710-5
19. Nature:通過(guò)點(diǎn)擊-功能性肽bundles制備具有受控組裝和剛性的聚合物
生物分子的工程設(shè)計(jì)是功能強(qiáng)大的精密軟材料設(shè)計(jì)中的關(guān)鍵概念。生物分子具有出廣泛的功能和結(jié)構(gòu),包括化學(xué)識(shí)別(例如,酶底物或粘合劑配體的化學(xué)識(shí)別),精美的納米結(jié)構(gòu)(由肽,蛋白質(zhì)或核酸組成),以及異常的機(jī)械性能(如絲狀強(qiáng)度,剛度,粘彈性和回彈性)。 近日,特拉華大學(xué)Christopher J. Kloxin,Darrin J. Pochan,賓夕法尼亞大學(xué)Jeffery G.Saven等發(fā)展了一種物理(非共價(jià))相互作用與“點(diǎn)擊”共價(jià)組裝相結(jié)合的方法,用于制備肽基聚合物。
這些聚合物的納米級(jí)單體單元是低分子量肽的同四聚體,α-螺旋bundles。肽bundles單體或bundlemers可以被設(shè)計(jì)成具有多種化學(xué)功能。蛋白質(zhì)狀結(jié)構(gòu)肽bundles可精確定位不同bundlemers末端之間的共價(jià)鍵,從而形成具有有趣且可控制的物理特性的聚合物,例如剛性棒,半柔性或扭結(jié)鏈以及熱響應(yīng)性水凝膠網(wǎng)絡(luò)。聚合物剛度可以通過(guò)改變連接劑來(lái)控制。此外,通過(guò)控制bundlemer外圍的氨基酸序列,對(duì)特定的氨基酸側(cè)鏈進(jìn)行修飾(包括“點(diǎn)擊”化學(xué)功能化),可創(chuàng)建各種各樣的雜化納米材料。
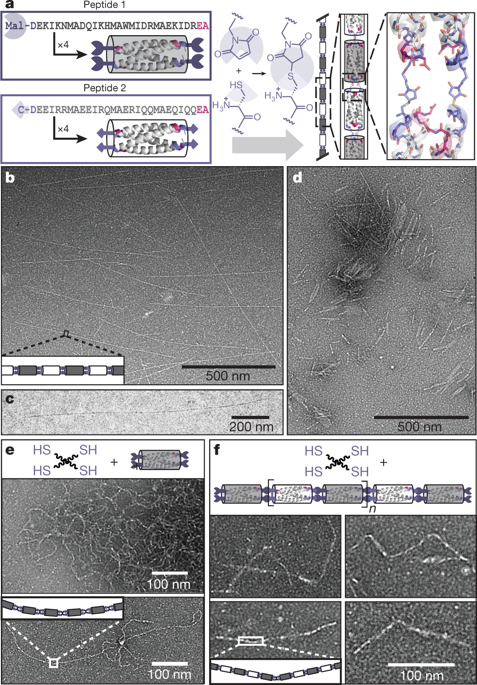
DongdongWu, et al. Polymers with controlled assembly and rigiditymade with click-functionalpeptide bundles. Nature, 2019.
https://www.nature.com/articles/s41586-019-1683-4











