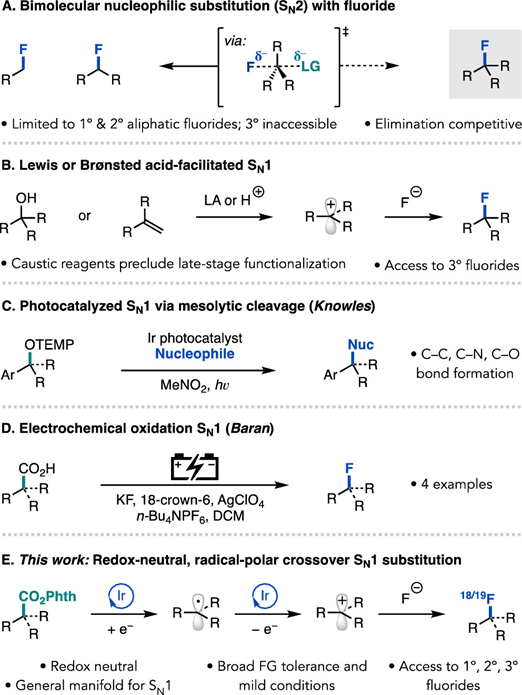
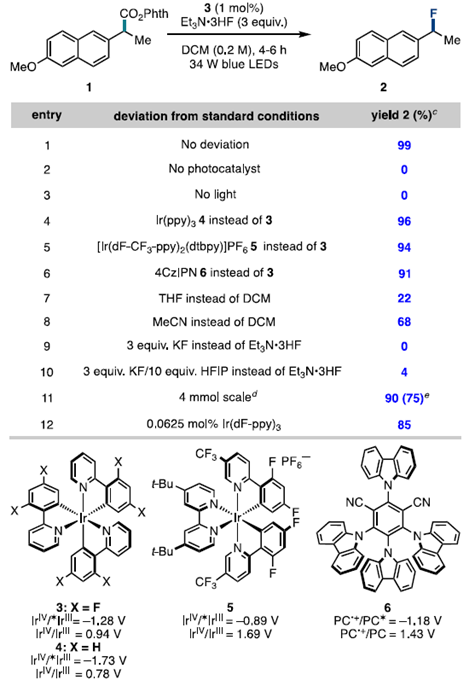
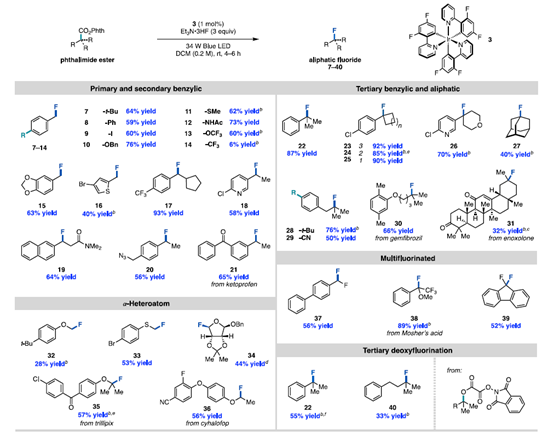
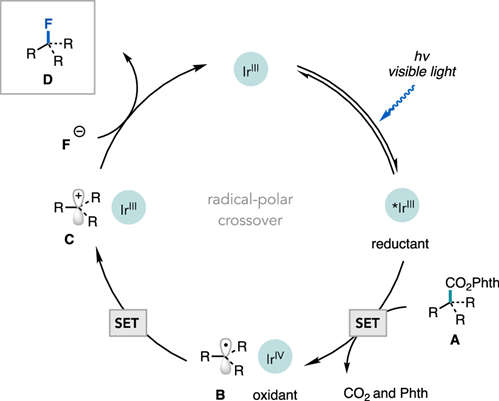
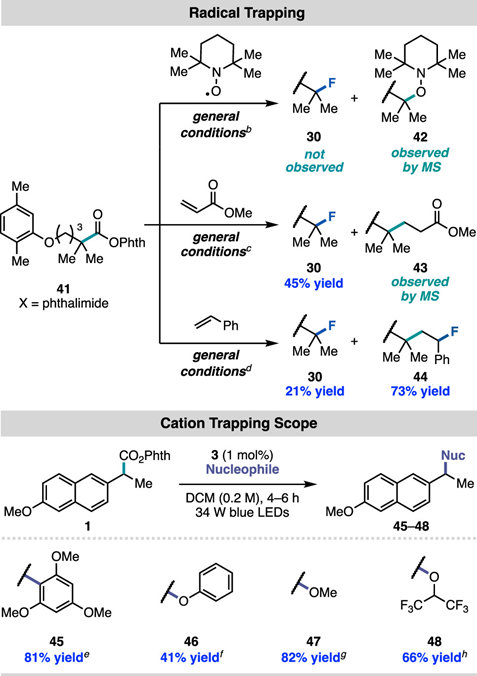
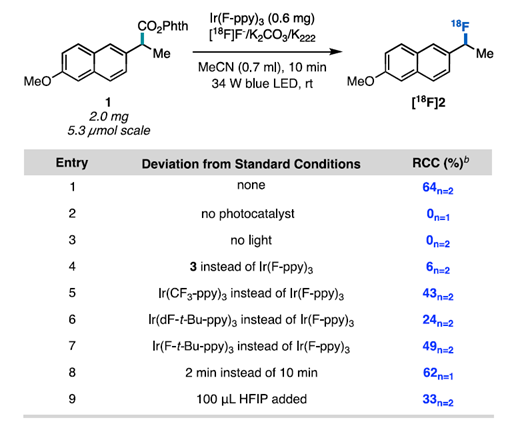
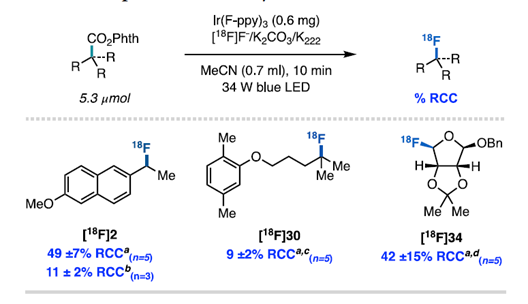
通訊單位:Princeton University1. 作者在可見光照射下使用銥光敏劑催化N-羥基鄰苯二甲酰亞胺酯順利實現親核氟化2. 光敏劑和氧化還原活性酯底物之間的連續雙電子轉移,經過自由基極性交叉過程形成碳正離子關鍵中間體3. 該反應可以拓展到其他親核反應以及放射性氟化反應脂肪族有機氟化合物具有重要的生物學和物理特性,在藥物,農藥和材料中有著廣泛的應用,其中最為著名的應用則是正電子發射斷層掃描(PET)放射性示蹤劑。因此,使用親核或親電氟試劑在溫和條件下后期氟官能團化一直是化學家研究的熱門領域。圖1 親核氟化反應綜述(圖片來源:J.Am. Chem. Soc.)考慮到成本,官能團兼容性以及對放射性氟化的適用性等原因,研究人員一直在尋找更為溫和的親核氟化策略制備烷基氟化物。在多數已發展的方法學中,C(sp3)-F鍵的形成通常遵循SN2機制,因此產物僅限于活化或位阻較小的脂肪族氟化物(圖1A)。實際上,對于SN2反應更核心的限制在于氟離子的低親核性和強堿性,這將加速競爭性的消除反應。通過碳正離子中間體(SN1機理)進行的逐步親核氟化反應為烷基氟化物的合成提供了新的選擇,人們因此能夠合成未活化和大位阻的脂肪族氟化物。但是,碳正離子中間體的產生通常需要苛刻的Br?nsted或Lewis酸性條件,這圖1B)。為了攻克這些難題,科研人員最近發展了在非酸性條件下產生碳正離子的新策略。Knowles課題組介紹了一種方法,該方法是在TEMPO衍生的烷氧基胺底物氧化后,進一步裂解獲得碳正離子中間體。盡管各種各樣的親核試劑均與該方法兼容,但美中不足的是該方法無法實現親核氟化(圖1C)。Baran實驗室報道了一種用電化學方法從易得的羧酸中生成碳正離子的方法(圖1D),該方法可與醇類親核試劑反應獲得廣泛的大位阻醚類化合物,并給出了與KF反應得到四個烷基氟化物的實例,但是他們并沒有報道放射性氟化的產物。作者希望能通過自由基-極性交換反應將N-羥基鄰苯二甲酰亞胺酯中生成自由基轉化為碳正離子(圖1E),進而實現親核氟化。他們選擇氧化還原活性酯作為底物,這類底物可以通過單電子還原脫羧并釋放非親核離去基團而,可作為烷基自由基的前體。圖2 反應條件優化表(圖片來源:J.Am. Chem. Soc.)作者從甲氧萘丙酸衍生N-羥基鄰苯二甲酰亞胺酯(圖2,化合物1)開始研究,因為這類富電子芳烴在有外源性氧化劑存在的方法學中是較難兼容的。在34 W藍光照射下,利用1 mol%的光敏劑3和3當量的Et3N·3HF能幾乎定量地將化合物1轉化為目標產物(圖2,條目1)。黑暗或光催化劑確實的條件都將完全抑制反應(圖2,條目2和3)。通過篩選發現,光敏劑3為最合適的光敏劑,DCM是該反應的最佳溶劑作者還發現了使用KF/HFIP代替Et3N·3HF可以觀察到痕量產物,這暗示了放射性親核氟化的可能性。最后,作者發現在幾乎不影響產率的前提下,該反應可以輕松放大至4 mmol (圖2,條目11),光催化劑的負載量可以降低至0.0625mol%。這些數據都證明了該方法的實用性,并且這么低的催化劑負載量暗示了單分子反應機理。圖3 反應底物適用性研究(圖片來源:J.Am. Chem. Soc.)作者利用優化的條件進一步測試了底物的適用性。他們發現可以以良好或優異的收率獲得各種伯芐基氟化物(圖3),像二惡唑,芐基保護的苯酚和硫醚這類難以在氧化性條件下兼容的底物也可以很好參與轉化。但是缺電子底物的產率較低,這可能是因為吸電子取代基使碳自由基氧化過程變得更為困難。自由基對陽離子的取代作用是不利的。帶有氯,溴,碘,疊氮等官能團的底物也能很好地參與反應,并可以進一步參與交叉偶聯或者Click反應。該方法學不僅能實現氧原子和硫原子的α氟化,還可以實現三級碳的親核氟化。圖4 可能的反應機理循環(圖片來源:J.Am. Chem. Soc.)熒光淬滅實驗證明了激發態光敏劑3(E1/2*= -1.28 V vs SCE)與N-羥基鄰苯二甲酰亞胺酯A發生單電子轉移(SET)(~ -1.3 V vs SCE)(圖4),得到自由基中間體B(對于一級芐基,E1/2ox<0.73 V vs SCE,對于三級碳底物,E1/2ox= 0.09 V vs SCE)和氧化光催化劑3+(IrIV / IrIII E1/2 = 0.94 Vvs SCE),兩個物種進一步反應,得到了碳正離子C。最后,碳正離子被氟離子捕獲,得到烷基氟化物D。圖5 自由基和碳正離子中間體捕獲實驗(圖片來源:J.Am. Chem. Soc.)作者分別進行了三種自由基捕獲實驗,TEMPO直接抑制了轉化,并在質譜中觀察到TEMPO加成產物(圖5);在丙烯酸甲酯的存在下,觀察到自由基加成產物43,以及氟化產物物30,但未得到三組分加成的產物;另外苯乙烯存在下可以得到新的氟化產物44。為了驗證碳正離子中間體的存在,作者嘗試了其他親核試劑并發現均可參與脫羧取代反應。一系列親核試劑的廣泛兼容性暗示了碳正離子的中間體的存在,并證明了該策略的普遍性。圖6 放射性親核氟化反應條件篩選表(圖片來源:J.Am. Chem. Soc.)為了實現放射性氟化反應,作者選擇在乙腈中進行脫羧氟化,以避免二氯甲烷的任何潛在臨床問題。使用K18F/Krypto?x[2.2.2]組合作為氟源,作者發現Ir(F-ppy)3光敏劑表現更為優異(圖6,條目1和4-7)。在最佳條件下,反應在2分鐘內即可以62%的放射化學轉化率(RCC)生成目標產物(圖6,條目8)。圖7 放射性親核氟化反應應用(圖片來源:J.Am. Chem. Soc.)對于傳統方法很難難以獲得的產物,作者用他們的方法進行了簡單的嘗試(圖7)。他們以9±2%,42%±15%RCC分別獲得了二甲苯氧庚酸和核糖類似物的放射性氟化產物 30,34。結語:Doyle課題組發展了一種光催化親核氟化的方法,該方法關鍵在于自由基極性交叉反應形成碳正離子中間體。該方法還可以拓展到O,S親核試劑和放射性氟化,從而實現生物活性分子的放射性氟化。
Eric W. Webb. et al. Nucleophilic (Radio)Fluorination of Redox-Active Esters via Radical-Polar Crossover Enabled by Photoredox Catalysis. J. Am. Chem. Soc. 2020,
DOI: 10.1021/jacs.0c03125https://doi.org/10.1021/jacs.0c03125