
第一作者:黃建安
通訊作者:Denis Garoli、黃建安
通訊單位:意大利理工學院
研究亮點:
1. 利用金納米星與金納米孔壁之間的單個熱點,實現了到了單分子SERS探測。
2. 通過分子動力學模擬與實驗SERS譜圖詳細研究了多肽在金表面的吸附和運動狀態。
蛋白質測序面臨挑戰
蛋白質是所有生命過程的重要參與者,蛋白質的一級結構,即氨基酸的排列順序決定了蛋白質高級結構和功能,是現代生命科學進行蛋白質結構功能分析中很重要的分析目標。精確、快速、便捷的實現蛋白質一級結構分析,對于理解生命活動過程,疾病的早期診療具有重要的意義。例如,在可預見的未來,開發出手持式單分子蛋白質測序儀,與醫療數據庫結合,病人在家中即可實現早期疾病診斷。這將是醫療領域革命性的突破,具有廣闊的發展空間和市場前景。
目前蛋白質測序常用的是質譜(Mass Spectroscopy),需要首先把蛋白質切碎成多肽,然后再離子化多肽使得多肽鏈上的氨基酸有了電荷,再通過質量/電荷比來確定多肽中氨基酸的順序,再比對蛋白質數據庫還原切碎前的蛋白質。質譜儀器巨大,靈敏度低,需要至少一百萬個多肽分子才能得出有意義的數據,對于測試生物體液中的占少數的蛋白質無能為力,質譜的這些缺點成為不僅是蛋白質測序而且是蛋白質組學(Proteomics)的重大瓶頸。
科學家于是寄希望于在基因測序取得重大成功的納米孔單分子測序。但是,對于單分子蛋白質測序,相比于在單分子DNA測序中只用到4種堿基作為基本結構單元,蛋白質由20個不同的氨基酸組成,使得單分子蛋白質測序變得更為復雜。因為組成蛋白質氨基酸數量眾多,無法通過離子電流等手段直接識別。目前各大研究機構和公司正在研究使用熒光標記20種氨基酸并通過單分子熒光來識別,但是仍然難于登天,一方面將不同染料分子連接到蛋白質鏈的每個氨基酸已經是接近不可能的任務。另一方面熒光的發光峰太寬,以至于不同染料分子的發光光譜相互交疊難以分辨,無法實現準確識別。表面增強拉曼光譜(SERS)利用貴金屬表面等離子體共振產生的電磁場增強(熱點),將吸附于其中的探測分子拉曼信號提高1010數量級,實現了對DNA等物質的單分子級探測。就如之前提到的《單分子SERS:第一次,測全了4個堿基的單分子基因測序》描述的那樣,SERS光譜在單分子分析中具有很大優勢,例如狹窄的“指紋峰”有助于多路識別,抗光漂白和無須標記。
SERS在對多肽中氨基酸的識別,仍然有不少困難。一方面,由于攜帶苯環的氨基酸具有較大的拉曼散射截面,導致其它氨基酸的拉曼信號被完全覆蓋。另一方面,由于對蛋白質的分析需要分散在溶液中進行,由于在金屬表面復雜的運動過程,如吸附、脫附、翻轉等,導致產生的拉曼信號出現飄動和展寬。因此,目前SERS研究無法精確識別單個氨基酸,特別是不含苯環的氨基酸。這些極大限制了SERS應用于單個蛋白質測序。
成果簡介
為此,意大利理工學院Francesco De Angelis研究團隊將蛋白質或氨基酸分子吸附于金納米星上,通過施加電等離子體力(electro-plasmonic force)將粒子推進并約束在金納米孔內,如圖1所示,利用金納米星與金納米孔壁之間的單個熱點,實現了到了單分子SERS探測,用于探測氨基酸和分辨僅含有兩個不同氨基酸單元的單個多肽分子抗利尿激素(Vassoprein)和催產素(Oxytocin),并結合分子動力學模擬對照實驗譜圖,詳細研究了多肽在金表面的吸附和運動狀態。該系統被證實具有與氨基酸尺寸可比擬的高空間分辨率,可以無標記的精確識別多肽鏈上的單個氨基酸,為之后的單個蛋白測序打下了堅實的基礎。
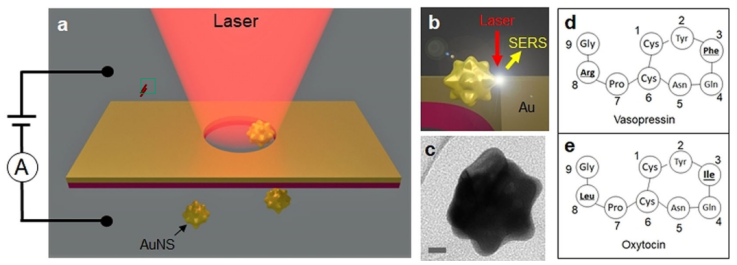
圖1. 納米星微流系統構成。
要點1:首次實現了10種不同氨基酸的單分子SERS分析
通過濃度控制,作者將單層氨基酸覆蓋在金納米星表面,史上首次得到了10種不同氨基酸分子的單分子信號(圖2),演示了納米星系統優越的單分子譜線分辨率。
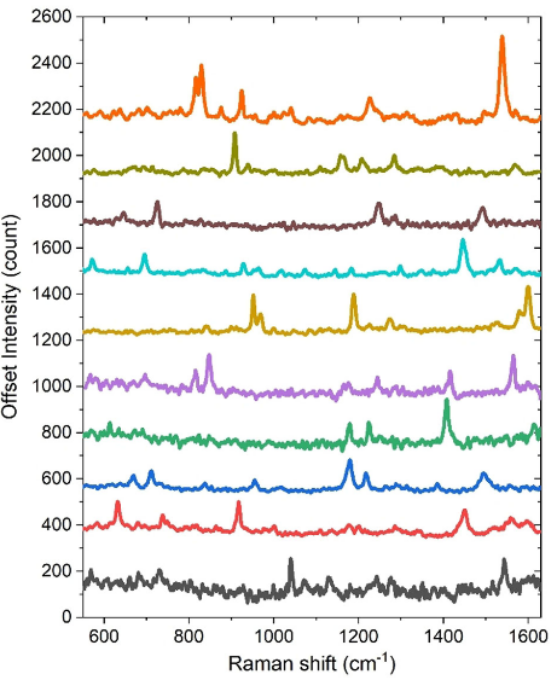
圖2. 10種單分子氨基酸SERS譜,從上往下是: Leu, Gln, Asn, Ile, Arg, Pro, Phe , Tyr, Cys, Gly。
所謂單分子譜線分辨率,是當單分子SERS信號和多分子SERS信號相比時,具有更窄的峰寬。如圖3所示,位于899cm-1處的CH2峰在單分子信號中峰寬僅有7cm-1,然而多分子SERS信號峰寬在15cm-1左右分布,并且重復性很差。這是由于在多分子情況下,吸附在粒子表面多個熱點附近的分子具有不同的構象,并且在溶液中不停的運動,從而將信號峰展寬。
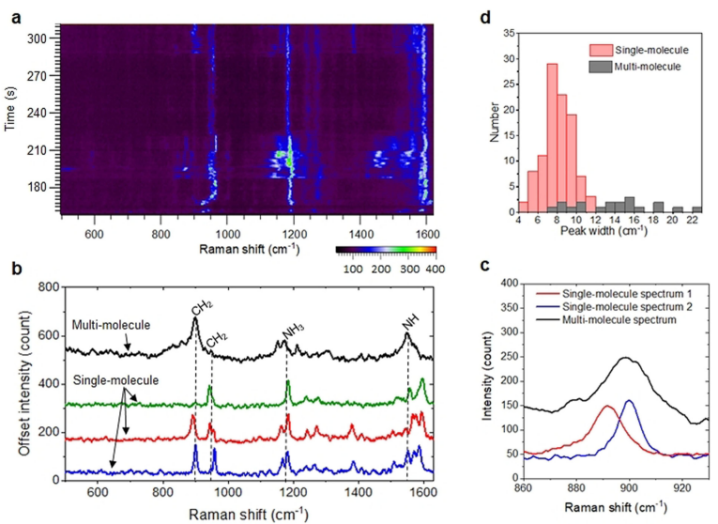
圖3. 單分子氨基酸SERS與多分子SERS信號對比。
要點2:成功實現單個多肽分子中氨基酸組分識別
為了進一步驗證納米星系統的空間分辨率,作者選擇了兩種常用的多肽: Vassoprein和Oxytocin,結構組成如圖1所示。這兩個多肽具有相同的氨基酸數量和相似的結構。不同的是在3號和8號位置上的氨基酸不同。納米線微流系統的譜圖如圖4所示,Vassoprein和Oxytocin的3號和8號位氨基酸被清晰的探測到了,史上第一次實現了單分子Vassoprein和Oxytocin的分辨。
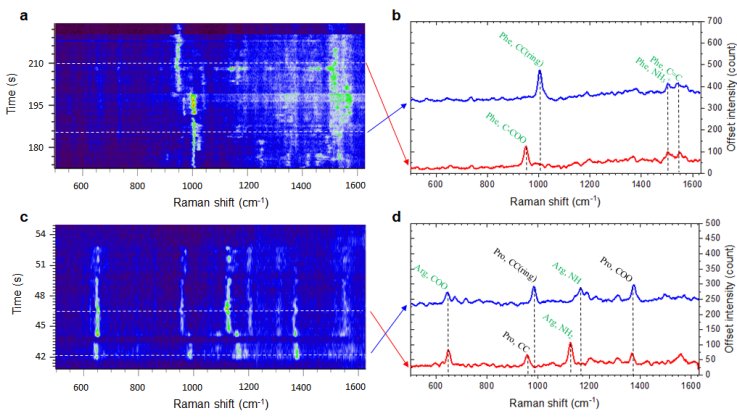
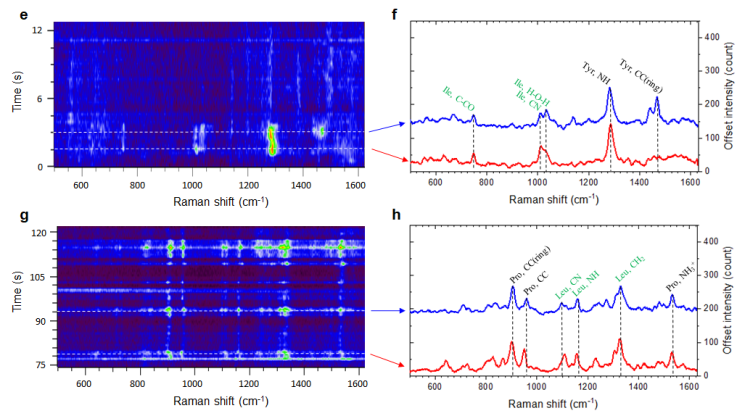
圖4. 其中a-d是氨基酸Vassoprein的SERS譜圖,e-h是Oxytocin的SERS譜圖。
要點3:通過分子動力學模擬與實驗SERS譜圖結合解釋了氨基酸的構象變化
作者不僅測出了結構信息。還通過SERS譜觀察到多肽在金表面的構型相關信息。例如結合電場激發拉曼峰的原理,Phe、Tyr和Pro等含苯環的氨基酸的面內呼吸振動模式的缺失,是由于其在金表面采取一種“平躺”的模式。據此,作者做了兩種多肽在金表面的分子動力學模擬(圖5),其中Tyr,Phe和Pro殘基均平躺在表面,與SERS光譜中得到的結果一致,證實了該分子動力學模型的正確性。
此外,該模型很好地解釋了其他不含苯環的氨基酸的動力學,模擬發現帶有苯環的殘基趨向于接觸金表面,并且阻止其它不帶苯環的殘基靠近,因此它們的SERS光譜往往蓋過了不帶苯環的殘基,實驗之所以能觀察到無苯環氨基酸,是因為與氨基酸尺寸可比擬的單個熱點所致。通過模擬,更加深入的證明了能觀察到多肽內單分子氨基酸殘基的信號,是因為光學牽引力的作用克服了熱運動效應。光學牽引力對穩定單個分子在熱點中,起了至關重要的作用,這對于深入了解亞納米級尺寸光與物質相互作用提供了新的理解。
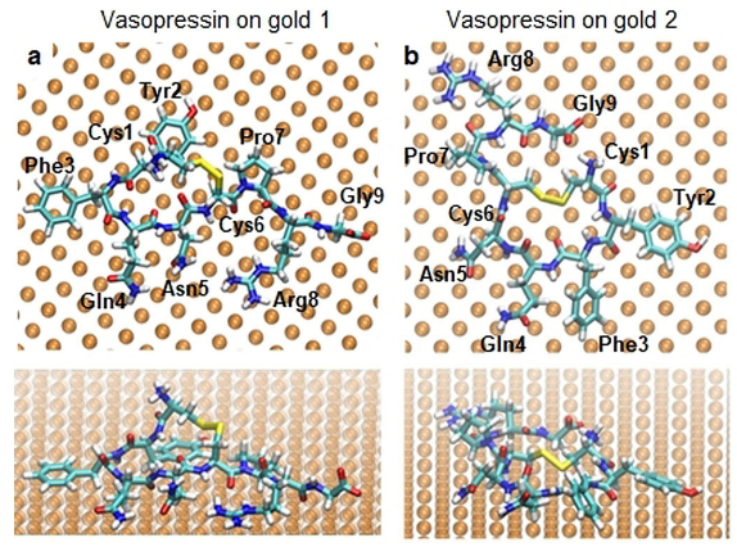
圖5. Vassopresin在金表面最可能構象的分子動力學模型。
小結
作者演示了單個SERS熱點對于單個蛋白質分子檢測的優越空間分辨率和譜線分辨率,但是單分子蛋白質測序還有很多問題尚待解決,例減慢蛋白質流速、熱點穩定性調控等。作者希望有更多SERS同行、單分子/單粒子操控、DFT模擬、分子動力學模擬和生物信息學專家參與和合作,有興趣的同行歡迎加入“納米人SERS”QQ群(群號:529847278)來一起探討。
參考文獻
Huang J A , et al. Multiplex discrimination of single amino acid residues in polypeptides by single SERS hot spot. Angewandte Chemie International Edition, 2020.
DOI: 10.1002/anie.202000489
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202000489











