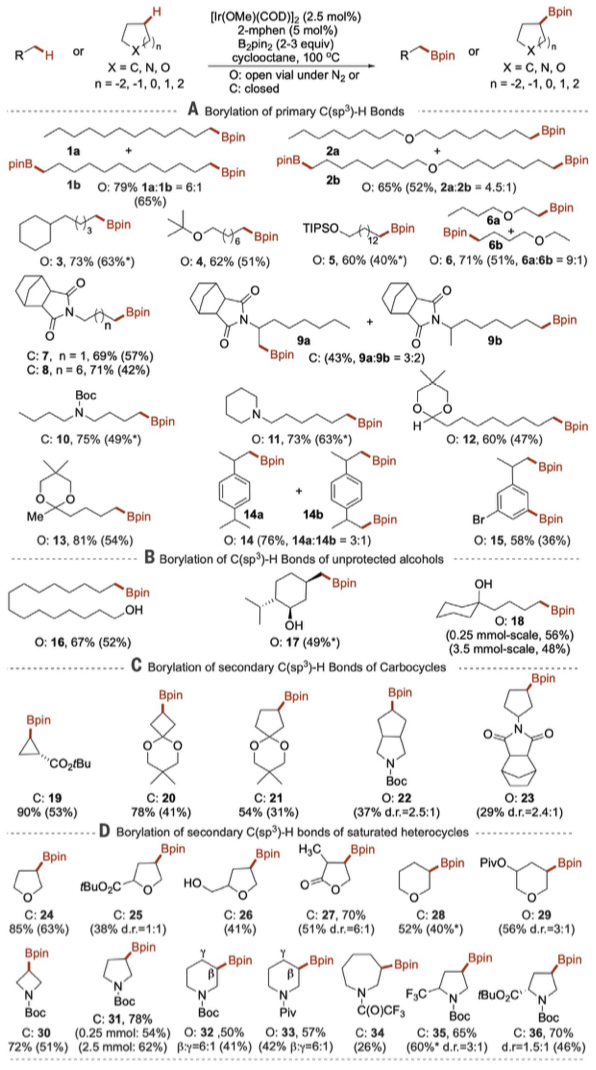
在合成化學中,C-H鍵的功能化應用的需求主要是在具有不同空間和電子特性的多個C-H鍵中直接進行選擇性的單個C-H鍵活化,以便合成復雜分子時有效減少副產物的生成。在有機分子的非反應性C-H鍵上安裝官能團一直是合成化學的一項重要挑戰。無論是催化反應還是非催化反應,都發生在芐基、烯丙基、一級和二級C-H鍵上,但是一級C-H鍵的無定向官能化作用更強,電子含量更低,發展得更慢。一級C-H鍵比二級或三級C-H鍵均強得多。因此對能夠將氫原子或氫化物分離出來的催化劑或酶的活性最低。然而,催化劑可以改變化學反應發生的部位,特定種類的碳烯的插入可能優先發生在具有空間位阻催化劑的一級C-H鍵中,而不是二級C-H鍵中。由于烷基硼酸酯可以形成多種類型的產物,因此具有非常規的選擇性并具有潛在的合成價值,但一級C-H鍵的硼化通常要求底物為溶劑或大量過量,而且沒有在潛在反應性官能團存在的情況下發生。
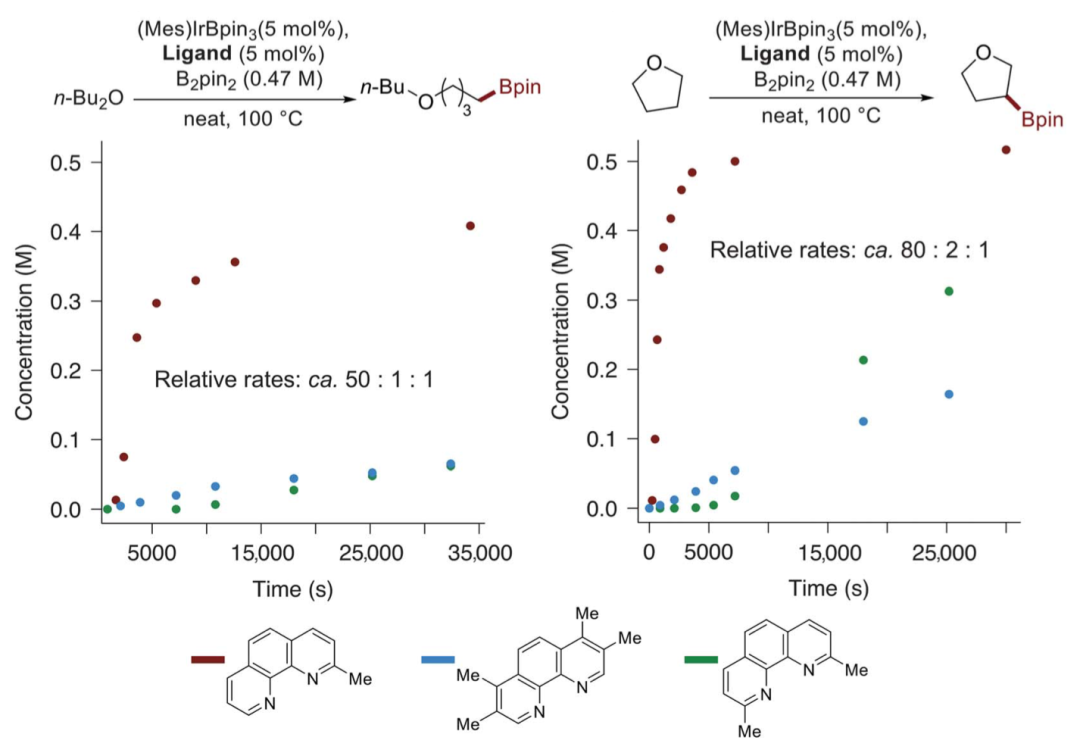
有鑒于此,美國加州大學伯克利分校John Hartwig教授等人設計制備了一種由2-甲基菲羅啉連接的銥催化劑,其活性使得底物為限制試劑進行主C-H鍵的無定向硼化,以及當主C-H鍵缺失或受阻時,強的二級C-H鍵的硼化。要點1. 在生成的碳-硼鍵上的反應說明,硼化作用導致在有機分子之前無法達到的位置上安裝大量的碳-碳和碳-雜原子鍵。以底物作為限制試劑,在有機分子中最強的烷基C-H鍵上以無定向的方式引入一系列官能團,并在βC-H鍵上引入雜原子。要點2. 含有2-甲基菲咯啉配體的銥催化劑可以使反應加速50-80倍,這種速率的提高使得主要的C–H鍵與作為限制劑的烴選擇性地發生硼化反應。另外,該反應對飽和雜環中的β-C-H鍵也具有異常的選擇性。在生成的碳-硼鍵上的反應表明。要點3. 當主C-H鍵缺失或被空間位阻阻斷時,含有乙醚、硅醚、亞胺、氨基甲酸酯、胺、酮和縮醛功能的底物在主C-H鍵或未激活的次級C-H鍵處進行了硼化。而且,該催化劑還能使大量處于β位置的飽和雜環以雜環作為限制試劑進行硼化反應。總之,該工作提出了一種使主烷基C-H鍵無定向硼化的方法,擴展了無定向C-H鍵的硼化作用。Raphael Oeschger et al. Diverse functionalization of strong alkyl C–H bonds by undirected borylation. Science, 2020.
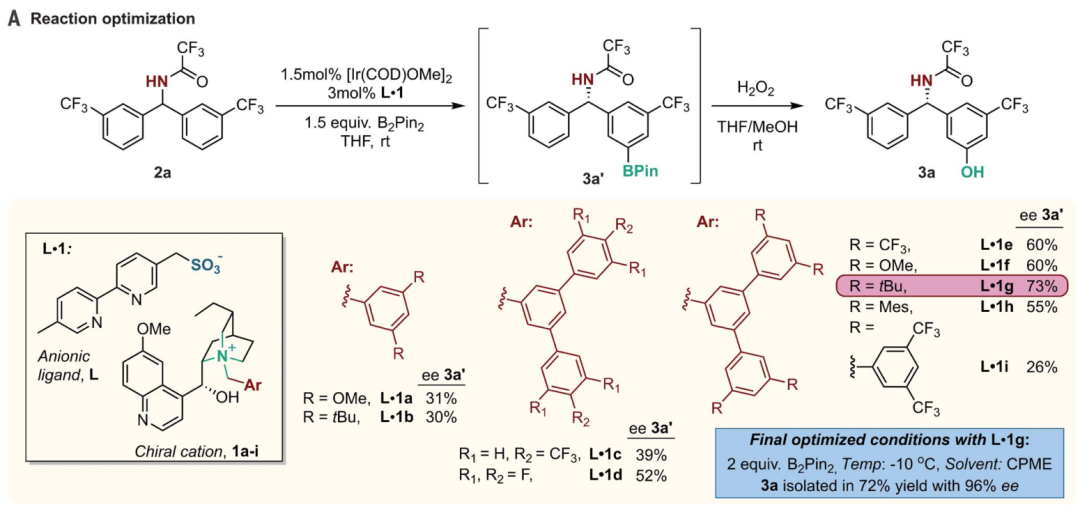
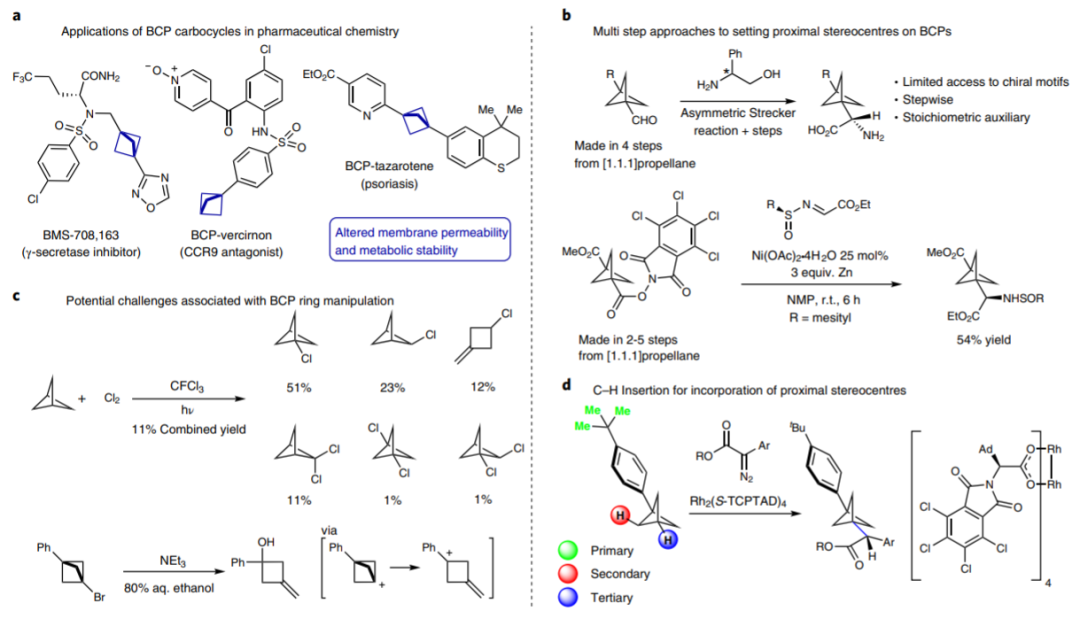
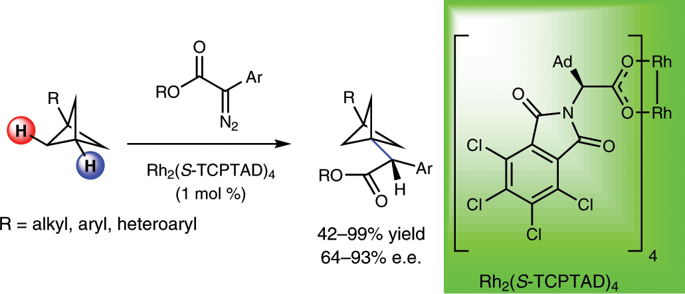
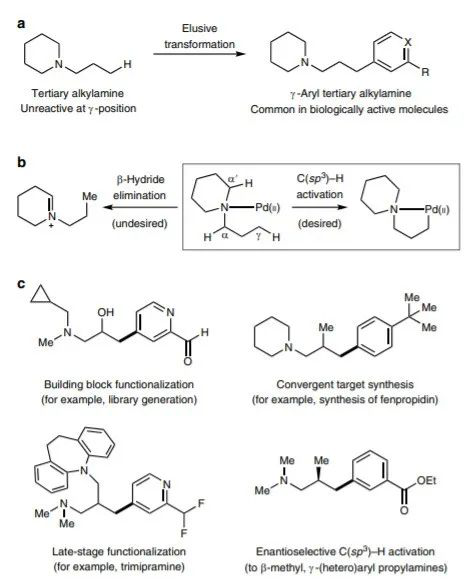
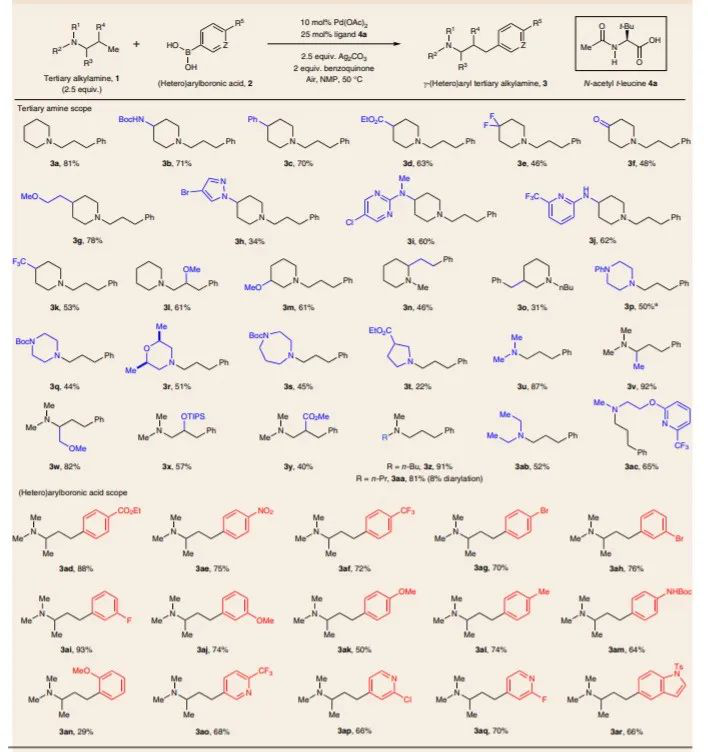
DOI: 10.1126/science.aba6146http://doi.org/10.1126/science.aba6146而在不久之前,多個長期深耕C-H活化的課題組在該領域取得了一些重要進展,現摘錄如下:1. Science: 英國劍橋大學報道銥催化選擇性芳環C-H鍵活化反應同時利用手性分子構建手性中心大量的金屬催化劑應用了手性配體用于手性催化反應,實現了對映性產物的選擇性生成。手性分子離子對在非對映性有機催化反應中也是構建手性分子的重要方法,在1980年代,通過手性陽離子催化劑和陰離子中間體反應物結構進行立體選擇相轉移催化開始得以應用(J. Am. Chem. Soc. 1984 106, 446–447.)。隨后實現了對邁克爾加成反應、阿德爾加成反應、曼尼希反應、氟化反應、烷基化反應等手性對映體合成反應。在最近一段時間,逆轉策略(inverse strategy)被發現在手性反應中非常成功(Angew. Chem. Int. Ed. 2013, 52, 534–561. Nat. Chem. 2012, 4, 603–614.),該方法通過手性陰離子和陽離子中間體配合。特別是當利用這種策略同時與過渡金屬配合協同催化,能夠在過渡金屬催化官能團化反應的同時,構建手性中心,實現在一步反應中同時進行官能團化和手性控制。英國劍橋大學的Robert J. Phipps等報道了新型手性配體的設計(磺酸基聯吡啶陰離子配體和手性陽離子手性配體),并將其與銥金屬催化劑協同作用,實現芳基硼基化反應的同時構建手性苯甲基和手性芳基磷酸中心。Robert J. Phipps之前還報道了通過底物和手性配體分子中的磺酸鹽之間的氫鍵作用實現構建手性結構的同時,實現硼基化反應(Angew. Chem. Int. Ed. 2017, 56, 13351–13355)。最近,余金權通過巧妙的接力策略(ingenious relay strategy)策略實現了對苯甲基的手性控制,同時在芳環上進行芳基化反應(Nature, 2018, 558, 581-585),但是該反應中需要用到~50 % mol量的手性配體分子,反應需要在回流溫度條件中發生。(1)該反應中能夠對非手性的苯甲基、苯甲酰基、磷酸酰基實現手性化,且在手性化的同時對芳基進行硼基化反應。該反應在室溫條件下發生,利用[Ir(COD)OMe]2作為硼基化催化劑。隨后,通過進一步反應,實現了將硼酸酯官能團氧化為-OH,或者轉化為氰基。在優化的反應條件中,反應產物一般能得到87~90 %的ee值。對不同溫度條件下(-10 oC~10 oC),反應的收率和手性修飾能力有所區別,說明有機陰陽離子對和原料底物之間的相互作用在反應中的重要影響。對手性有機離子對分子在構建手性結構中的作用進行了對照實驗。當反應中用到的配體為中性的聯吡啶(非負電性的磺酸聯吡啶),反應產物不體現手性中心。當手性陽離子用Br-中和后加入反應體系中,反應產物的對映體ee值降低為58 %。Georgi R. Genov, James L. Douthwaite, Antti S. K. Lahdenper?, David C. Gibson, Robert J. Phipps*. Enantioselective remote C–H activation directed by a chiral cation. Science,2020,367,1246-1251. DOI:10.1126/science.aba1120https://science.sciencemag.org/content/367/6483/12462. Nature Chemistry: Scipps研究所余金權報道遠離官能團的惰性C-H鍵活化選擇性對特定分子的特定位點進行C-H鍵活化對化學家而言是構建復雜有機分子的遠大目標。其中,一個可行的目標是活化惰性碳原子上的惰性C-H鍵,由于缺少位阻效應和電子效應的區分,使得高選擇性的在惰性C-H鍵上進行官能團化反應非常困難。Scipps研究所的余金權報道了難以發生反應的雜環化合物上C-H鍵的活化。1) 設計了催化體系和催化過程:通過遠端導向性官能團模板和非穩定的降冰片烯(Norbornene)中間體過程實現對遠端的特定惰性C-H鍵進行活化。2) 該反應過程對多種雜環化合物分子都有效(包含抗白血病藥、苯丙酸衍生物)。Shi, H., Lu, Y., Weng, J. et al. Differentiation and functionalization of remote C–H bonds in adjacent positions. Nat. Chem. (2020). DOI:10.1038/s41557-020-0424-5https://www.nature.com/articles/s41557-020-0424-53. Nature Catalysis: 埃默里大學報道雙環[1.1.1]戊烷C-H鍵官能團化反應雙環[1.1.1]戊烷(bicyclo[1.1.1]pentanes,BCP)分子中有強張力的碳環,這種特殊結構分子的合成和性質在之前的很長一段時間得到了廣泛的關注,目前構建BCP結構的分子依然具有極高難度。BCP分子中的近端立體中心在文獻中通常需要化學計量比的手性助劑。最近,普林斯頓大學報道了光還原-Cu金屬雙催化體系對雙環[1.1.1]戊烷上的C-H鍵進行活化反應(Nature, 2020, DOI: 10.1038/s41586-020-2060-z)。埃默里大學的Huw M. L. Davies等報道了通過雙銠手性催化劑Rh2(S-TCPTAD)4和重氮化合物反應,合成手性結構BCP分子的創新方法。(1)作者使用對叔丁苯基雙環[1.1.1]戊烷作為反應底物,二氯甲烷作為溶劑,使用雙銠催化劑,對反應溫度、重單化合物的取代基結構進行調節。在37 oC下,使用Rh2(S-TCPTAD)4作為催化劑,目標反應的產率為99 %,ee值為90 %。對重氮化合物原料分子的結構進行調控,并探索了反應的收率和ee值變化,取得了中等到高的反應收率和中等到高的ee值。(2)通過密度泛函理論對雙環[1.1.1]戊烷中的C-H鍵插入中間體過渡態能量進行比較,對雙銠催化劑和雙環[1.1.1]戊烷生成的中間態物種能量進行比較。結果顯示,反應優先在三級碳上發生,這是因為其生成這種過渡態的能量較低。Zachary J. Garlets; Jacob N. Sanders; Hasnain Malik; Christian Gampe; K. N. Houk; Huw M. L. Davies*. Enantioselective C–H functionalization of bicyclo[1.1.1]pentanesNat Catal (2020) DOI: 10.1038/s41929-019-0417-1https://www.nature.com/articles/s41929-019-0417-14. Nature Chemistry: 通過催化活化C(sp3)-H的路徑對三級胺分子進行修飾三級胺的合成在有機合成中是十分重要和具有挑戰性的方法學。英國劍橋大學化學系的Matthew J. Gaunt教授課題組最近在Nature Chemistry上全文刊發了最新研究進展。他們通過將三級有機胺分子中N原子的γ-位點上的C-H鍵進行活化實現芳基修飾,能夠對有機胺分子中烷基組分的修飾方法提出新方案,該方法具有廣泛的應用前景。1) 發現了一種簡單易得的Pd(II)配體在活化γ-位點上的C-H鍵中非常有效。2) 通過簡單易得的初始分子生成各種結構的立體結構的γ-芳基烷基胺,并體現了非常高的選擇性。Jesus Rodrigalvarez, Manuel Nappi?, Hiroki Azuma, Nils J. Flodén, Matthew E. Burns, Matthew J. Gaunt. Catalytic C(sp3)–H bond activation in tertiary alkylamines. Nat. Chem., 2020, 12, 76-81DOI:10.1038/s41557-019-0393-8https://www.nature.com/articles/s41557-019-0393-8