在Science Advances最新一期(VOL 6, ISSUE 20)上,奇物論編輯部選取了6篇與生物(納米)材料相關的論文進行介紹,具體如下:

封面
1. Science Advances: 生物無機雜合噬菌體可調節腸道菌群以重塑抗結直腸癌的腫瘤免疫微環境
越來越多的證據表明,腸道菌群有助于結直腸癌(CRC)的腫瘤發生,其中共生核酸核梭菌(Fn)選擇性地增加了免疫抑制的髓樣來源的抑制細胞(MDSC),以阻礙宿主的抗癌免疫反應。于此,武漢大學張先正教授等人通過噬菌體展示技術篩選了一株特異性Fn結合的M13噬菌體。然后,將銀納米顆粒(AgNP)靜電組裝在其表面衣殼蛋白(M13@Ag)上,以實現Fn的特異性清除并重塑免疫腫瘤的微環境。
本文要點:
1)體外和體內研究均顯示,M13@Ag治療可清除腸道Fn,并導致腫瘤部位MDSC擴增減少。
2)此外,抗原呈遞細胞(APC)被M13噬菌體激活,以進一步喚醒宿主免疫系統以抑制CRC。M13@Ag與免疫檢查點抑制劑(α-PD1)或化學治療劑(FOLFIRI)的結合可顯著延長原位CRC模型小鼠的總體存活時間。
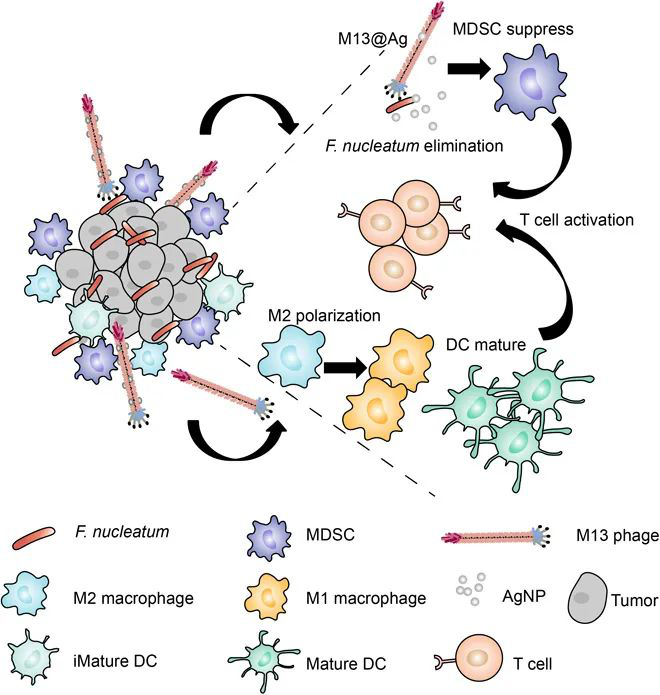
Dong X, et al. Bioinorganic hybrid bacteriophage for modulation of intestinal microbiota to remodel tumor-immune microenvironment against colorectal cancer. Science Advances. 2020;6(20):eaba1590.
https://advances.sciencemag.org/content/6/20/eaba1590
2. Science Advances:多級組裝/拆卸策略用于腫瘤靶向CO遞送
CO氣體分子不僅可以選擇性地殺死癌細胞,而且由于缺乏活性腫瘤靶向積累能力而表現出有限的抗癌功效。在這項工作中,深圳大學何前軍等人開發了一種多級組裝/拆卸策略,通過將線粒體靶向和線粒體內微環境響應前藥(FeCO-TPP)封裝在介孔二氧化硅納米粒子中來構建新型智能納米藥物,該納米粒子通過逐步靜電進一步涂有透明質酸組裝,以逐步拆卸的方式實現腫瘤組織-細胞-線粒體靶向的多級遞送和CO的控制釋放。
本文要點:
1)多級靶向遞送和CO的控制釋放涉及(i)被動腫瘤組織靶向納米藥物遞送,(ii)主動腫瘤細胞靶向納米藥物遞送,(iii)酸響應性前藥釋放,(i v)線粒體靶向前藥遞送,和(v)ROS響應性CO釋放。
2)開發的納米醫學有效地增強了體外和體內癌癥聯合治療的有效性和安全性。所提出的多級組裝/拆卸策略為靶向聯合治療開辟了一個新窗口。
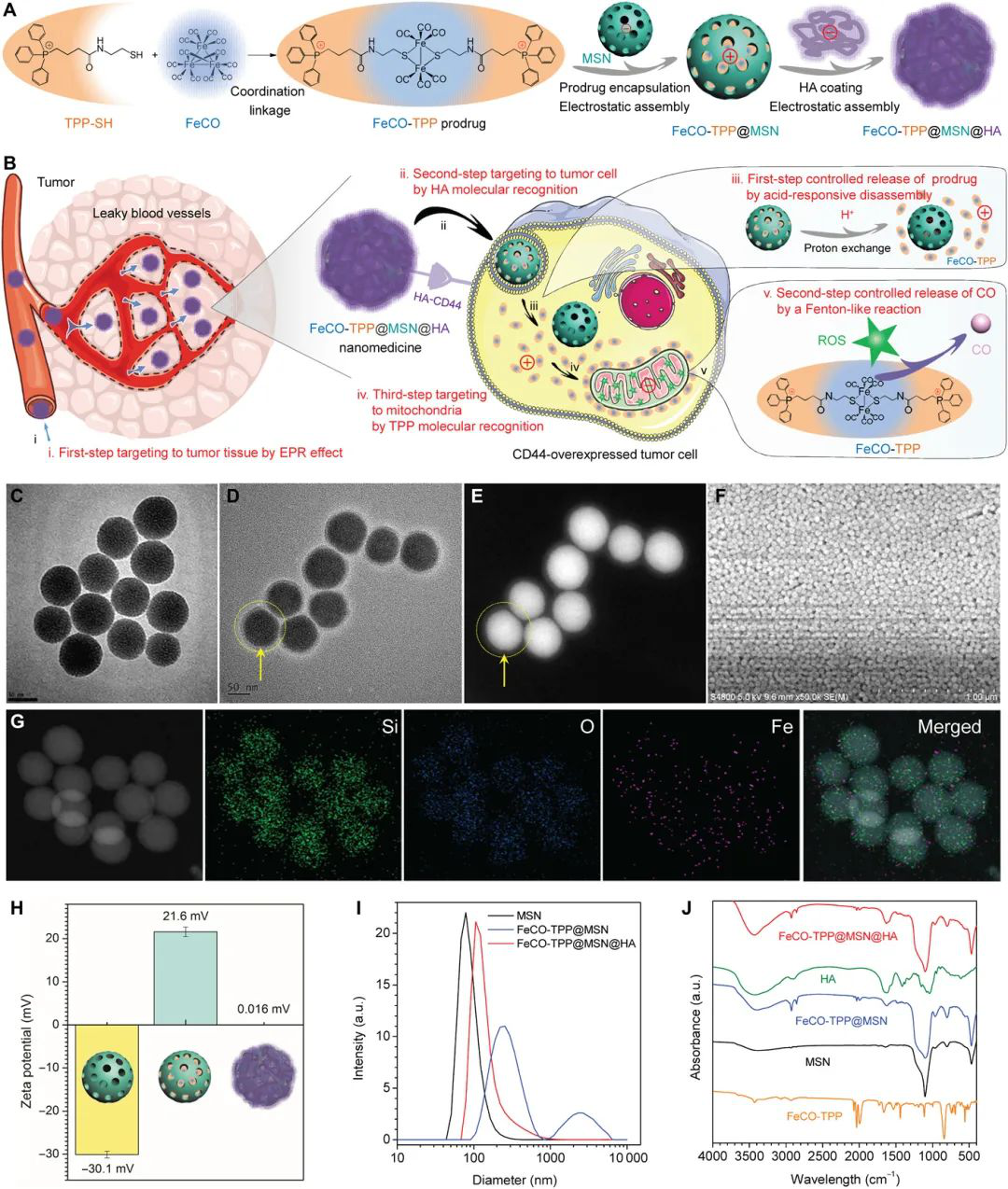
Meng J, et al. A multistage assembly/disassembly strategy for tumor-targeted CO delivery. Science Advances. 2020;6(20):eaba1362.
DOI: 10.1126/sciadv.aba1362
https://advances.sciencemag.org/content/6/20/eaba1362
3. Science Advances: 結構效應:從無生命到有生命納米顆粒組裝的新視角
納米粒子(NP)組裝是納米科學和納米技術最重要的成就之一,因為它們的粒子間相互作用克服了單個NP所表現出的弱點。然而,以往的研究都認為NP組裝體是無生命的,這使得NP組裝體的動力學特性被忽略。有生命的特性,即那些模仿生物學特性的特性,賦予NP集成獨特的和意想不到的功能,以供實際應用。中科院化學所王鐵研究員等人綜述了納米粒子的結構效應,提供了納米顆粒組裝從無生命到有生命的新視角。
本文要點:
1)重點介紹了他們在理解NP組裝特性,特別是其生命特性方面的最新進展。
2)關鍵示例用于說明關鍵概念,并且特別著重于生命屬性相關應用。最后,討論了該領域進一步發展的障礙。

Huang C, et al. Effect of structure: A new insight into nanoparticle assemblies from inanimate to animate. Science Advances. 2020;6(20):eaba1321.
DOI: 10.1126/sciadv.aba1321
https://advances.sciencemag.org/content/6/20/eaba1321
4. Science Advances:CXCR4抑制納米復合物靶向肺腫瘤微環境增強抗PD-L1免疫治療
抗程序性細胞死亡1配體1(PD-L1)治療在選定的癌癥患者中非常有效。然而,淋巴細胞浸潤不足,弱T細胞誘導的炎癥,以及腫瘤微環境(TME)中免疫抑制細胞的聚集可能會大大降低療效。有鑒于此,中國藥科大學的孫敏捷、美國內布拉斯加大學醫學中心的David Oupicky等研究人員,報道了由氟化聚合的CXCR4拮抗劑(FX)和載紫杉醇的人血清白蛋白(HP)組成的FX@HP納米復合物的研制,用于肺遞送抗PD-L1小干擾RNA(siPD-L1)治療原位肺腫瘤。
本文要點
1)FX@HP可誘導T細胞浸潤,增加腫瘤細胞上鈣網蛋白的表達,減少TME中髓系來源的抑制性/調節性T細胞,從而與siPD-L1協同作用進行有效的免疫治療。
2)研究表明,CXCR4抑制納米復合物可以減少腫瘤纖維化,促進T細胞浸潤,減輕免疫抑制,從而調節免疫過程,提高抗PD-L1免疫治療的客觀應答率。
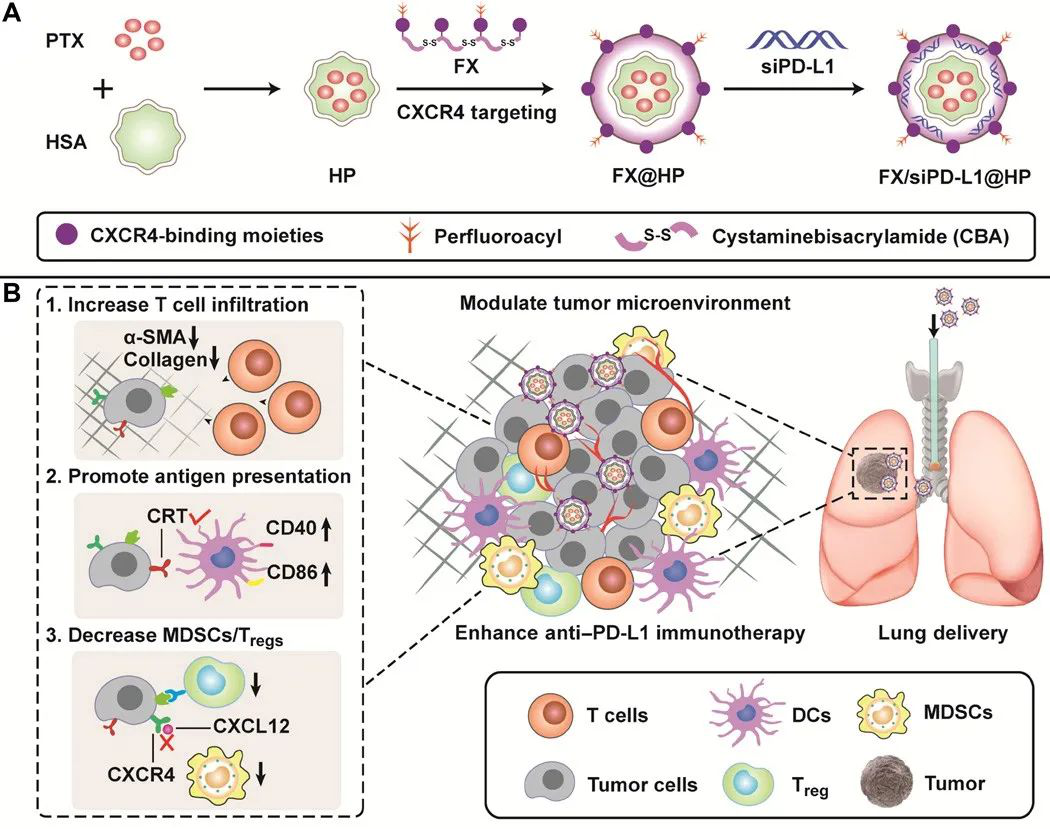
Zhaoting Li, et al. Targeting pulmonary tumor microenvironment with CXCR4-inhibiting nanocomplex to enhance anti–PD-L1 immunotherapy. Science Advances, 2020.
DOI:10.1126/sciadv.aaz9240
https://advances.sciencemag.org/content/6/20/eaaz9240
5. Science Advances:靶向同源二聚的細胞穿透肽對IRF5細胞活性的抑制作用
轉錄因子干擾素調節因子5(IRF5)是一種自身免疫易感基因,在Toll-、核苷酸結合寡聚結構域和維甲酸誘導基因I樣受體下游的病原體誘導免疫中起重要作用。正常情況下,IRF5在細胞質中不活躍,在受到刺激后,IRF5會經歷翻譯后修飾、同源二聚化和核轉位,其中二聚體介導促炎基因的轉錄。有鑒于此,范因斯坦醫學研究院的Betsy J. Barnes、美國羅氏公司的Gang Chen等研究人員,報告了破壞IRF5同源二聚化的細胞穿透肽(CPPs)的合理設計。
本文要點
1)生化和圖像分析表明,IRF5-CPPs具有細胞通透性,無細胞毒性,可直接與內源性IRF5結合。
2)IRF5-CPPs是選擇性的,具有細胞類型和物種特異性的抑制作用。在漿細胞樣樹突狀細胞中,抑制IRF5介導的干擾素-α的產生與核磷酸化的IRF5[p(Ser462IRF5]]呈劑量依賴性降低,而對pIRF5水平無影響。這些數據支持IRF5-CPPs在磷酸化下游的功能。
總之,數據支持IRF5-CPPs可以作為新的工具用于探測IRF5在疾病中的激活和功能。
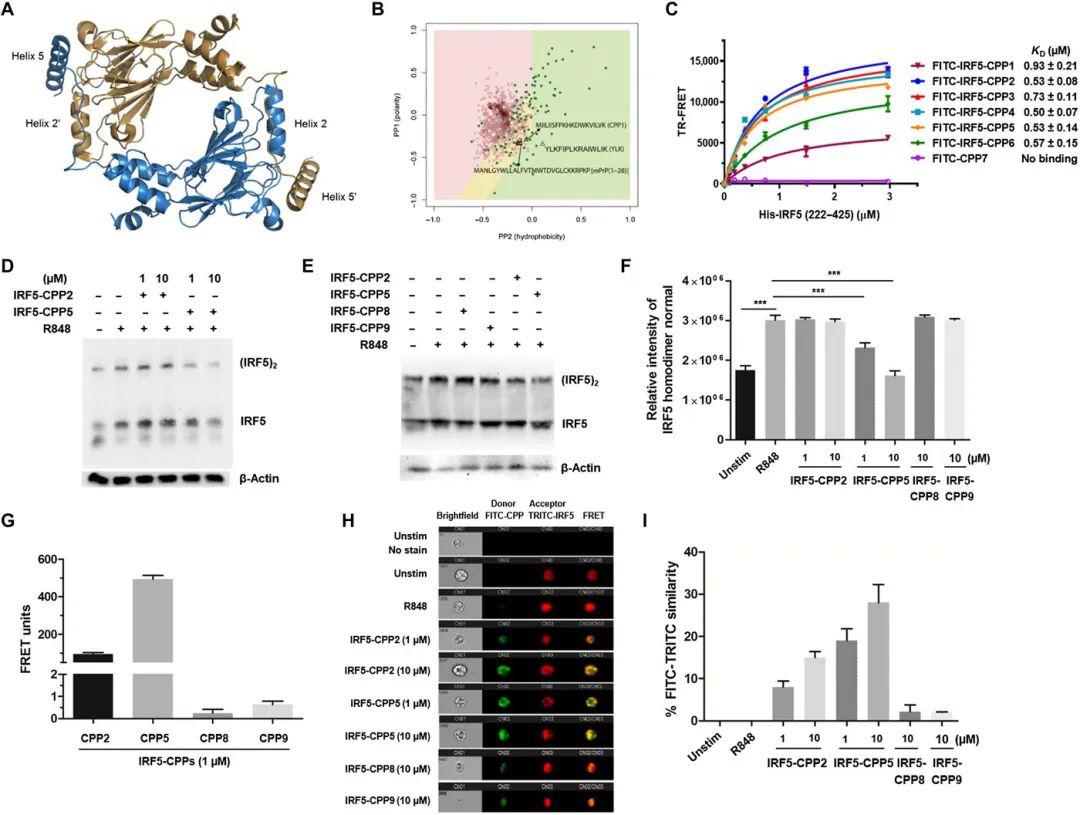
Jaspreet Banga, et al. Inhibition of IRF5 cellular activity with cell-penetrating peptides that target homodimerization. Science Advances, 2020.
DOI:10.1126/sciadv.aay1057
https://advances.sciencemag.org/content/6/20/eaay1057
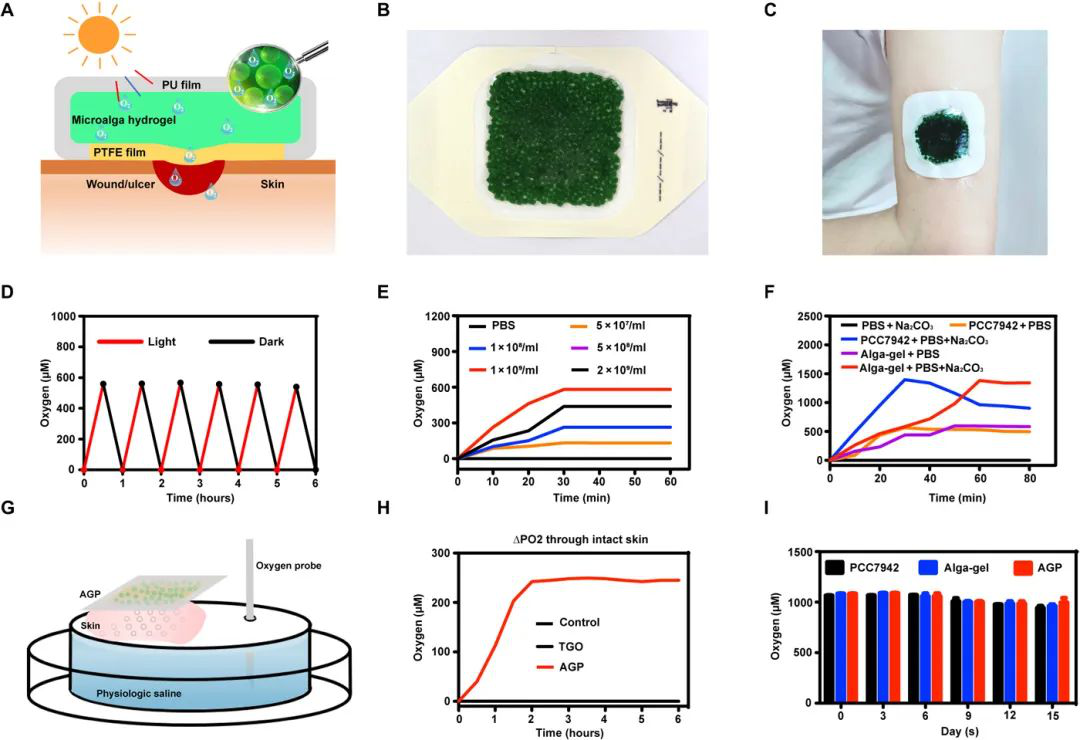
糖尿病中的慢性傷口終生會發展為糖尿病足潰瘍。氧氣通過調節細胞增殖,遷移和新血管形成對傷口愈合至關重要。但是,當前的氧氣療法,包括高壓氧(HBO)和局部氣態氧(TGO),主要采用氣態氧輸送,在穿透皮膚方面效果不佳。于此,南京大學吳錦慧和胡一橋等人介紹了一種由活性微藻水凝膠制成的產氧貼片,它可以產生溶解的氧氣。
設計思路
設計了稱為藻膠貼片(AGP)的貼片,可以簡單地覆蓋傷口并將溶解的氧氣輸送到傷口床中。在貼片中填充了直徑為1毫米的含有活微藻的水凝膠珠,可以吸收預先添加的碳酸鹽(CO2-3和HCO-3),以通過呼吸和光合作用產生O2和CO2。孔徑為0.22 μm的親水性聚四氟乙烯(PTFE)膜用作AGP的襯里,以允許清潔氣體和水雙向滲透并具有細菌過濾性能。當貼在傷口上時,由于不可滲透的聚氨酯薄膜被用作AGP的背襯,在敷料和傷口之間形成了一個密封系統。假設傷口的二氧化碳,氧氣和濕氣可以通過AGP充分升高和調節,以全時,有氧和濕法修復組織。
改善慢性傷口愈合
由溶解氧輸送的貼片的優越性能是TGO滲透皮膚效率的100倍以上。進一步的實驗表明,該貼劑可以促進體外細胞增殖,遷移和管形成,并改善糖尿病小鼠的慢性傷口愈合和皮膚移植物的存活。相信微藻膠貼片可以提供持續的溶解氧,以改善慢性傷口的愈合。
參考文獻
Chen H, et al. Dissolved oxygen from microalgae-gel patch promotes chronic wound healing in diabetes. Science Advances. 2020;6(20):eaba4311.
https://advances.sciencemag.org/content/6/20/eaba4311











