非天然糖的代謝糖工程化提供了一種強(qiáng)大的工具,可以用化學(xué)標(biāo)簽標(biāo)記細(xì)胞膜,以便隨后通過(guò)有效的化學(xué)方法靶向輸送感興趣的分子。這項(xiàng)技術(shù)已被用于癌癥靶向化療、光熱療法和光聲療法的開(kāi)發(fā),最近的努力已將其擴(kuò)展到癌癥免疫治療領(lǐng)域。然而,到目前為止,尚未探索免疫細(xì)胞(特別是樹(shù)突狀細(xì)胞(DC))的直接代謝標(biāo)記和靶向調(diào)節(jié)。由于樹(shù)突狀細(xì)胞作為適應(yīng)性免疫反應(yīng)的介質(zhì),是腫瘤免疫治療的重要靶點(diǎn)。
樹(shù)突狀細(xì)胞DCs
樹(shù)突狀細(xì)胞是人體抵御入侵者的第一道防線(xiàn),它像哨兵一樣駐扎在我們身體的所有外表面和內(nèi)表面以及大部分器官中。當(dāng)他們檢測(cè)到異物時(shí),它們變得活躍并遷移到淋巴結(jié)中,在那里它們將異物呈現(xiàn)給B細(xì)胞和T細(xì)胞以啟動(dòng)保護(hù)性反應(yīng)。
DCs在骨髓中產(chǎn)生,遷移至淋巴和外周組織,并在病原體或腫瘤抗原的背景下成熟。DCs已被熒光或放射標(biāo)記離體追蹤其經(jīng)過(guò)繼性轉(zhuǎn)移后的生物分布,但缺乏在原位特異性標(biāo)記樹(shù)突狀細(xì)胞以進(jìn)行后續(xù)追蹤和靶向調(diào)節(jié)的技術(shù)。通過(guò)獨(dú)特的標(biāo)記物在體內(nèi)靶向樹(shù)突狀細(xì)胞,可以跟蹤其遷移,并靶向傳遞免疫調(diào)節(jié)劑,以改善效應(yīng)T細(xì)胞反應(yīng)和整體抗腫瘤效果。
成果簡(jiǎn)介
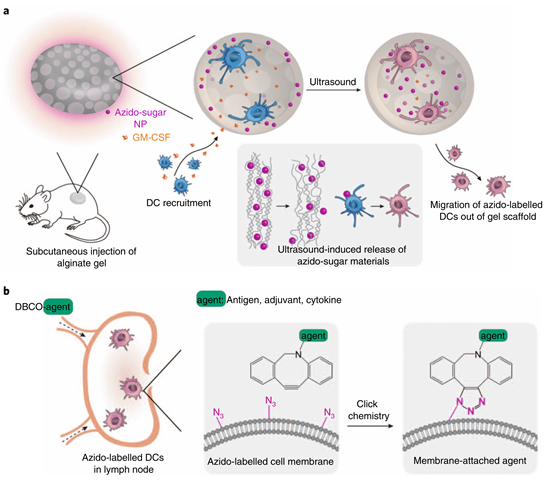
有鑒于此,生物材料大牛、哈佛大學(xué)David J. Mooney院士課題組創(chuàng)造了一種新的方法,即在體內(nèi)成功使用工程糖分子標(biāo)記DCs,即(畫(huà)重點(diǎn))使用可注射的成孔藻酸鹽釋放粒細(xì)胞巨噬細(xì)胞集落刺激因子(GM-CSF)凝膠支架來(lái)集中DCs,然后將疊氮糖材料釋放到聚集DC中,然后細(xì)胞進(jìn)行代謝處理,細(xì)胞表面標(biāo)記上了疊氮基團(tuán)。相同的分子也用作靶標(biāo),從而允許通過(guò)“點(diǎn)擊”化學(xué)作用將各種各樣的分子(帶有二苯基環(huán)辛炔(DBCO)的腫瘤抗原、佐劑、細(xì)胞因子和其他免疫調(diào)節(jié)劑)直接傳遞給DC,以調(diào)節(jié)其行為。
用這種方法可以很容易地產(chǎn)生腫瘤特異性的免疫反應(yīng),并且可以操縱DC-T細(xì)胞的相互作用來(lái)增強(qiáng)T細(xì)胞的啟動(dòng)。這項(xiàng)技術(shù)提供了前所未有的能力來(lái)操縱DC并調(diào)節(jié)DC在體內(nèi)的相互作用,并將代謝標(biāo)記的應(yīng)用擴(kuò)展到免疫療法。
該項(xiàng)研究于5月18日發(fā)表在Nature Materials上,第一作者為該研究院的博士后王華博士,值得一提的是,王華博士于2018年同樣以第一作者在Nature Materials上發(fā)表綜述論文,綜述了迄今開(kāi)發(fā)的針對(duì)樹(shù)突狀細(xì)胞,T細(xì)胞,腫瘤相關(guān)巨噬細(xì)胞,髓樣來(lái)源的抑制細(xì)胞,B細(xì)胞和自然殺傷細(xì)胞的靶向調(diào)節(jié)的免疫材料,并總結(jié)針對(duì)細(xì)胞的有望和面臨的挑戰(zhàn)免疫調(diào)節(jié)治療癌癥。


示意圖
功能化、納米化解決體內(nèi)局限性
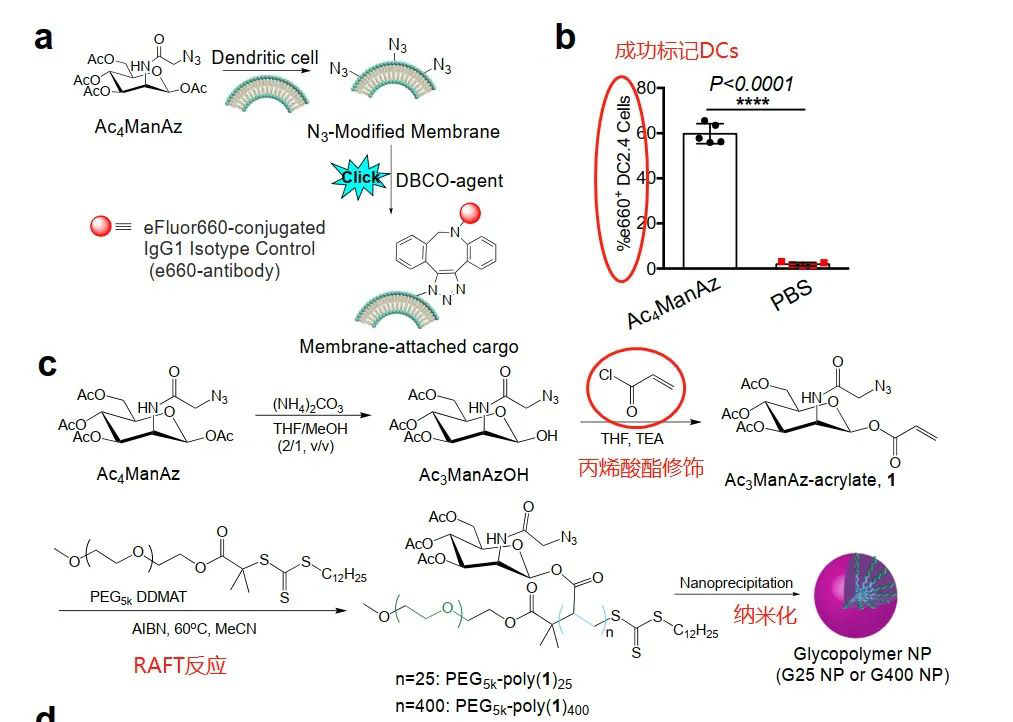
首次證實(shí)了常用的代謝標(biāo)記試劑疊氮修飾甘露糖(Ac4ManAz)在體外用疊氮基基團(tuán)標(biāo)記DC2.4細(xì)胞的能力。但是呢,Ac4ManAz在體內(nèi)使用卻存在許多局限性,包括水溶性低、包封性差以及從水凝膠中突釋。
為了解決這些問(wèn)題,研究人員用丙烯酸酯鍵對(duì)Ac4ManAz的C1位點(diǎn)進(jìn)行功能化,然后進(jìn)行可逆加成-斷裂鏈轉(zhuǎn)移聚合反應(yīng)(RAFT),得到聚疊氮糖n(n=25(G25)或n=400(G400))。然后分別通過(guò)G25和G400的納米沉淀制備平均直徑分別為70和130nm的G25和G400納米顆粒(NPs)。
標(biāo)記和功能化
按需釋放
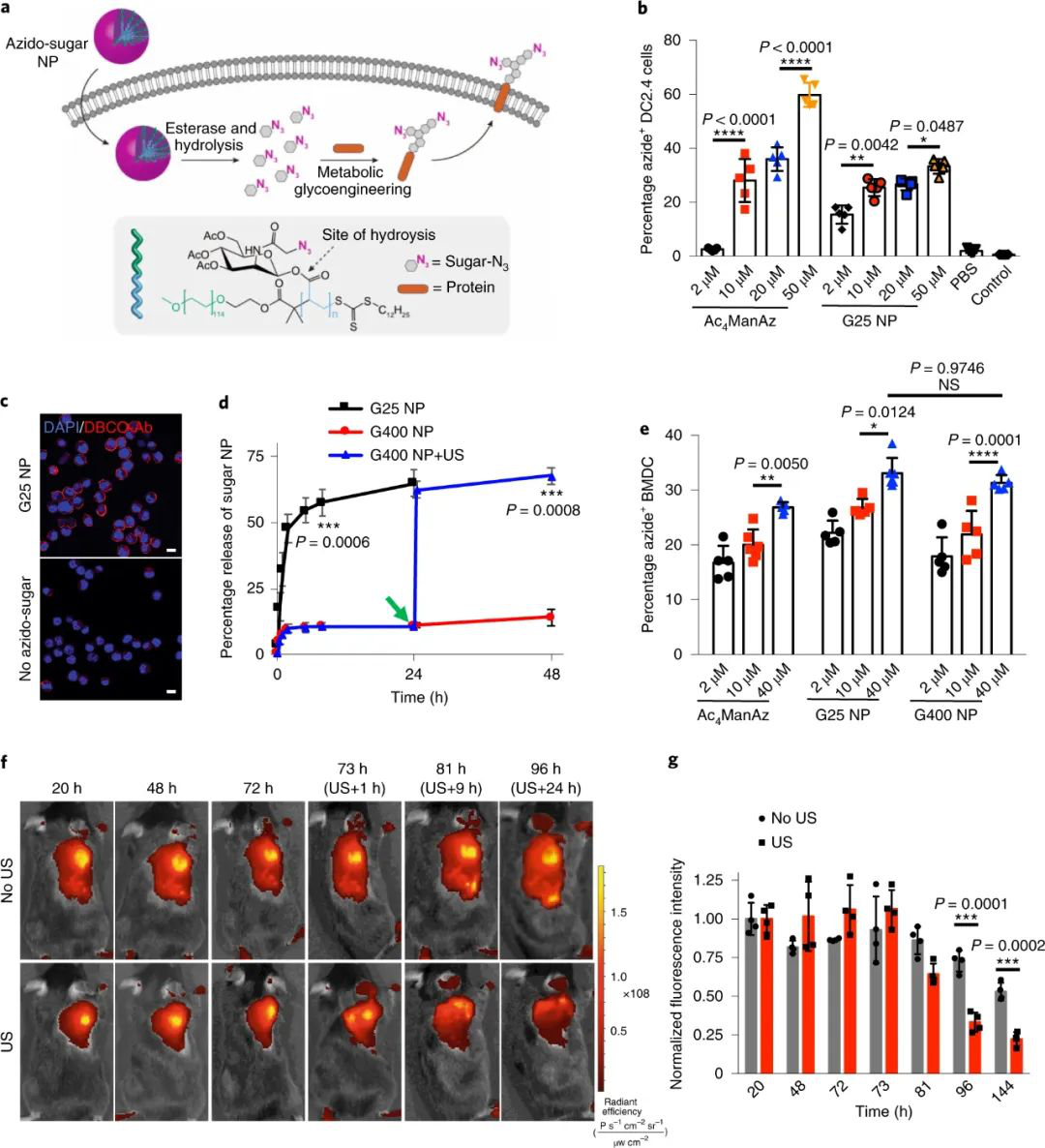
研究表明,G25和G400 NP能夠以濃度依賴(lài)的方式進(jìn)入DC2.4細(xì)胞和骨髓源DCs(BMDCs)并對(duì)其進(jìn)行代謝標(biāo)記。G400 NP的攝取不影響B(tài)MDCs的激活,且可通過(guò)超聲觸發(fā)釋放,故G400 NP用于后續(xù)研究。
圖|代謝標(biāo)記DCs與按需釋放
體內(nèi)招募和標(biāo)記DCs試驗(yàn)
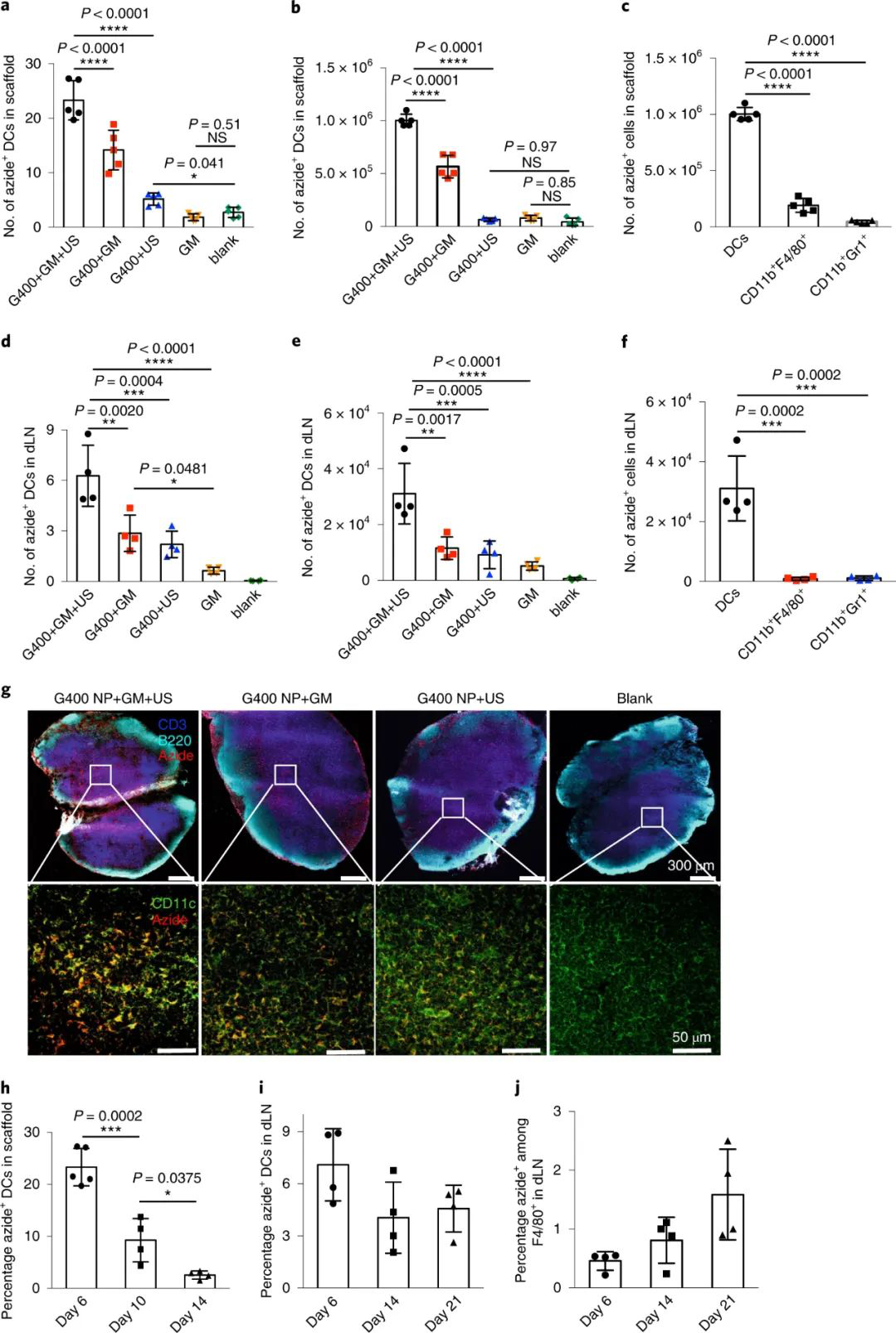
研究小組然后將其植入活體小鼠體內(nèi)。三天后,當(dāng)支架內(nèi)DCs濃度達(dá)到峰值時(shí),將植入的支架暴露于超聲波輻射下,這將使水凝膠支架的結(jié)合松動(dòng),并允許疊氮糖納米顆粒被釋放,隨后被DCs攝取和處理。
為了測(cè)試疊氮糖分子如何可靠地追蹤標(biāo)記的樹(shù)突狀細(xì)胞,研究人員計(jì)算了小鼠淋巴結(jié)中疊氮陽(yáng)性樹(shù)突狀細(xì)胞的數(shù)量。他們發(fā)現(xiàn),與接受無(wú)超聲支架或空白支架的小鼠相比,接受含糖水凝膠支架和超聲治療的小鼠淋巴結(jié)中存在大量疊氮陽(yáng)性樹(shù)突狀細(xì)胞。疊氮標(biāo)記物在淋巴結(jié)樹(shù)突狀細(xì)胞表面持續(xù)21天,表明它們可用于對(duì)樹(shù)突狀細(xì)胞活性的長(zhǎng)期跟蹤和研究。
體內(nèi)招募并代謝標(biāo)記含疊氮基團(tuán)的樹(shù)突狀細(xì)胞
更進(jìn)一步!調(diào)節(jié)DCs的行為
做到能夠在活體內(nèi)標(biāo)記和跟蹤DCs本身就是一項(xiàng)成就,但是該團(tuán)隊(duì)想要的不止這些,猜想可不可以使用相同的標(biāo)記來(lái)控制DCs的行為?于此,研究人員轉(zhuǎn)向了“點(diǎn)擊化學(xué)”,推測(cè)疊氮的搭檔二苯基環(huán)辛炔(DBCO)可以通過(guò)將分子“貨物”直接附著在淋巴結(jié)中的DCs上,而將其傳遞給DCs。
理下思路:前面的植入水凝膠支架和超聲已經(jīng)將DCs帶上疊氮基團(tuán)了,然后他們?cè)兕~外注射與疊氮基團(tuán)match的DBCO,這個(gè)DBCO又額外連接上其他免疫細(xì)胞因子,然后在體內(nèi)進(jìn)行點(diǎn)擊化學(xué),使得DC帶上細(xì)胞因子,然后對(duì)T細(xì)胞進(jìn)行激活,進(jìn)而殺死外來(lái)病菌等異物。
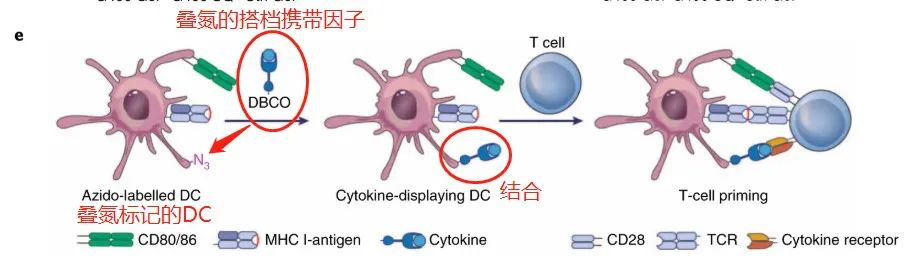
圖|調(diào)節(jié)DC行為
研究人員使用熒光分子(Cy5),細(xì)胞因子(IL-15/IL-15Rα,出現(xiàn)在DCs表面會(huì)觸發(fā)CD8+ T細(xì)胞和NK細(xì)胞的增殖)與DBCO偶聯(lián),然后在經(jīng)過(guò)前面支架植入和超聲后,進(jìn)行注射,結(jié)果顯示,接受靶向細(xì)胞因子的小鼠產(chǎn)生了針對(duì)肽的更強(qiáng)的T細(xì)胞反應(yīng),并且重要的是,沒(méi)有顯示出任何副作用,因?yàn)檫@種方法所需的細(xì)胞因子劑量比過(guò)去的研究低100倍。
點(diǎn)擊即可抗擊癌癥的化學(xué)
最后,研究人員通過(guò)將E7或CpG與DBCO結(jié)合進(jìn)行上一步同樣的操作,以進(jìn)行抗癌研究,結(jié)果顯示出該系統(tǒng)能提供抗癌的全面保護(hù),還可以有效治療患有已確立的肺癌腫瘤的小鼠。這些實(shí)驗(yàn)證明了這種DC靶向腫瘤疫苗策略的有效性和廣泛適用性。
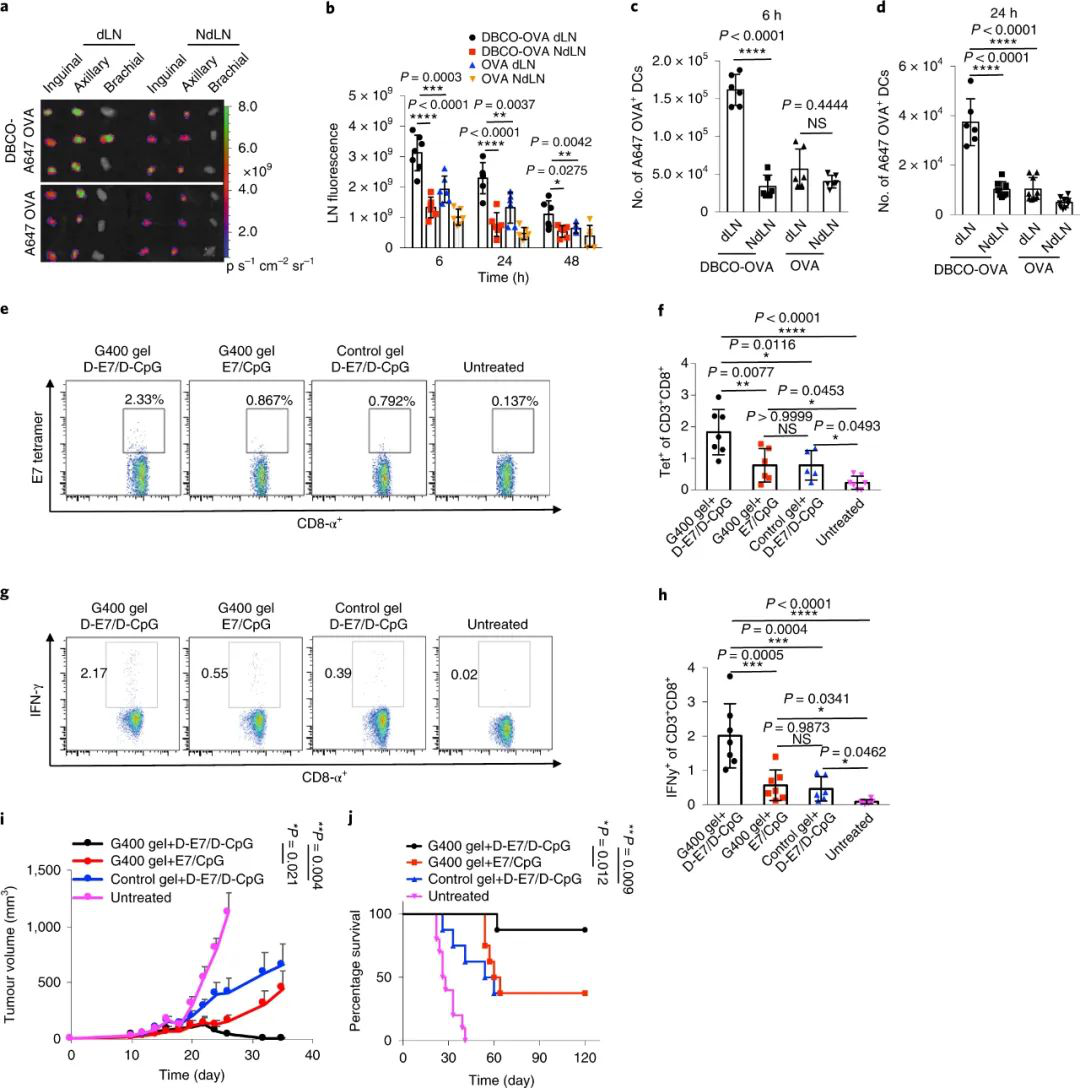
圖|有效的免疫應(yīng)答
小結(jié)
這種DC標(biāo)記和靶向調(diào)節(jié)技術(shù)為在體內(nèi)操縱DC和調(diào)節(jié)DC-T細(xì)胞相互作用提供了前所未有的策略。該論文描述的靶向方法涉及皮下注射裝載有趨化因子和疊氮基糖材料的凝膠,超聲處理和DBCO修飾的癌癥疫苗或免疫調(diào)節(jié)劑的給藥,具有顯著的臨床轉(zhuǎn)化潛力。
據(jù)悉,Mooney實(shí)驗(yàn)室正在繼續(xù)探索可以通過(guò)該系統(tǒng)傳遞到DC的不同類(lèi)型的分子,并計(jì)劃將其應(yīng)用于研究和介導(dǎo)其他免疫細(xì)胞相互作用。
參考文獻(xiàn):
Wang,H., et al. Metabolic labeling and targeted modulation of dendritic cells. Nat.Mater. (2020).
https://doi.org/10.1038/s41563-020-0680-1
簡(jiǎn)介:
David Mooney

David Mooney,哈佛大學(xué)Wyss研究所的核心教員,是生物材料,機(jī)械轉(zhuǎn)導(dǎo),藥物遞送,組織工程和免疫工程領(lǐng)域的領(lǐng)導(dǎo)者。他是多個(gè)國(guó)家科學(xué)院的院士,因其研究和指導(dǎo)/教學(xué)而獲得了多項(xiàng)獎(jiǎng)項(xiàng)。發(fā)表了400多篇文章,并獲得了多項(xiàng)專(zhuān)利,其中多項(xiàng)已獲得公司許可,從而獲得成功的商業(yè)產(chǎn)品。
主要研究領(lǐng)域:了解細(xì)胞如何感知其環(huán)境中的信號(hào)以及這如何改變細(xì)胞行為。他的實(shí)驗(yàn)室開(kāi)發(fā)了利用這些信號(hào)來(lái)調(diào)節(jié)特定細(xì)胞及其功能的生物材料。他們是第一個(gè)在3-D培養(yǎng)中證明底物的機(jī)械特性決定干細(xì)胞命運(yùn)的物質(zhì)。他的實(shí)驗(yàn)室還開(kāi)發(fā)了首個(gè)可植入生物材料癌癥疫苗,其中包含生化線(xiàn)索以募集和重新教育免疫系統(tǒng)以破壞癌細(xì)胞。Dave的目標(biāo)是將在細(xì)胞生物學(xué)方面的知識(shí)與材料結(jié)合起來(lái),以提高治療效果。











