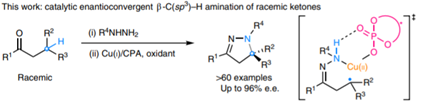
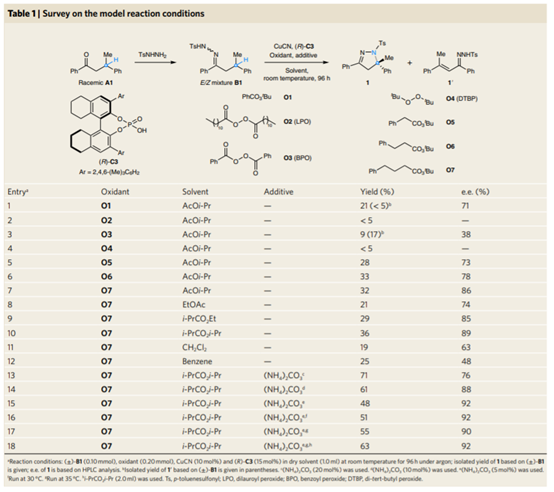
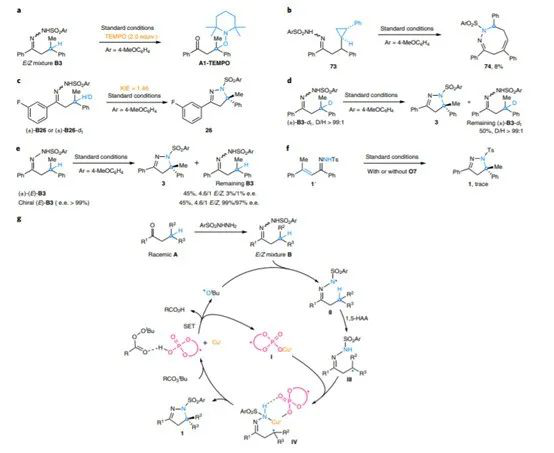
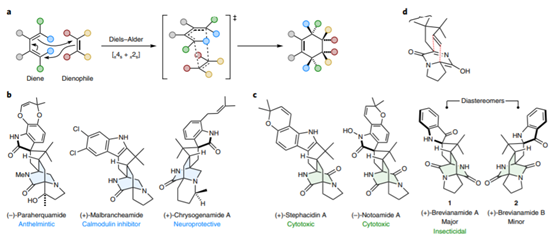
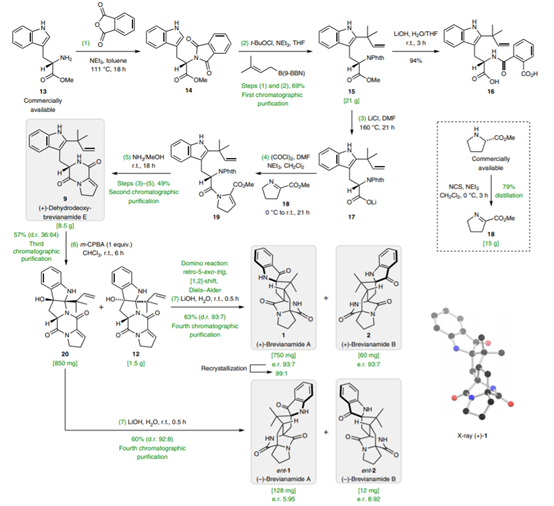
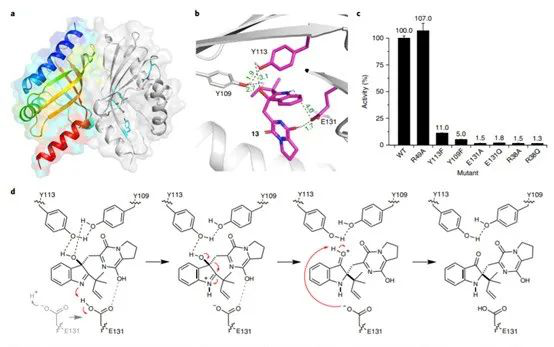
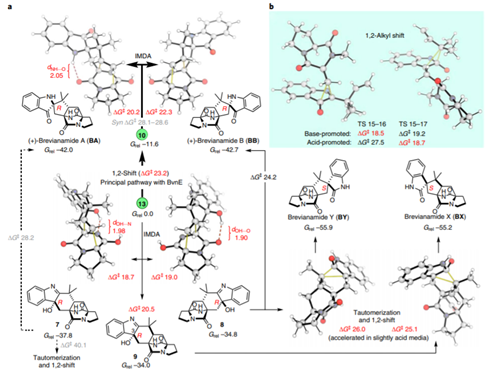
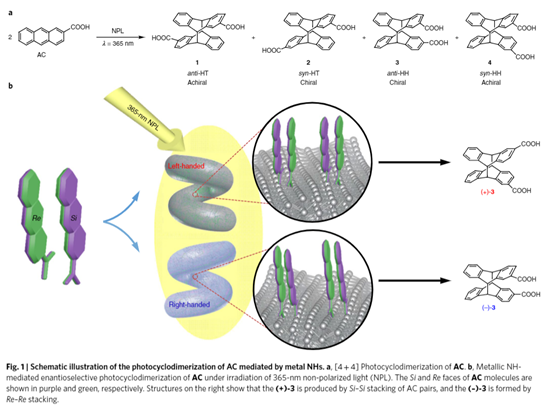
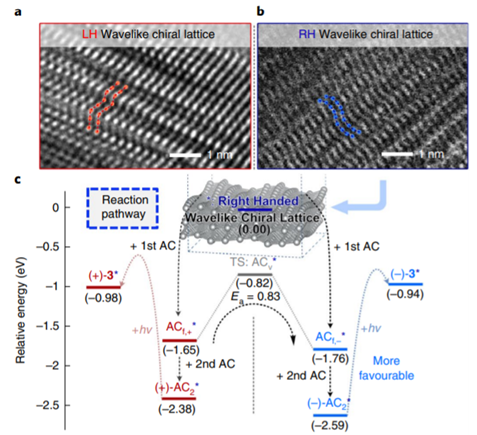
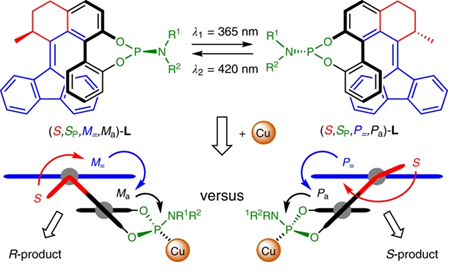
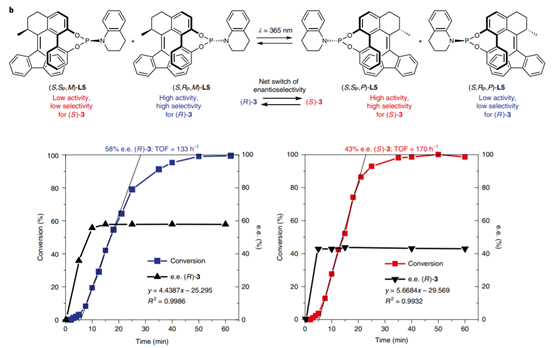
1. 最近手性催化中的發展,在Nature Chemistry、Nature Catalysis上報道了一些構建手性結構的工作3. 吲哚生物堿大分子布雷維亞酰胺酶催化過程分析/人工全合成4. 四川大學等單位納米螺旋金屬手性環境構建手性反應5. 格羅寧根大學光響應配體通過調光對反應手性控制一、Nature Catalysis:消旋碳原子構建手性的開創性工作第一作者:Chang-Jiang Yang, Chi Zhang, Qiang-Shuai Gu(共同一作)創新性的實現了對消旋的三級碳上C-H鍵胺基化并將其轉變為手性中心,該工作是racemic消旋位點手性化領域的開創性工作。過渡金屬催化劑在大量C(sp3)-H對映性官能團化反應中廣泛存在,但是外消旋(racemic)的三級C(sp3)-H鍵的對映化反應之前完全沒有相關報道。該種反應過程中存在的問題在于手性的保留難以實現,為了實現這個目標,南方科技大學劉心元等通過手性Cu催化劑進行摘氫反應,并對三級C(sp3)-H實現胺基化。通過這種方法和隨后的轉化反應合成了含有手性季碳中心的有機分子,該工作為設計高效手性催化劑對消旋的三級C(sp3)-H對映轉化反應提供了經驗和參考。通過苯甲酮基取代的芳基分子作為反應物,對無手性的芐基位點構建手性中心。首先通過TsNHNH2和底物中的羰基反應,轉化為亞胺物種。隨后在CuCN/軸芳烴修飾的磷酸作為催化體系,PhCO3tBu、BPO、DTBP等作為活化C-H鍵的氧化劑,在室溫中進行反應。通過對氧化劑和溶劑篩選,得到最優反應條件。氧化劑篩選結果顯示,Ph(CH2)3CO3tBu和i-PrCO2i-Pr溶劑配合有最好的效果。當反應中加入2倍量Ph(CH2)3CO3tBu氧化劑,5 mol % (NH4)2CO3在35 ℃的Ar氣氛中以63 %的產率和92 % ee值進行。底物拓展結果顯示,芳基磺酸肼中芳基上甲基、甲氧基、氟、氯、溴、三氟甲基、羧酸甲酯、氰基、NO2等取代反應物中至少得到92 %的ee值,叔丁基取代的芳基磺酸肼產物的ee值稍低(86 %)。對各種產物的產率隨著芳基磺酸肼上芳環的電子濃度變化,缺電子的芳環產率偏低,富電子的芳環產率更高。對底物上三級碳的鄰位芳基兼容性進行測試,結果顯示芳基上甲氧基、甲基、叔丁基、氟、氯、溴、三氟甲基、羧酸甲酯、苯乙炔基、BPin、苯并噻吩、金剛烷基等取代的底物有兼容性,其中,芳基鄰位上氯取代的手性產物ee值偏低(81 %),當芳環被金剛烷基/噻吩基/叔丁基取代的手性產物ee值偏低,分別為73 %、78 %、80 %。通過TEMPO捕獲實驗驗證了該反應通過反應的自由基反應過程,通過攜帶環丙基的底物產物分析驗證了反應自由基反應過程,通過對反應物進行D代,結果顯示反應過程中反應物中的D保留,驗證了反應中通過1,5-HAA(抓氫原子)進行。由此提出了合理的反應機理:Cu(I)催化劑和過氧化物通過單電子轉移過程生成的高反應活性叔丁氧基自由基反應生成手性Cu(II)磷酸催化劑,隨后叔丁氧基自由基和肼上的N-H鍵反應生成N·中心自由基,并通過分子內的1,5-HAA抓氫過程生成三級碳前手性自由基物種,最后Cu(II)催化劑和生成的三級碳自由基反應構建手性C-N鍵產物分子。該反應中通過連續的HAA抓氫自由基過程/手性自由基官能團化,能夠兼容碳的去手性過程,因此該方法能夠應用于消旋分子構建含有手性碳的分子。這種作用可能在開發消旋碳原子的手性化催化劑上引發新型催化劑的發展。Chang-Jiang Yang, Chi Zhang, Qiang-Shuai Gu,Jia-Heng Fang, Xiao-Long Su, Liu Ye, Yan Sun, Yu Tian, Zhong-Liang Li &Xin-Yuan Liu*. Cu-catalysed intramolecular radicalenantioconvergent tertiary β-C(sp3)–H amination of racemicketones,Nature Chemistry 2020DOI:10.1038/s41929-020-0460-yhttps://www.nature.com/articles/s41929-020-0460-y二、Nature Catalysis & Nature Chemistry:吲哚生物堿大分子布雷維亞酰胺人工合成和自然酶催化合成過程分析核心內容:Dia-Alder [4+2]環加成手性合成重要吲哚生物堿大分子布雷維亞酰胺海洋真菌衍生物雙環[2.2.2]二氮雜烷生物堿(bicyclo[2.2.2]diazaoctane alkaloids)是廣泛關注的一種功能性分子,這是因為其具有多種多樣的生物活動。其中毒性代謝物(+)-布雷維亞酰胺(metabolite (+)-brevianamide)的合成復雜困難、生物作用難以理解。愛丁堡大學AndrewL. Lawrence等報道了化學合成這種(+)-布雷維亞酰胺分子,該反應通過7個步驟,以7.5 %的總收率得到750 mg產物分子。其中包括了從(-)-dehydrobrevianamide到(+)-brevianamide A的合成。(1)合成步驟。反應首先對市售L-色氨酸甲酯的胺基通過鄰苯二甲酸酐(Phthalicanhydride)形成鄰苯二甲酰胺實現保護,隨后與9-BBN在t-BuOCl/NEt3作用中反應,對C-H鍵活化,加成烯丙基,本步驟中的產率達到69 %。隨后在DMF溶劑中與LiCl中反應,對酯上的甲基取代生成對應的鋰鹽,隨后在(COCl)2處理生成對應的酰氯。并與脫氫脯氨酸反應,將酰氯轉化為酰胺結構。隨后在NH3甲醇溶液中反應,將鄰苯二甲酰、酯上的甲醇基水解,并生成分子內酰胺。隨后在1倍量的m-CPBA反應中,氧化吲哚的雙鍵,并和分子中的N-H鍵反應,生成對應的N-C鍵。隨后在室溫中LiOH水溶液中反應0.5 h,以~60 %的收率得到最終產物。Robert C. Godfrey, Nicholas J.Green, Gary S. Nichol & Andrew L. Lawrence*. Total synthesis of brevianamideA,Nature Chem. 2020,DOI:10.1038/s41557-020-0442-3https://www.nature.com/articles/s41557-020-0442-3第一作者:Ying Ye, Lei Du(共同一作)通訊作者:David H. Sherman,Robert M.Williams,李盛英通訊作者單位:密歇根大學,山東大學,科羅拉多州立大學核心內容:吲哚生物堿大分子布雷維亞酰胺酶催化合成過程分析真菌類[2.2.2]雙環二氮辛烷吲哚生物堿是一種重要的天然產物種類,并且有廣泛的生物活性。雖然目前通過仿生策略能對代表性的化合物進行合成,但是其生物相關的性質,特別是對映異構體的組裝過程和對映體代謝物(antipodal metabolites)沒有得到很好的表征。Brevianamide A亞種是一類具有二氧哌嗪中心結構和3-spiro-ψ-indoxyl骨架結構,密歇根大學David H. Sherman、科羅拉多州立大學Robert M. Williams、山東大學李盛英、日本熊本大學、英國牛津大學、中科院青島市生物能源與生物工藝技術研究所等闡明了短密青霉菌(Penicillium brevicompactum)NRRL 864和其代謝途徑(metabolic pathway)。作者發現該過程中BvnE作為異構酶/半頻哪醇酶(isomerase/semipinacolase)實現了選擇性反應生成天然產物分子。對BvnE的結構解析、分子建模、突變分析,和量子化學計算為生成Brevianamide A中的3-spiro-ψ-indoxyl組分的機理進行分析。通過詳細的研究結果,作者發現該過程中經歷了半頻哪醇重排反應(semipinacol rearrangement)和隨后的分子內[4+2]Diels-Alder成環反應。(1)量子計算分析反應機理。對反應中通過半頻哪醇重排過程生成3-spiro-ψ-indoxyl產物的過程計算顯示,該過程是放熱過程(ΔG=-11.6 kcal mol-1),因此該反應能夠很好的進行;對Diers-Alder反應過程的計算結果顯示,反應中優先對反式結構環加成源于C-H…O氫鍵作用和立體位阻作用導致。通過對BvnE的生物合成過程分析,發現其中通過對映體控制的[4+2]環加成反應進行,對雙環[2.2.2]二氮辛烷核心結構的構建過程通過量子計算化學進行分析,計算結果支持該反應中[4+2]周環反應。Ying Ye, Lei Du, Xingwang Zhang, Sean A.Newmister, Morgan McCauley, Juan V. Alegre-Requena, Wei Zhang, Shuai Mu,Atsushi Minami, Amy E. Fraley, Maria L. Adrover-Castellano, Nolan A. Carney,Vikram V. Shende, Feifei Qi, Hideaki Oikawa, Hikaru Kato, Sachiko Tsukamoto,Robert S. Paton, Robert M. Williams*, David H. Sherman * & Shengying Li*. Fungal-derived brevianamide assembly by astereoselective semipinacolase,Nature Catalysis 2020,DOI:10.1038/s41929-020-0454-9https://www.nature.com/articles/s41929-020-0454-9三、Nature Chemistry:構建手性界面調控界面合成的手性選擇性第一作者:Xueqin Wei, Junjun Liu, Guang-Jie Xia(共同一作)通訊作者:楊成、Wang Yang-Gang、黃陟峰通訊作者單位:四川大學,南方科技大學,香港浸會大學核心內容:構建手性表面結構,在手性表面構建手性分子。在沒有手性引發劑的情況中對分子構建手性結構具有較高的難度,同時是深入理解同手性(homochirality)的好方法,四川大學楊成、南方科技大學Wang Yang-Gang、香港浸會大學黃陟峰等通過控制螺旋金屬納米材料的偏手性(handedness)實現了對分子的手性調控,該過程中通過在基底上控制沉積分子的掠射角按照順時針/逆時針方向旋轉實現對吸附在表面分子的手性實現調控。對2-蒽羧酸分子對映性吸附在納米螺旋金屬上,形成反頭對頭二聚體的對映手性結構,該產物在納米螺旋金屬的手性作用中,經過光催化環加成反應會生成對應的Si-Si或者Re-Re堆疊結構:左手性/右手性的納米螺旋金屬材料生成(+)-二聚體/(-)-二聚體。密度泛函理論結果顯示,光催化環加成產物的手性是由在螺旋金屬材料上的手性堆疊過程導致的。(1)在<10 nm的金屬螺旋上修飾-NH2基團,隨后將2-蒽羧酸通過和-NH2之間的相互作用負載到金屬螺旋上,由于這種較小的納米手性金屬螺旋材料表面上展現增強的波浪狀手性晶格結構,展現了對吸附分子結構有選擇性(手性吸附能量有區別,導致優先手性選擇性)。此外,這個體系能夠對納米螺旋材料近表面上的光有手性選擇的吸收作用,并提供了一種通過外界條件對分子的手性結構進行調控的方法。Xueqin Wei, Junjun Liu, Guang-JieXia, Junhong Deng, Peng Sun, Jason J. Chruma, Wanhua Wu, Cheng Yang*, Yang-GangWang* & Zhifeng Huang*. Enantioselective photoinducedcyclodimerization of a prochiral anthracene derivative adsorbed on helicalmetal nanostructures,Nature Chem 2020,DOI:10.1038/s41557-020-0453-0https://www.nature.com/articles/s41557-020-0453-0四、Nature Catalysis:光響應配體結構調控反應產物的手性第一作者:Pizzolato, S.F., ?tacko, P.(共同一作)生物體、人工系統中的手性傳遞和放大實現動態控制結構和功能的基本過程,目前很少有體系能夠對手性有動態的傳遞功能或者表現為光響應的手性傳感器。最近格羅寧根大學Ben L. Feringa等在這個課題中取得了重要進展,他們發現了一種對光響應的亞磷酰胺配體結構,基于手性的雙芳基取代基,通過改變光輸入,能夠調節Cu催化不對稱共軛加成反應,實現相反的手性選擇性。在相互對映亞磷酰胺配體作用中,每種手性的配體分子分別展現出不同的催化反應活性和手性作用,并且通過光的控制實現對產物手性的控制。在對烯烴的光聚合反應中,手性的選擇性通過光進行調控,本工作為開發復雜光響應的手性催化劑體系和多功能催化劑的開發給出了可能性。(1)配體分子合成。通過含有雙酚結構的分子作為反應物,在PCl3、有機胺、三乙胺作用中,于THF溶劑中的0 ℃中反應,實現了將酚羥基轉變為對應的膦胺組分。 反應設計。開發了一類配體分子,具有對365 nm((S, Sp, M)-L)和420 nm((S, Sp, P)-L)光的反應性,分別在365 nm和420 nm光照射作用中實現手性結構的調控。通過光的作用,在365 nm光中,配體和Cu組成的Cu(S, Rp, M)-L的手性催化體系對(R)手性產物有更好的選擇性;在420 nm光中,配體和Cu組成的Cu(S, Rp, P)-L的手性催化體系對(S)手性產物有更好的選擇性。(2)對催化反應動力學過程進行表征,結果顯示在60 min反應過程中,分別展現了對(R)手性產物得到58 %的ee值,轉化頻率為133 h-1;對(S)手性產物得到43 %的ee值,轉化頻率170 h-1。Stefano F. Pizzolato, Peter?tacko, Jos C. M. Kistemaker, Thomas van Leeuwen & Ben L. Feringa*. Phosphoramidite-basedphotoresponsive ligands displaying multifold transfer of chirality in dynamicenantioselective metal catalysis,Nature Catalysis 2020DOI:10.1038/s41929-020-0452-yhttps://www.nature.com/articles/s41929-020-0452-y手性是宇宙間的普遍特征,體現在生命的產生和演變過程中。例如,自然界存在的糖以及核酸、淀粉、纖維素中的糖單元,都為D—構型;地球上的一切生物大分子的基元材料α—氨基酸,絕大多數為L—構型;蛋白質和DNA的螺旋構象是右旋的;而且人們還發現,海螺的螺紋和纏繞植物也都是右旋的。生物體內存在著手性環境,作用于生物體內的藥物及農藥,其藥效作用多與它們和體內靶分子間的手性匹配和手性相關。在用于治療的藥物中,有許多是手性藥物。(https://baike.baidu.com/item/手性分子)