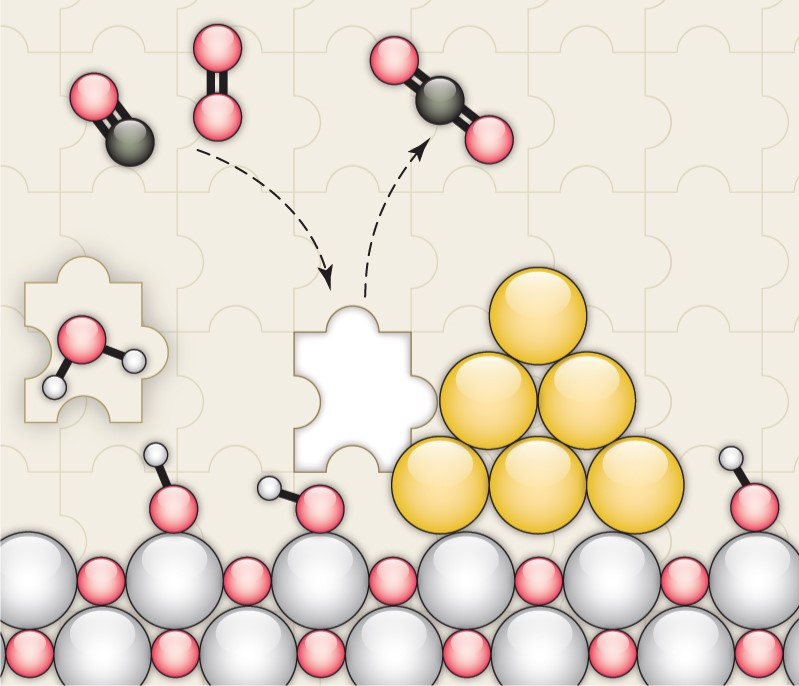
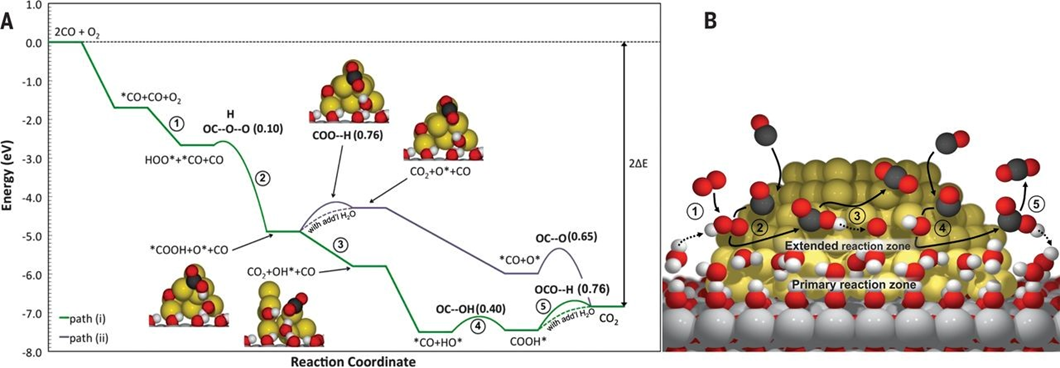
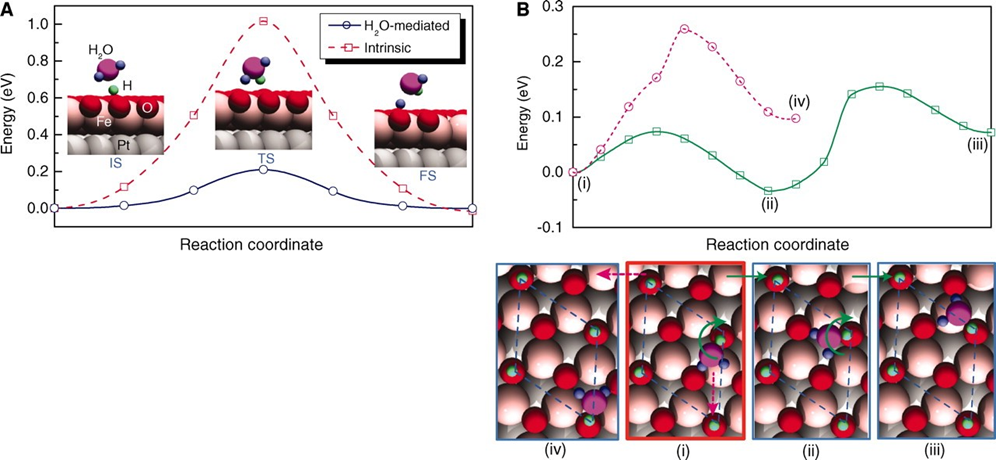
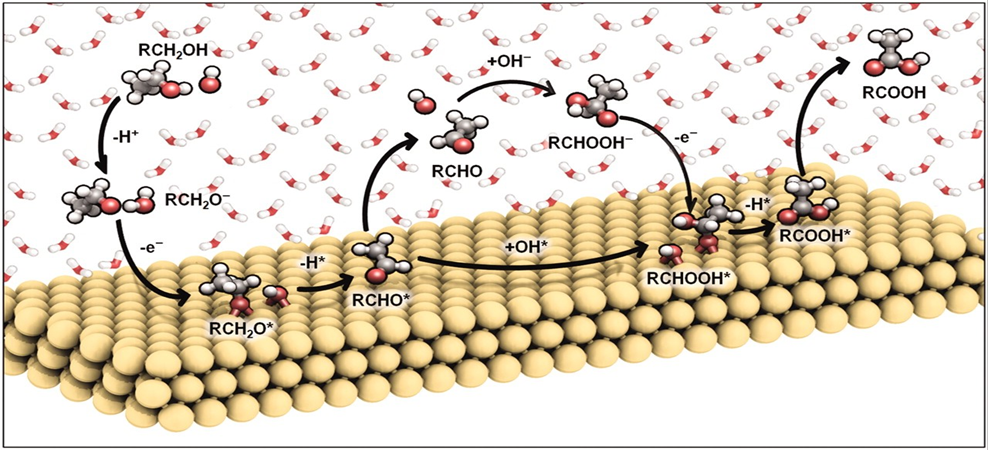
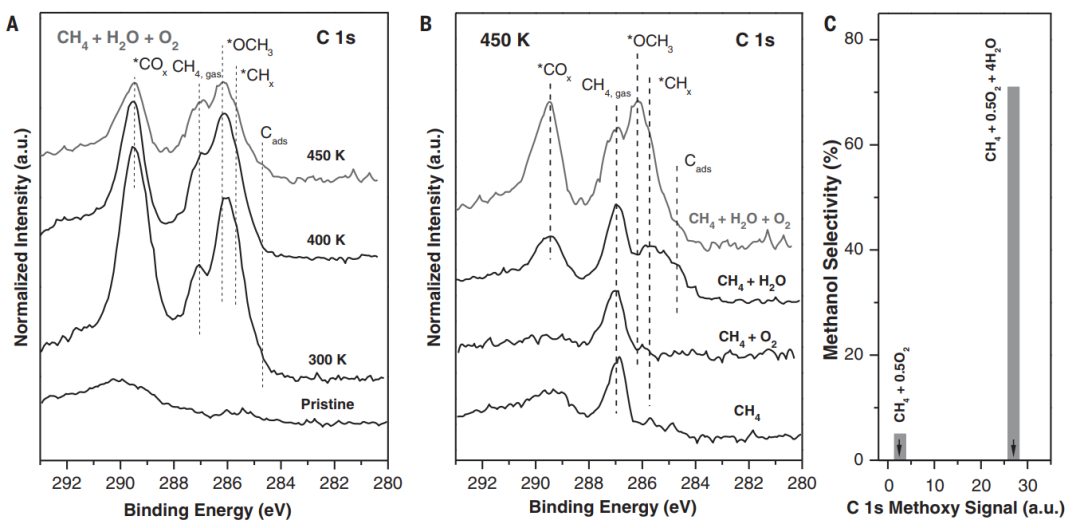
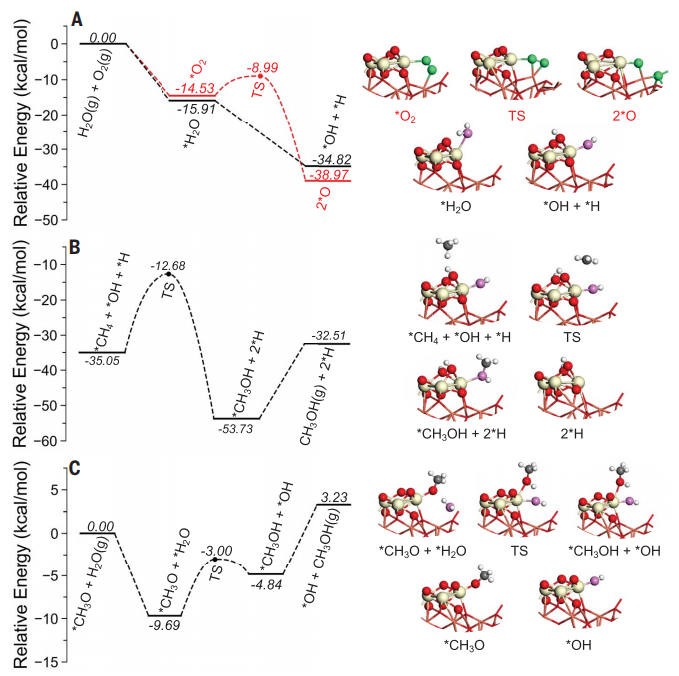
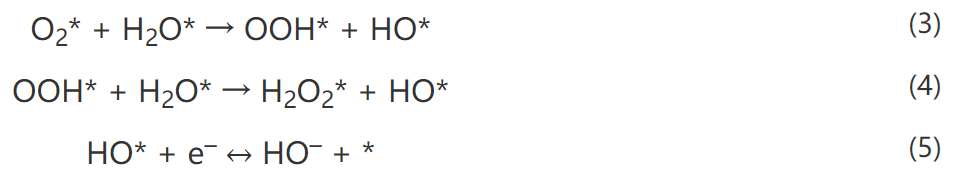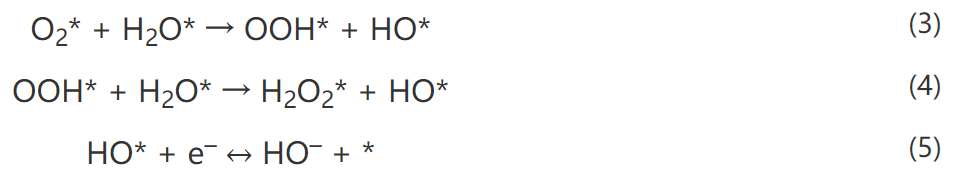我說的水,就是水,是個名詞,不是形容詞。水真的是個好東西,不僅能孕育生命,還能幫助我們認識世界,發(fā)現(xiàn)真理,順便發(fā)表幾篇Science。早在1989年,日本科學家M.Haruta等人發(fā)現(xiàn)Au納米催化劑對CO氧化具有很高的活性。15年之后的2004年,M. Daté等人發(fā)現(xiàn),在反應體系中加入微量水可以將CO催化活性提高幾個數(shù)量級。各大科研團隊開始陷入一陣狂熱。有人就要問了,why?剛開始,大家都覺得,這個簡單的一個反應,機理應該不是很難吧?研究來,研究去,10年又過去了,大家得出了一大堆結(jié)論,卻始終沒弄清楚why?各個研究團隊的結(jié)論甚至相互矛盾,很多人不知不覺就得罪了大牛,各個課題組之間也暗暗結(jié)下了不少梁子。直到2014年,Lars C. Grabow和Bert D. Chandler團隊橫空出世,提出了一個更加令人信服的機理,相關(guān)成果發(fā)表在Science雜志。關(guān)于水為什么能大幅CO催化活性的機理爭論,主要集中于2個問題:1)水是通過促進表面中間體的分解還是通過促進反應物的活化來增強活性?2)活性位點是存在于金催化劑表面還是金-載體界面?LarsC.Grabow和Bert D. Chandler團隊在實驗上觀察到,O-H或O-D鍵的斷裂是反應中的關(guān)鍵步驟。DFT理論計算表明,Au/TiO2界面上的吸附H2O有助于降低O2活化能壘。因此,他們認為,金催化劑表面和Au/TiO2界面都參與反應。1)水既起到活化O2的作用,又促進*COOH的分解生成CO2。2)載體和界面主要用于活化O2,而涉及到與*OOH 與*CO的反應則在Au表面進行。這種機制綜合了先前的各種水增強CO氧化反應機理,使那些看似相互矛盾的說法融合在一起。在催化研究中,氧化物表面上的質(zhì)子擴散是一個關(guān)鍵過程。尤其是在“氫溢流”效應中,氫的擴散顯得更加重要,因為H2解離或吸附的活性位點和其他反應的活性位點在空間上是獨立的。許多具有加氫活性的催化劑,由分散在高比表面氧化物載體上的金屬納米顆粒組成。H2在金屬納米顆粒上解離產(chǎn)生H原子,然后從金屬納米顆粒遷移到氧化物上,并穿過氧化物表面遷移到所吸附的反應物上。大量研究表明,在少量水存在的情況下,質(zhì)子擴散速率得到顯著增強。那么,問題來了,why?氧化物材料表面極其復雜性,很難在原子水平上對其進行表征,固體表面上質(zhì)子擴散的基本機制以及影響因素仍然不穩(wěn)定。表面科學方法使用原子級平坦的單晶表面作為模型系統(tǒng),可以在良好控制的條件下對表面反應進行精確的原子尺度表征,對于深入解析非均相催化劑的復雜表面起到重要作用。2012年5月,丹麥奧胡斯大學FlemmingBesenbacher和美國威斯康辛大學ManosMavrikakis團隊合作在Science報道,利用掃描隧道顯微鏡等多種表征手段揭示了水加速質(zhì)子傳遞是通過H3O+過渡態(tài)進行,這種機理不同于以往觀察到的金紅石TiO2(110)表面水解離機制。作者在Pt(111)上構(gòu)建氧封端的FeO(111)單層膜,研究了FeO(111)表面的質(zhì)子跳躍過程。由于FeO(111)和Pt(111)之間的晶格不匹配,會呈現(xiàn)出莫爾超晶格結(jié)構(gòu)。對裸露FeO層的原子分辨STM,程序升溫脫附(TPD)和紅外反射吸收光譜(IRAS)等研究表明,水分子在FeO表面微弱吸附,在與多層水接近的溫度下解吸,解吸溫度比在TiO2(110)和MgO(100)上低80~100K。其中,與暴露的金屬陽離子的相互作用決定了水的吸附行為。在較厚的Fe3O4(111)薄膜上,作者發(fā)現(xiàn),Fe3O4表面的活性Fe位點會導致水的分解吸附。因此,FeO膜上的Fe原子必須與吸附的H2O分子非常弱地相互作用,才可以在沒有水解離的情況下研究OH-H2O相互作用。在生物可再生原料轉(zhuǎn)化為高價值化學品以及石化產(chǎn)品生產(chǎn)領(lǐng)域,醇氧化催化是一類重要的反應過程。傳統(tǒng)工藝普遍采用相對昂貴的無機氧化劑和有毒有害的有機溶劑。為了進一步降低成本,并實現(xiàn)綠色可持續(xù)的環(huán)保生產(chǎn),以水為溶劑,以氧氣為原料,以Au作為催化劑的醇氧化工藝問世。研究表明,用水做溶劑,可以形成獨特的H2O/Au界面,提高催化性能。那么,為什么呢?2010年10月,美國弗吉尼亞大學RobertJ. Davis課題組在Science報道,在高pH條件下,醇氧化主要反應路徑包括溶液介導和金屬催化兩大基本步驟,O2在醇氧化過程中并不是通過解離成原子氧直接參與反應,而是通過過氧化物活性中間體的催化分解來再生氫氧根離子。同位素標記實驗結(jié)合密度泛函理論計算表明,OH在反應體系中至關(guān)重要,如果不添加堿,Au對醇氧化幾乎沒有活性。在Au(111)上,H2O還原O2能壘較低,為16 kJ mol-1,形成的過氧化物隨后可以在Au上解離以形成原子O和氫氧化物,能壘為83kJmol -1。同時,OOH *會被還原成H2O2*,其能壘僅為48kJ mol -1。而H2O2*在Au上分解成氫氧化物的能壘為71kJmol -1,在Pt和Pd上分解的能壘分別僅為29和5 kJ mol -1。這也是為什么在Au/C催化劑上進行甘油氧化時,形成的產(chǎn)物中過氧化物濃度偏高,而Pd/C在相同的反應條件下反應時,僅檢測到極少量的過氧化物。也就是說,在這種獨特的H2O/Au界面進行的醇氧化過程中,分子氧并不進入到最終的酸產(chǎn)物中。甲烷(CH4)是天然氣的主要成分,由于其穩(wěn)固的C-H鍵(104 kcal/mol),很難轉(zhuǎn)化為增值化學品(如芳烴、烯烴、含氧化合物)。工業(yè)上,CH4首先在高溫和高壓條件下轉(zhuǎn)化為合成氣(CO與H2),隨后在銅催化劑的作用下制備甲醇。在自然界中,酶使用諸如水,氧氣和二氧化碳(CO2)之類的含氧分子在環(huán)境溫度下將CH4直接轉(zhuǎn)化為甲醇(CH3OH)。將這種仿生策略應用于多相催化劑常常受到高溫需求的限制,這會導致選擇性較差,但是一些氧化物和金屬氧化物表面可在室溫下可以分解CH4,這為直接進行CH4→CH3OH的轉(zhuǎn)化提供了可能性。但大多數(shù)催化劑參與反應時CH4起始發(fā)生C-H鍵的斷裂為決速步驟,后續(xù)的氧化過程往往進展迅速、難以控制。事實上,Ni/CeO2(111)催化劑可以在CH4、O2和H2O的混合物中直接合成CH3OH,然而該工藝的選擇性較低(<40%)。Cu2O/Cu(111)和CeO2/Cu2O/Cu(111)催化劑對水的解離具有較高的活性,CeO2/Cu2O/Cu(111)的反催化劑在有水存在時,催化CH4生成CH3OH的選擇性接近70%,然而產(chǎn)生如此高選擇性的原因是什么呢?2020年5月1日,美國布魯克海文國家實驗室的Ping Liu,José A. Rodriguez, Sanjaya D. Senanayake等人,將環(huán)境壓力X射線光電子能譜(AP-XPS)與密度泛函理論(DFT)計算和動力學蒙特卡羅(KMC)模擬相結(jié)合,得到了在CeO2/Cu2O/Cu(111)催化劑上,當CH4、O2和H2O暴露在催化劑上時,水促進界面途徑是該反應的關(guān)鍵步驟。H2O的加入阻斷了金屬=O介導的機制,阻止了CH4的完全解離形成CO或CO2,開辟了一條之前未被探索的*OH介導的途徑,從而使活化CH4能夠在CeO2-Cu2O/Cu(111)界面上直接生成CH3OH。當向反應進料中添加H2O時出現(xiàn)*CH3O和*CHx,在簡單的CH4/O2反應混合物中沒有發(fā)現(xiàn)這種物質(zhì)。在400和450 K溫度下,CH3O被吸附,這是在暴露于CH4/O2/H2O混合物的CeO2/Cu2O/Cu(111)表面上催化CH4→CH3OH轉(zhuǎn)化的開始。在高溫下,單獨的CH4可以引起二氧化鈰覆蓋層的部分還原,但是在CH4/O2/H2O混合物下,二氧化鈰被完全氧化。雖然CeO2/Cu2O/Cu(111)對于CH4的解離具有特殊的性質(zhì),但其中一些位點的活性過高,使得*CH3O不可避免地被分解。來自水解離的OH基團對于阻斷這些高活性的位點是必不可少的,而且這些OH基團還可以參與CH4活化和轉(zhuǎn)化的其他反應路徑。總的來說,在CeO2/Cu2O/Cu(111)上,H2O發(fā)揮三個關(guān)鍵作用:1)位阻劑:H2O優(yōu)先占據(jù)了CeO2-Cu2O界面上的活性Ce部位,阻礙了O2的活化,從而阻礙了CH4向CO或CO2的轉(zhuǎn)化。2)活性中心:界面Ce處的易解離產(chǎn)生了活性*OH,可促進CH4→CH3OH的直接轉(zhuǎn)化。H2O作為實際的O提供者參與了反應。3)萃取劑:防止*CH3O脫氫并因此防止CO2形成,同時促進氫化并因此促進CH3OH的形成并將其置換到氣相。所以,當實驗不太順利的時候,不妨加點水,或者試試水,說不定一篇Science就此誕生了。再次聲明,我說的水,就是水,是個名詞,不是形容詞。1.JohnnySaavedra, Lars C. Grabow, Bert D. Chandler et al. The critical role ofwater atthe gold-titania interface in catalytic CO oxidation. Science, 2014,345,1599-1602http://science.sciencemag.org/content/345/6204/15992.LindsayR. Merte, Manos Mavrikakis, Flemming Besenbacher et al. Water-MediatedProtonHopping on an Iron Oxide Surface. Science 2012, 336, 889-893.http://science.sciencemag.org/content/336/6083/8893.BhushanN. Zope, Robert J. Davis et al. Reactivity of the gold/water interfaceduring selectiveoxidation catalysis . Science 2010, 330, 74-78.http://science.sciencemag.org/content/330/6000/74.full4.Zongyuan Liu et al. Water-promotedinterfacial pathways in methane oxidation to methanol on a CeO2-Cu2O catalyst.Science, 2020.http://doi.org/10.1126/science.aba5005