新的一期為大家帶來的是微/納米馬達,微軟機器人在體內進行遞送和治療疾病的2020年來發表在頂刊上的最新論文!
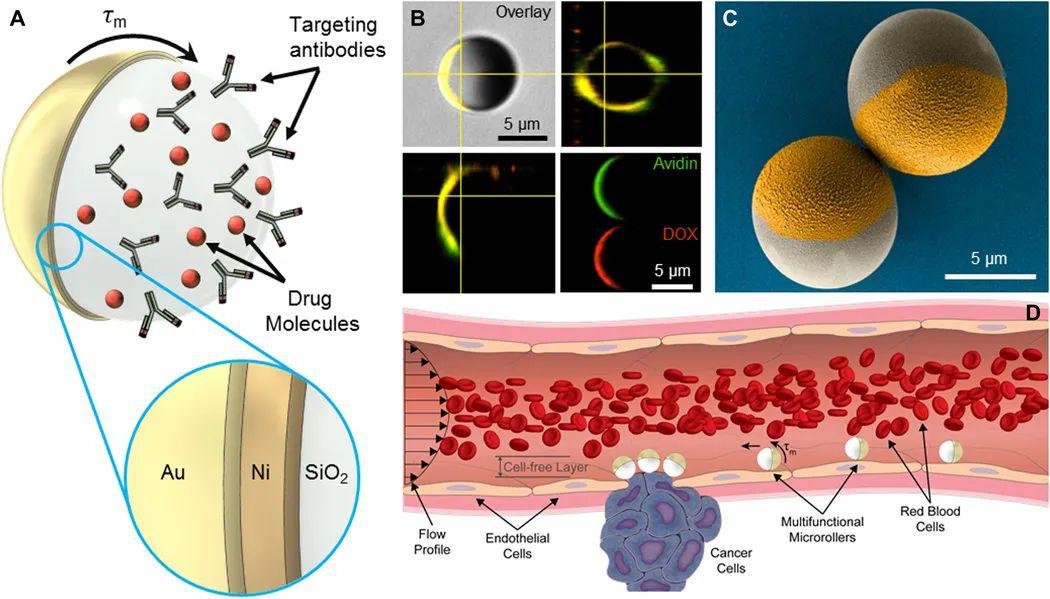
1. Science Robotics:多功能表面microrollers,用于在生理血流中靶向輸送貨物
移動微型機器人為在人體內難以接近的區域以最小侵入性為目標的醫療治療方法提供了廣闊的前景。循環系統代表了理想的航行路線;但是,血流會削弱微型機器人的推進力,特別是對于整體尺寸小于10微米的微型機器人。此外,細胞和組織特異性靶向是有效識別疾病部位和在動態流動條件下長期保存微型機器人所必需的。于此,馬克斯 · 普朗克智能系統研究所MetinSitti等人報道了受循環系統中白細胞啟發的直徑約3.0微米和?7.8微米的細胞大小的多功能表面microrollers,用于將藥物靶向遞送至特定細胞并控制血流內的導航。
本文要點:
1)受白細胞啟發的球形microrollers由磁響應的Janus微粒組成,該微粒具有靶向癌細胞(抗HER2)的靶向抗體功能和光可裂解的癌癥藥物分子(阿霉素)。
2)microrollers的磁性推進和操縱導致平移運動速度高達每秒600微米,每秒約76體長。通過在細胞單層上microrollers的主動推進和操縱,證明了在異種細胞群中能靶向癌細胞。
3)多功能microrollers被用于抵抗在平面微通道和內皮化微通道上的生理相關的血流(每平方厘米高達2.5達因)。此外,microrollers產生足夠的上游推進,以在生理相關的血流中在傾斜的三維表面上運動。
此處描述的多功能microrollers平臺為循環系統中的體內控制推進、導航和目標主動貨物輸送提供了一種生物啟發的方法。
AlapanY, et al. Multifunctional surface microrollers for targeted cargo delivery inphysiological blood flow. Science Robotics. 2020;5(42):eaba5726.
https://robotics.sciencemag.org/content/5/42/eaba5726
2. AM:具有精確磁集體控制的仿生軟微機器人用于微血管溶栓
用于生物醫學應用的新時代軟微機器人需要模擬自然界生物的基本結構和集體功能。生物相容性界面、智能功能和精確的運動控制是設計適應復雜生物環境的軟微機器人的關鍵參數。在此,同濟大學何斌、成昱、王啟剛等人以趨磁細菌(MTB)為靈感,研制了一種運動響應快、定位準確的仿生磁性微機器人(BMM),用于靶向溶栓。
2)模擬結果表明,組裝的程度和速度與場強成正比。BMM最大速度可達161.7μm s?1,在旋轉磁場下實現精確定位控制,偏差小于4%。
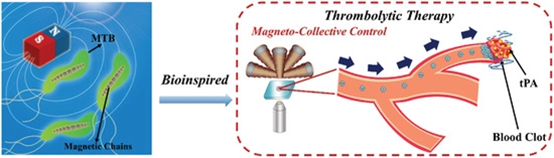
Meihua Xie, et al. BioinspiredSoft Microrobots with Precise Magneto‐CollectiveControl for Microvascular Thrombolysis, Adv. Mater., 2020.
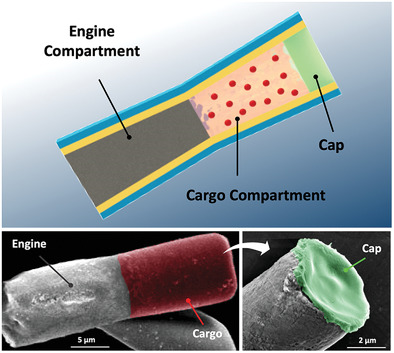
3. AM: 多室管狀微馬達,以增強局部主動傳遞
具有空間分辨隔室的管狀微電機被提供用于有效的特定地點貨物輸送,其具有后端鋅(Zn)推進劑發動機段和預先裝載貨物的明膠段,其進一步由pH響應帽保護。多室微電機顯示出強大的胃動力推進力,其壽命可調,具體取決于Zn段長度。這種推進通過推動和撞擊前端貨物段到胃壁上來顯著增強馬達在胃組織中的分布和保留。一旦微馬達穿透胃粘膜(pH≥6),其pH響應帽溶解,促進了自主局部貨物的釋放。加州大學圣地亞哥分校Joseph Wang和張良方等人系統地測試和討論了制造過程,物理化學性質和推進行為。
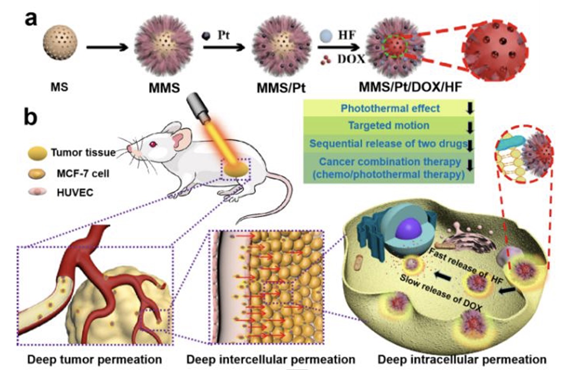
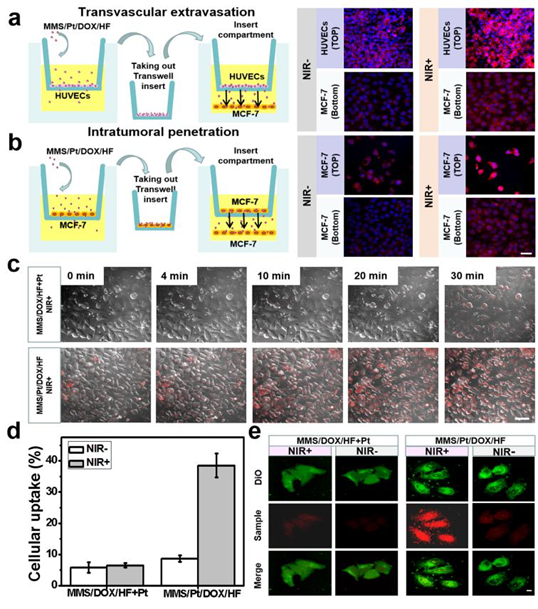
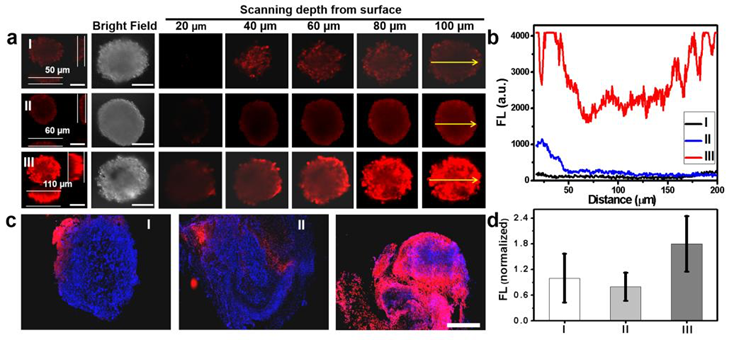
4. Angew:多功能納米馬達用于癌癥聯合治療的研究
治療藥物有限的腫瘤滲透性是當前癌癥治療方法面臨的巨大挑戰,開發可在人體中移動的納米馬達一直是許多研究人員的方向,許多科學家為此做出了不懈的努力。另一方面,不同類型的納米馬達與細胞、腫瘤之間的相互作用也非常重要。再者,當前大多數載藥的納米馬達只有單個孔狀結構,缺乏攜帶不同功能藥物的能力,這也是限制其應用的重要因素。
https://doi.org/10.1002/anie.202002452
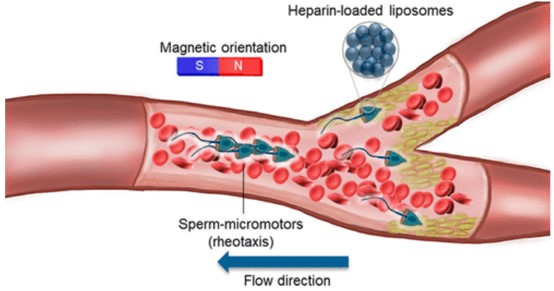
5. ACS Nano:用于流動血液運送貨物的精子微馬達
在復雜的生物環境中,微馬達被認為是無約束微操作和有針對性的物質運輸的有前途的候選者。然而,它們在循環系統中的可行性受到限制,因為許多報道的合成微馬達顯示出低推力,不足以克服高流量和復雜的血液成分。有鑒于此,德國萊布尼茲納米科學研究所的HaifengXu、Mariana Medina-Sánchez等研究人員,提出了一種混合精子微馬達,它能主動逆著流動的血液(連續的和脈動的)游動,并執行肝素物質輸送的功能。
6. Small:病毒樣納米顆粒在小鼠卵巢腫瘤模型中的主動遞送促進抗腫瘤活性
病毒樣納米顆粒(VLPs)因其獨特的固有免疫刺激特性,已成為腫瘤免疫治療的一種有吸引力的手段。然而,對于卵巢癌等腹膜轉移性腫瘤,由于治療的腹膜腔大,排泄快,需要多次注射治療。在此,美國加利福尼亞大學圣迭戈分校Nicole F. Steinmetz、JosephWang等人報道了利用生物相容性Qβ VLPs負載Mg基微馬達的活性VLP載體治療腹膜卵巢腫瘤的的研究進展。
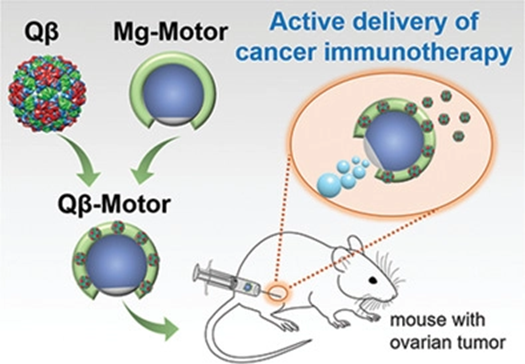
Chao Wang, et al. ActiveDelivery of VLPs Promotes Anti‐TumorActivity in a Mouse Ovarian Tumor Model, Small, 2020.