
顧臻,博士,美國加州大學洛杉磯分校(UCLA)生物工程系教授、NIH生物技術/生物醫(yī)學與工程培訓項目主任。
顧臻團隊致力于將生物材料設計,生物大分子工程以及微/納米工程整合到新的藥物輸送策略中,且應用刺激響應系統(tǒng)以劑量、空間和時間控制的方式來輸送和或釋放治療劑。
以下是課題組研究的主要方向:
生物響應性材料/制劑
癌癥免疫療法
細胞療法
智能胰島素輸送
生物啟發(fā)和仿生設計
團隊目前的研究重點是利用生理學進行生物響應性藥物的遞送。
以下為顧臻教授課題組近期部分研究進展,包括納米醫(yī)藥和微針貼片,供大家學習和交流!
納米醫(yī)藥
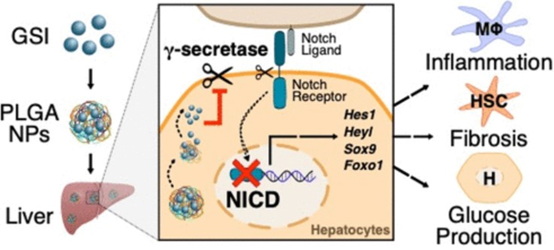
1. ACS Nano:靶向給藥Notch抑制劑可減輕肥胖引起的葡萄糖耐受不良和肝纖維化

隨著肥胖型2型糖尿病(T2DM)和非酒精性脂肪性肝炎(NASH)發(fā)病率的持續(xù)增加,對藥物治療的需求變得迫切。然而,為這些慢性疾病尋找和開發(fā)新的治療策略的努力與安全性的需要相平衡,阻礙了臨床翻譯。這兩種疾病的共同病理之一是肝臟中Notch信號通路的不適應性重新激活。γ-分泌酶抑制劑的缺口拮抗可有效抑制NASH的肝糖生成,減輕肝纖維化,但其肝外副作用,尤其是杯狀細胞化生,限制了其治療效果。
有鑒于此,美國加利福尼亞大學的顧臻和美國哥倫比亞大學的LiQiang、Utpal B. Pajvani等研究人員,開發(fā)了一種納米顆粒介導的遞送系統(tǒng)來靶向肝臟γ分泌酶抑制劑(GSI NPs)。
2. Science Advances:通過DNA介導的生物反應編輯遞送CRISPR-Cas12a用于調(diào)節(jié)膽固醇
CRISPR系統(tǒng)已成為功能強大的生物技術工具,在基礎研究和藥物學中發(fā)現(xiàn)了多種應用。然而,有效遞送系統(tǒng)的可用性嚴重阻礙了CRISPR系統(tǒng)的治療性轉(zhuǎn)化。除廣泛研究的CRISPR-Cas9外,CRISPR-Cas12a還是一種有效的基因組編輯工具。然而,為CRISPR-Cas12a開發(fā)有效的非病毒遞送系統(tǒng)仍然具有挑戰(zhàn)性。
成果簡介:
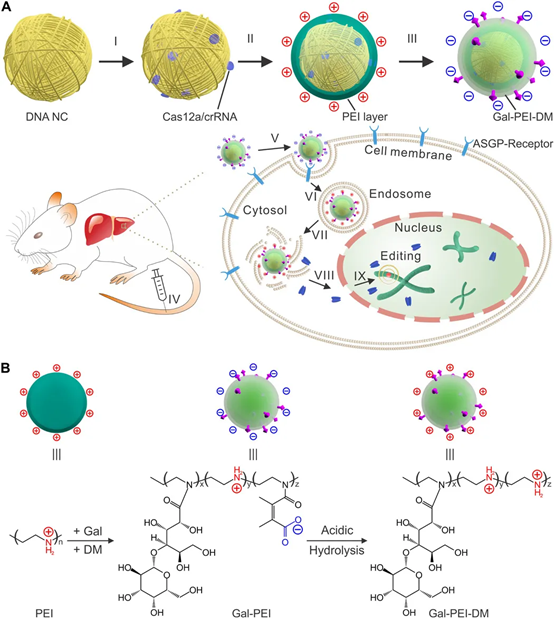
于此,加州大學洛杉磯分校顧臻教授、Wujin Sun等人展示了一種基于DNA納米分子(NC)的載體,可用于傳遞Cas12a/CRISPR RNA(crRNA)核糖核蛋白(RNP)來調(diào)節(jié)血清中的膽固醇水平。
具體設計:
DNA-NC可通過DNA-NC與crRNA的互補作用,有效地負載Cas12a/crRNA-RNP。陽離子聚合物層的加入使DNA模板核濃縮,并允許進一步涂覆電荷反轉(zhuǎn)聚合物層,這使得該組裝在生理pH下帶負電,但在酸性環(huán)境下恢復為正電荷。
實驗結(jié)果:
當選擇Pcsk9作為靶基因時,由于其在調(diào)節(jié)血清膽固醇水平方面的重要作用,體內(nèi)可觀察到有效的Pcsk9破壞(~48%),顯著降低Pcsk9的表達,獲得膽固醇控制的治療效果(約有45%的膽固醇降低)。
綜上所述,這種載體提供了一種平臺策略,可以通過應用適當?shù)陌邢蚺潴w而適于靶向其他器官。crRNA還可以被重新編程以靶向其它感興趣的基因,用于治療不同的疾病,并且CRISPR-Cas12a的高度多樣性可以方便地同時靶向多個基因。
WujinSun, et al. CRISPR-Cas12a delivery by DNA-mediated bioresponsiveeditingfor cholesterol regulation. Sci. Adv. 2020
DOI:10.1126/sciadv.aba2983
https://advances.sciencemag.org/content/6/21/eaba2983
微針貼片
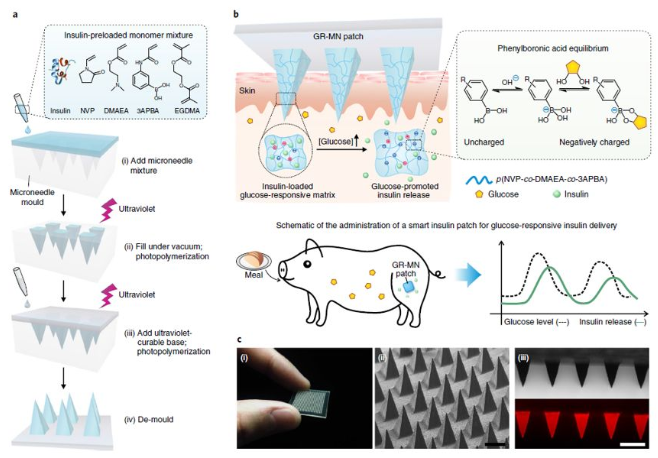
3. Nature BME:胰島素貼片2.0 | 一天貼一次,全球4億糖尿病患者的福音(深度解讀)

UCLA顧臻教授團隊于近日開發(fā)出新一代的經(jīng)皮智能胰島素貼片——“智能胰島素貼片2.0”。該胰島素貼片只有硬幣大小(5 cm2),易于工業(yè)生產(chǎn)制造,可實現(xiàn)臨床相關劑量的和快速葡萄糖依賴性的胰島素釋放,調(diào)節(jié)葡萄糖釋放時間可超過20h。
具體設計:
在這種葡萄糖反應微針(GR-MN)貼片中,整個微針聚合物基質(zhì)是以苯硼酸(PBA)作為葡萄糖響應成分。重要的是,研究人員將胰島素、單體和交聯(lián)劑(EGDMA)的混合物通過非常方便的原位光聚合方法形成聚合基質(zhì),以獲得足夠的胰島素載量供臨床使用。
PBA能與葡萄糖可逆地相互作用生成環(huán)硼酸酯。即:當暴露在高血糖條件下時,聚合物基質(zhì)中的負電荷增加,并導致微針溶脹,然后將胰島素快速擴散到皮膚組織中。而在正常血糖條件下,基質(zhì)不再溶脹和靜電相互作用的恢復,可減緩胰島素釋放速率,降低了低血糖的風險。
據(jù)了解,該技術已被FDA的新興技術計劃接受,且研究人員正在為人類臨床試驗申請FDA批準,預計可以在幾年內(nèi)開始實施。

個人簡介

顧臻,博士,美國加州大學洛杉磯分校(UCLA)生物工程系教授、NIH生物技術/生物醫(yī)學與工程培訓項目主任。本科、碩士畢業(yè)于南京大學化學系及高分子科學與工程系;2010年于UCLA獲得工學博士學位;同年博士后受聘于麻省理工學院化工系/Koch癌癥綜合研究院、哈佛大學醫(yī)學院,師從Robert Langer教授。2018年前,任教于北卡羅萊納大學教堂山分校/北卡州立大學聯(lián)合生物醫(yī)學工程系,獲評Jackson Family杰出講席教授(Distinguished Professor)。其指導的“iMedication-智能醫(yī)藥實驗室”研究方向包括蛋白質(zhì)遞藥系統(tǒng)、生理響應材料、免疫治療制劑、細胞治療策略等。目前已發(fā)表學術論文180余篇,申請專利80余項(授權公司30余項)。
顧臻教授曾獲“斯隆研究獎”、國際藥物控釋學會(CRS)“青年學者獎”、美國糖尿病學會(ADA)“青年教授獎”及“Pathway”研究獎、美國生物醫(yī)學工程學會(BMES)“細胞/分子生物工程創(chuàng)新者獎”等。2017年獲美國國務院頒發(fā)的亞太經(jīng)合組織(APEC)創(chuàng)新、研究與教育科學獎(ASPIRE)評選美國區(qū)亞軍。《麻省理工科技評論》曾將其評為“TR35全球杰出創(chuàng)新者”。2019年當選美國醫(yī)學與生物工程院(AIMBE)Fellow。其團隊首次報道了“智能胰島素貼片”(Smart Insulin Patch)的原型并推動其臨床轉(zhuǎn)化,相關研究圖片曾入選《科學》雜志年度十大科技圖片。目前擔任《Nano Research》副主編及《Advanced Biosystems》、《Advanced Therapeutics》、《化學進展》、《Medicinein Drug Discovery》等雜志的編委,并任CRS仿生遞藥專委會主任。
課題組網(wǎng)站:https://imedicationlab.net/











