納米尺度的依賴于距離的物理過程極大地促進了對生命系統的基本理解,并促進了新分子藥物的開發,以改善患者護理。熒光共振能量轉移(FRET)是一種物理過程,它對研究引起分子鄰近性變化的生物現象非常敏感。然而,FRET受單一熒光團信號強度低且波動大以及由于光漂白導致觀察時間短的困擾。納米等離子體技術利用貴金屬之間的距離變化來產生表面等離子體共振吸收波長偏移和隨后的顏色變化。這些技術可以克服有機熒光團的局限性,為生物活性的繪制提供一個快速方便的平臺。然而,與FRET一起,這些光學技術的廣泛應用可能會因其固有的低組織穿透性和與體內復雜生物環境的不理想的光子相互作用而受到阻礙。
Cheon及其同事報道了基于磁性的納米級距離相關磁共振調諧(magnetic resonance tuning,MRET)的開創性工作(Nature Materials,DOI: 10.1038/nmat4846)。由于磁共振成像(MRI)可以提供高分辨率的功能和解剖學成像而不受組織穿透深度的限制,因此MRET為生物過程的非侵入性研究開辟了新的可能性。
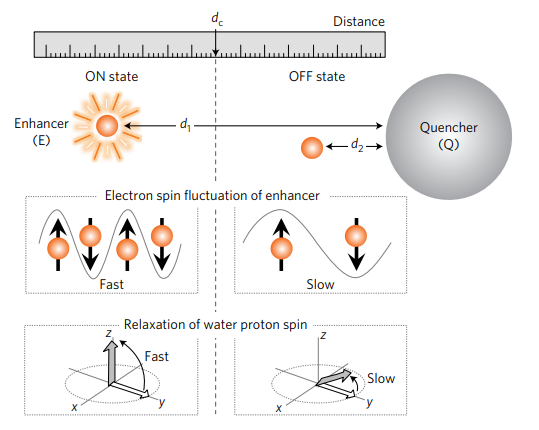
圖自Nature Materials
在MRET中,通過控制順磁性T1增強劑和超順磁性淬滅劑之間的距離來調節T1弛豫。然而,T1造影劑在磁共振成像中的應用可能會受到低靈敏度和固有的低磁共振(MR)松弛性的影響。第一批MRET探針是在腫瘤內使用的;然而,這些探針的大小、穩定性和表面性質需要進一步優化,以便通過全身注射(這些探針暴露在血流中)的廣闊體內應用。此外,由于體內固有的1H信號的干擾,1H MRI通常會受到來自正常組織的低對比度增強和高背景噪聲的影響。
成果簡介:
有鑒于此,加州大學戴維斯分校李源培教授等人介紹一種具有雙向可激活T1和T2信號的新型雙向磁共振調諧(two-waymagnetic resonance tuning,TMRET)納米技術。該方法的目的是在抑制MRET背景信號的同時,大大提高MR的對比度和可靠性。相關成果于5月25日發表在Nature Nanotechnology上。

整體思路:(畫重點)
TMRET納米技術是通過將雙向MRET對(即:脫鎂葉綠素a–順磁性Mn2+螯合物(P–Mn)(T1造影劑)和超順磁性氧化鐵(SPIO)納米顆粒(T2造影劑))同時封裝到具有結構依賴性穩定性和刺激響應性的膠束中(如下圖所示)。
首先鎖住信號:當雙向MRET對被“鎖定”在膠束核內時,T1和T2的MRI信號被“關閉”。然后鑰匙打開:與生物刺激物(“鑰匙”)相互作用時,T1和T2 MRI信號會根據Mn2+和SPIO之間的距離增加而雙重“打開”,這取決于膠束的完整性。
此外,為了更好地實現雙T1和T2磁共振信號的變化,提出了一種互補的后成像處理和重建方法-“雙對比度增強減影成像”(dual-contrast enhancedsubtraction imaging,DESI)。
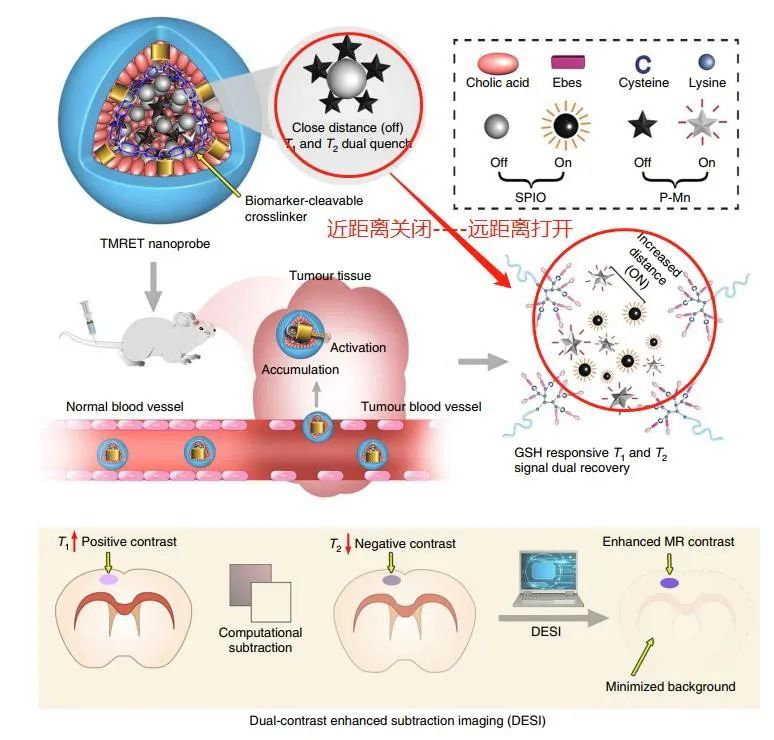
示意圖
淬滅機理
研究人員研究了TMRET納米探針中T1和T2淬滅的機理。關于T1造影劑的強磁化作用,r1的淬滅作用已有大量報道。然而,對T2淬滅作用的了解很少。本文提出了兩種可能的機制:首先,包封后的二硫交聯膠束(DCM@P–Mn–SPIO)中的水所經歷的偶極子場可以近似為SPIO和P–Mn的場之和。其次,據報道將分子附著在SPIO的表面上會減少粒子的凈矩。眾所周知,Mn和Fe具有負交換相互作用,從而在其二元合金中產生非共線反鐵磁構型。在這種情況下,P–Mn中的Mn2+可能與SPIO相互作用,從而降低了SPIO的凈力矩。
這兩種機制協同作用以抑制DCM@P–Mn–SPIO的偶極子場并淬滅r1和r2。T1造影劑通過快速自旋波動幫助松弛周圍水中的質子,而當SPIO和P-Mn被封裝時,r2主要受到水質子與SPIO或TMRET納米探針之間的偶極-偶極相互作用的影響。在關閉狀態下,來自納米探針的偶極場很小,這使其無法有效降低水質子的橫向磁化強度,并導致更長的T2。
同時,T1造影劑由于來自T2造影劑(SPIO)的磁場而具有緩慢的自旋波動,因此在松弛水質子方面也無效。在on狀態下,Mn從SPIO中分離出來,重新獲得快速的自旋漲落,降低了T1,SPIO恢復了其磁矩,從而有助于松弛周圍的水質子。這導致彌散后T1和T2成像增強。
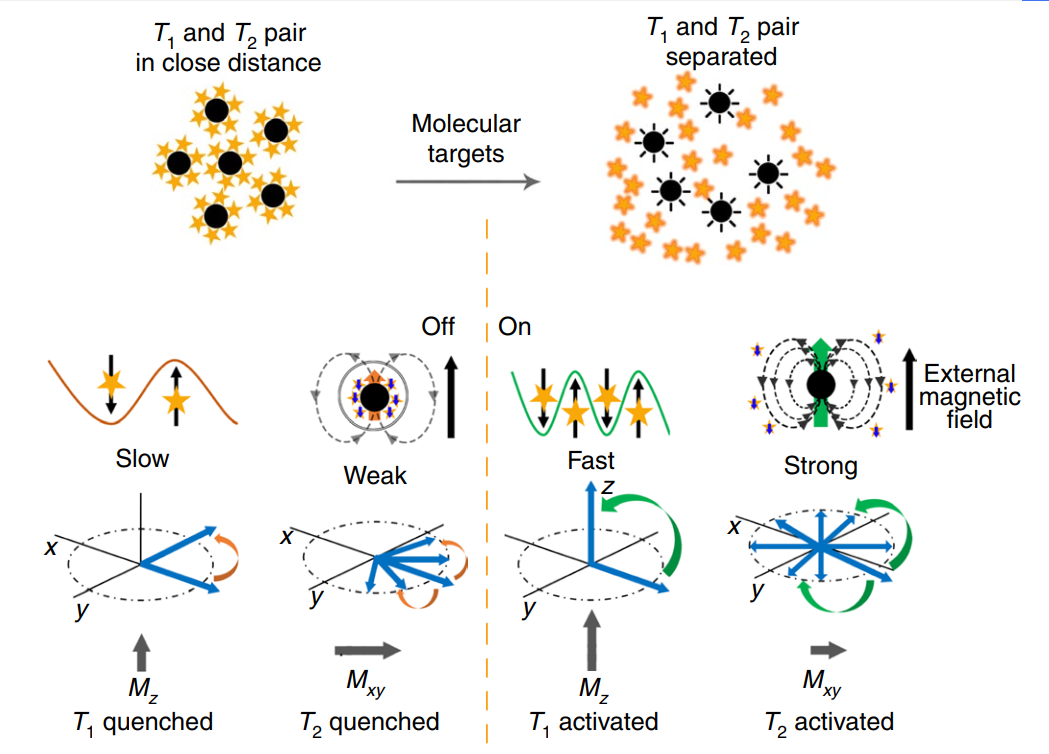
圖|機理示意圖
體內外成像
然后研究人員針對GSH響應型TMRET納米探針進行物理化學、體內體外實驗,實驗結果表明,TMRET探針具有良好的生物相容性,GSH響應性,且MRI信號增強可以被腫瘤部位的刺激激活。后期圖像處理時,還開發了一種新的DESI技術作為后成像處理和重建方法。
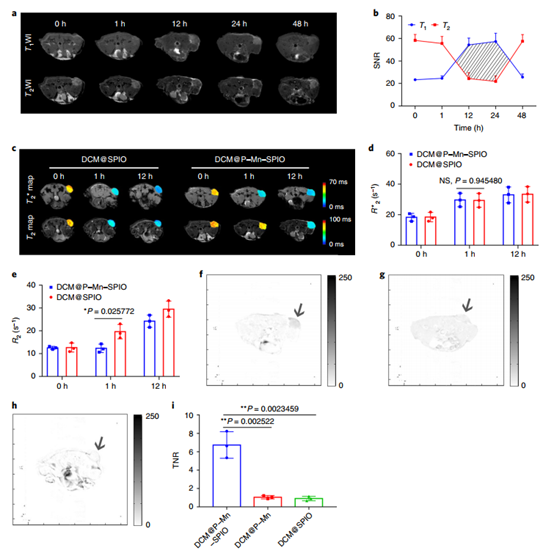
圖|體內腫瘤MRI
DESI技術顯著提高TNR和超微小腫瘤檢測
高腫瘤/正常組織信號比(TNR)對通過成像方法成功檢測早期癌癥至關重要。TMRET納米探針在血液循環中沉默,但在腫瘤內可見。互補的DESI技術進一步抑制了背景信號并增強了腫瘤對比度。該集成了TMRET納米技術和DESI的成像平臺有望實現迄今為止最高的TNR,因此特別適合于早期癌癥檢測。
使用DESI,DCM@P–Mn–SPIO的TNR達到11.6,而DCM@P–Mn和DCM@SPIO的TNR分別為1.25和1.09,這表明配備DESI的TMRET可以顯著增強TNR。且實現超微小腫瘤病灶的檢測(0.7 mm3)。
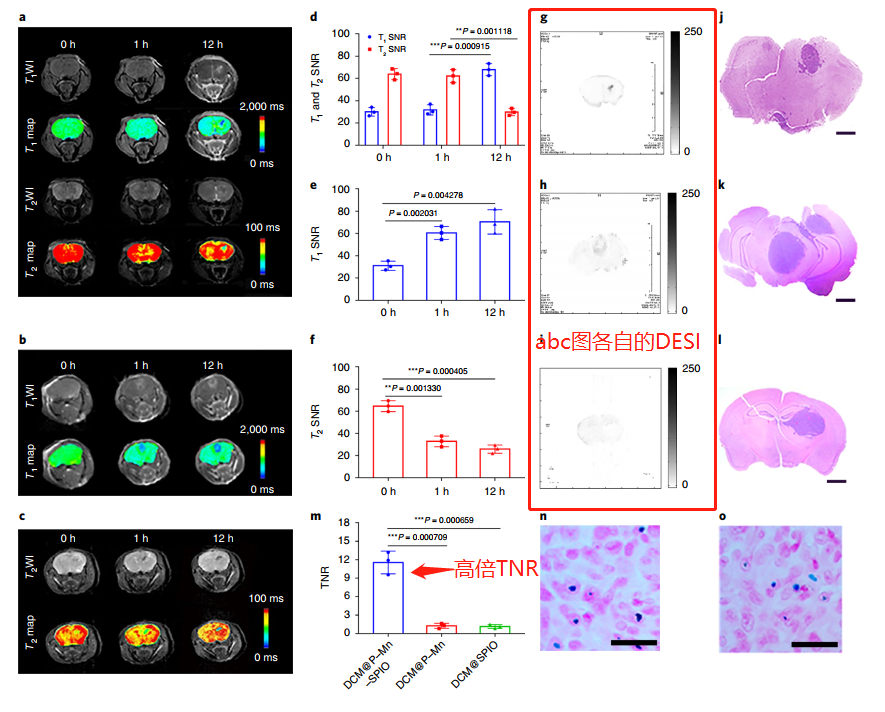
圖|TMRET探針與DESI技術在原位腦腫瘤中的應用
應用范圍廣
為了拓寬TMRET技術的應用范圍,研究人員還分別在3.0 T和9.4 T MRI掃描儀上測量了TMRET探針,支持了TMRET系統的穩定性,可廣泛應用于不同磁場的MRI掃描儀。這增加了TMRET納米技術轉化為臨床應用的潛力。
為了測試TMRET技術是否適用于不同的納米載體和分子靶,開發了兩種新的探針,即:利用DSPE-PEG2000(常規磷脂)和PEG5000-OH8-PPBA(酸敏膠束),均可以實現T1和T2雙向淬滅和恢復,說明TMRET可被用于其他膠束類型。
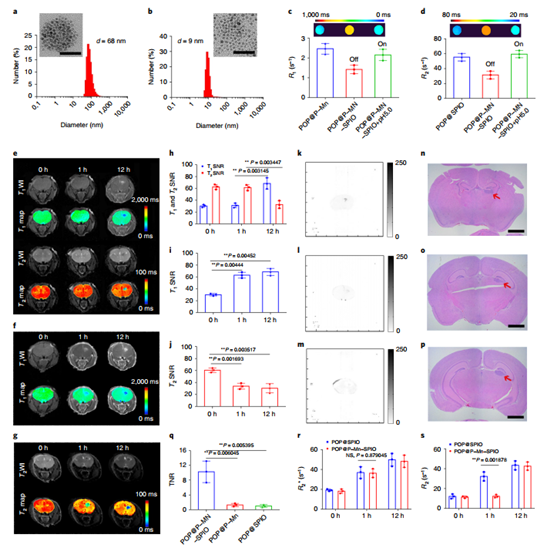
圖|其他膠束體系的應用
小結:
設計了一個獨特的TMRET平臺,采用定制的DESI技術,使得MRI比傳統的癌癥診斷技術更加靈敏和更具選擇性。這是由于以下優點:(1)腫瘤的優先累積賦予了磁共振成像高腫瘤選擇性,(2)內在腫瘤刺激的激活增加了TNR,(3)雙模態、基于減影、高靈敏度MRI對早期小病灶的診斷及(4)超高TNR可突出腫瘤邊緣,提高MRI引導手術的準確性。相信該新成像平臺對癌癥和其他疾病的診斷具有巨大的臨床潛力。
參考文獻:
Wang,Z., et al. Two-way magnetic resonance tuning and enhanced subtraction imagingfor non-invasive and quantitative biological imaging. Nat. Nanotechnol. (2020).
https://doi.org/10.1038/s41565-020-0678-5











