轉(zhuǎn)眼間,就到了2020年的6月了,一年已將近一半,這期給大家?guī)淼捻斂厔菔顷P(guān)于材料與血液相互作用的精選論文,更具體來講,就是材料用于溶解血栓,或是利用血栓來扼殺腫瘤,下面為具體的內(nèi)容:
(由于往期比較多了,所以本期文末就不放入口鏈接啦,部分往期內(nèi)容可點擊上方專輯查看)
一、化害為利,利用血栓扼死腫瘤
1. Science Advances:基于自組裝肽的生物模擬血小板引發(fā)人工凝血
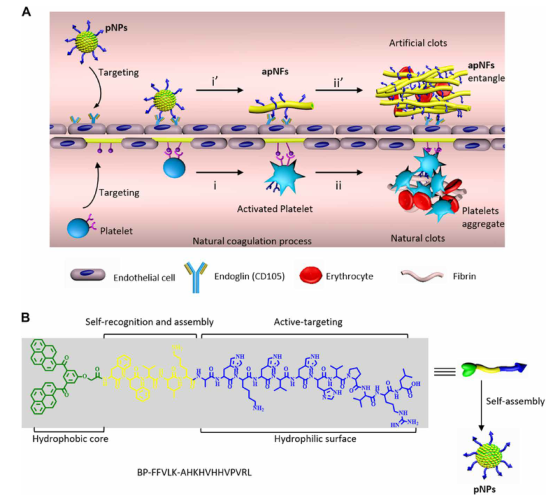
血小板在凝血調(diào)節(jié)中起著至關(guān)重要的作用,凝血是生命中必不可少的過程之一,引起了人們的極大關(guān)注。然而,由于凝血過程的復雜性,模擬血小板用于體內(nèi)人工凝血仍然是一個巨大的挑戰(zhàn)。在此,國家納米科學中心王浩、王磊等人設(shè)計了基于自組裝肽的血小板樣納米顆粒(pNPs),這些肽可以在血管中引發(fā)凝血并形成凝塊。
本文要點:
1)pNPs首先與腫瘤部位血管生成內(nèi)皮細胞過度表達的膜糖蛋白(即CD105)特異性結(jié)合,同時通過配體-受體相互作用轉(zhuǎn)化為活化的血小板樣納米纖維(apNFs)。
2)接下來,apNFs暴露更多的結(jié)合位點,招募并激活更多的pNPs,在體模和動物模型中形成人工凝塊。
3)pNPs在小鼠身上被證明是安全的,沒有全身凝血。
這種自組裝肽可以模擬血小板,在體內(nèi)實現(xiàn)人工凝血,從而為腫瘤的治療提供了一種很有前途的策略。
Pei-Pei Yang, et al. A biomimetic platelet based on assembling peptides initiates artificial coagulation, Sci. Adv., 2020.
DOI: 10.1126/sciadv.aaz4107
http://advances.sciencemag.org/content/6/22/eaaz4107
2. ACS Nano:肽基納米顆粒在腫瘤血管內(nèi)特異性模擬層粘連蛋白纖維形成抑制腫瘤生長
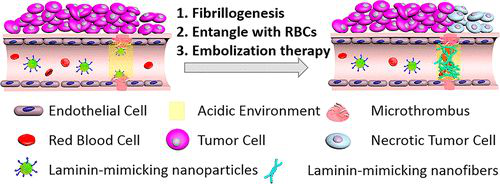
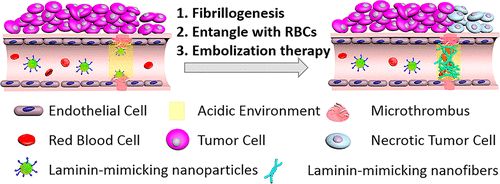
基于血管生成的腫瘤治療策略受到基礎(chǔ)研究和臨床研究的高度重視。通過阻斷腫瘤內(nèi)的血管來阻斷腫瘤細胞的氧氣和營養(yǎng)供應可以抑制腫瘤的生長。在此,國家納米科學中心王浩、王磊,北京科技大學曹暉等人報道了一種基于雙響應肽的納米顆粒,它能在腫瘤血管中特異地高效地模擬層粘連蛋白纖維生成,從而導致腫瘤血管的阻塞和腫瘤的生長抑制。
本文要點:
1)層粘連蛋白模擬肽(LMMP)具有纖顫序列、pH響應序列和靶向序列。
2)納米制劑中的LMMP被輸送到腫瘤中的血管,腫瘤血管微環(huán)境(pH和微血栓)使LMMP能夠進一步層粘連蛋白纖維生成,構(gòu)建纖維網(wǎng)絡。層粘連蛋白樣纖維網(wǎng)絡捕獲紅細胞等,特異性地在腫瘤血管形成阻塞,從而抑制腫瘤的生長。
Kuo Zhang, et al. Peptide-Based Nanoparticles Mimic Fibrillogenesis of Laminin in Tumor Vessels for Precise Embolization, ACS Nano, 2020.
DOI: 10.1021/acsnano.0c02110
https://doi.org/10.1021/acsnano.0c02110
3. ACS Nano:模擬生物趨向性靶向血管破壞腫瘤,用于缺氧敏感治療
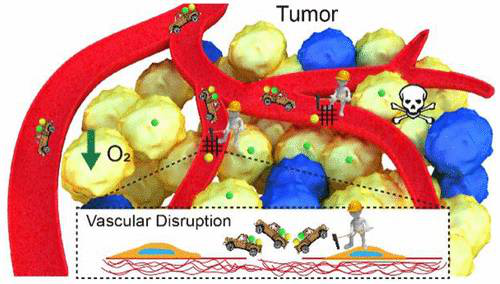
腫瘤血管系統(tǒng)在維持腫瘤生長中起關(guān)鍵作用。血管破裂伴隨著內(nèi)部凝血,血小板的聚集和由此產(chǎn)生的氧供應的抑制。在此,武漢大學張先正和馮俊等人人為地創(chuàng)建了這一生理過程,以建立血管中斷和模擬血小板的生物趨化之間的相互反饋,用于缺氧依賴治療的級聯(lián)擴增。
本文要點:
1)為了證明這一概念,將介孔二氧化硅納米顆粒與缺氧激活的前藥(HAP)和血管破壞劑共負載,然后涂覆血小板膜。一旦進入腫瘤,此納米療法可以破壞局部血管從而抑制腫瘤。這種血小板膜包覆的納米平臺與親代血小板共享出血傾向性功能,并且可以被血管破裂的腫瘤持續(xù)聚集。
2)通過這種方式,腫瘤內(nèi)血管破裂和腫瘤靶向在生物學上是相互依賴和相互加強的。依靠這種相互反饋,腫瘤缺氧被極大地促進了20倍以上,說明了HAP的細胞毒性得到了有效恢復。
因此,此受生物啟發(fā)的納米設(shè)計通過腫瘤內(nèi)血管破裂、模擬血小板的生物趨化、級聯(lián)低氧擴增和低氧敏感化療之間的生物驅(qū)動合作,表現(xiàn)出高度特異性和有效的抗腫瘤效力。這項研究提供了將治療設(shè)計與生理事件相關(guān)聯(lián)以實現(xiàn)更好的治療效果的范例。

Mingkang Zhang, Jing-Jie Ye, Yu Xia, et al. Platelet-Mimicking Biotaxis Targeting Vasculature-Disrupted Tumors for Cascade Amplification of Hypoxia-Sensitive Therapy. ACS Nano, 2019.
https://doi.org/10.1021/acsnano.9b07330
二、潤物無聲,保護卒后損傷
4. JACS:一種克服體內(nèi)缺血性卒中損傷的金屬協(xié)同抗氧化策略
氧化應激是缺血性腦卒中的標志之一。基于過氧化氫酶(CAT)的生物模擬復合物有望作為缺血性腦卒中的神經(jīng)保護劑,通過降低H2O2的損傷效應而成為具有較大前景的治療候選藥物。不幸的是,這些分子會產(chǎn)生有害的羥基自由基HO·。在此,北京大學張俊龍、德克薩斯大學奧斯汀分校Jonathan L. Sessler、北京大學第一醫(yī)院康磊等人報告了一系列基于Salen的三錳(Mn(III))金屬配合物(1-3),它們具有模擬過氧化氫酶的功能。
本文要點:
1)這些籠狀分子包含一個獨特的“活性位點”,三個Mn中心非常接近,這種排列設(shè)計能促進金屬的協(xié)同作用,以最小限度地產(chǎn)生HO·,從而有效地歧化H2O2。
2)事實上,與單體Mn(Salen)配合物1c相比,1-3的產(chǎn)氧量顯著增加。
3)對最有前景的體系1進行了更詳細的研究,發(fā)現(xiàn)在體外和體內(nèi)都比單體控制系統(tǒng)1c具有更大的治療效益,這從涉及缺血性腦卒中損傷的大鼠模型和支持組織學分析的研究中可見一斑。
綜上所述,金屬配合物 1及其類似物代表了一種治療氧化應激相關(guān)疾病的新的、有前景的策略。

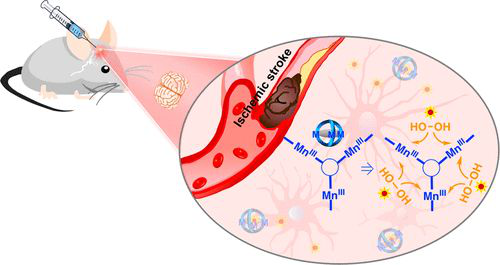
Yingying Ning, et al. Tri-Manganese(III) Salen-Based Cryptands: A Metal Cooperative Antioxidant Strategy that Overcomes Ischemic Stroke Damage In Vivo. J. Am. Chem. Soc., 2020.
DOI: 10.1021/jacs.0c03805
https://doi.org/10.1021/jacs.0c03805
5. ACS Nano:順序特異性遞送溶栓劑和神經(jīng)保護劑用于強化治療缺血性中風
由血栓阻塞和缺血引起的缺血性中風是一種容易致殘甚至致命的腦血管疾病之一。而開發(fā)一個可以將溶栓劑和神經(jīng)保護劑分別送到血栓和缺血半暗帶位置的順序靶向給藥系統(tǒng)則有望實現(xiàn)很好的聯(lián)合效果。受血小板在血栓形成中的重要作用的啟發(fā),加州大學顧臻教授和南京醫(yī)科大學辛洪亮等人開發(fā)了一種生物工程納米血小板(tP-NP-rtPA/ZL006e),用于對重組組織纖溶酶原激活劑(rtPA)和神經(jīng)保護劑(ZL006e)進行順序特異性遞送。
本文要點:
1)tP-NP-rtPA/ZL006e可經(jīng)血小板膜介導的靶向作用到達血栓部位,進而上調(diào)凝血酶并觸發(fā)rtPA的釋放。隨后,原位暴露的Tat肽可以使得納米血小板穿過血腦屏障進入缺血大腦,實現(xiàn)了對ZL006e的位點特異性遞送。
2)體內(nèi)外實驗表明,tP-NP-rtPA / ZL006e在大鼠大腦中動脈閉塞模型中具有很好的抗中風療效,可顯著降低63%的缺血區(qū)和72%的活性氧水平。
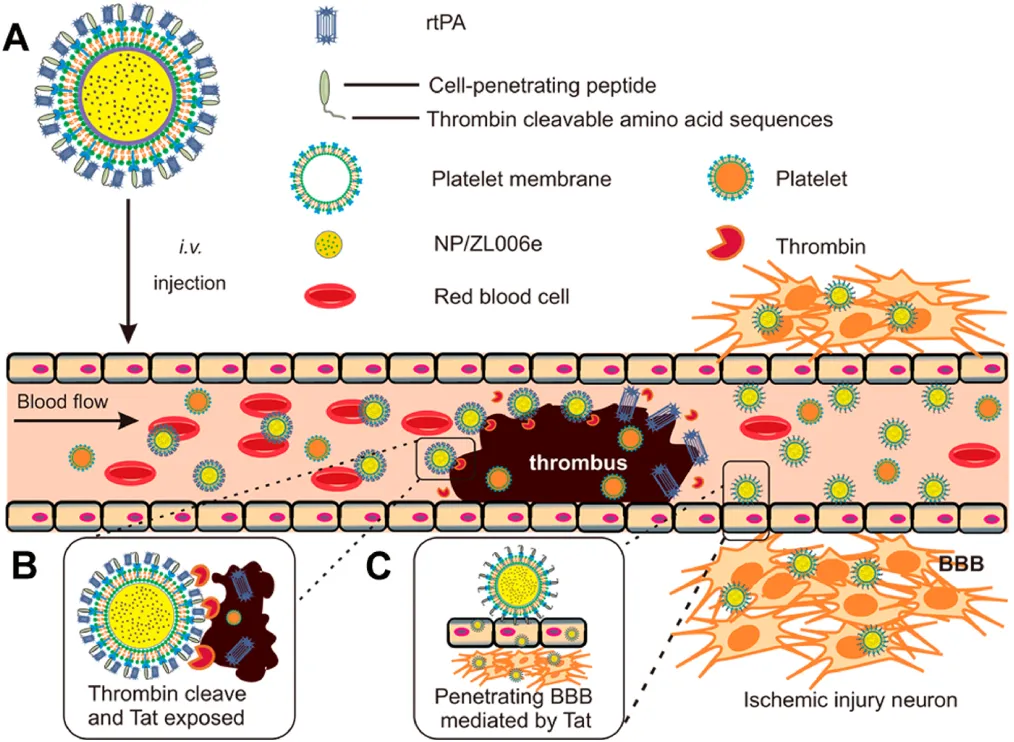
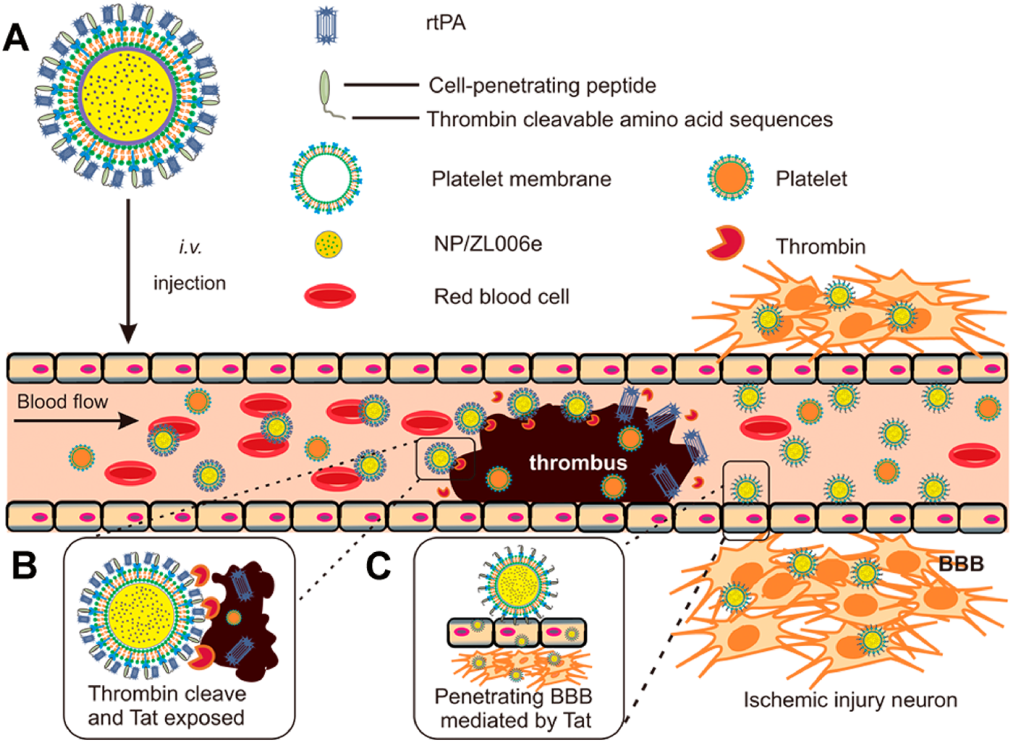
Jianpei Xu, Zhen Gu, Hongliang Xin. et al. Sequentially Site-Specific Delivery of Thrombolytics and Neuroprotectant for Enhanced Treatment of Ischemic Stroke. ACS Nano. 2019
DOI: 10.1021/acsnano.9b01798
https://pubs.acs.org/doi/10.1021/acsnano.9b01798
6. Nano Lett:納米海綿通過自由基清除和自適應氧調(diào)節(jié)治療缺血性腦卒中
急性腦卒中溶栓前的缺氧或溶栓后的氧增強導致高水平的自由基,導致神經(jīng)細胞的連續(xù)損傷。為了治療缺血性中風,需要清除自由基,并相繼調(diào)節(jié)缺氧和助氧微環(huán)境。于此,鄭州大學張振中教授、張開翔副教授和Liu Junjie等人報道了一種工程化的納米海綿(Mn3O4@nanorecomes-T7,MNET),它可以通過自我調(diào)節(jié)氧氣和清除自由基來重塑中風患者的微環(huán)境。
由于紅細胞的隱形作用以及在T7肽的輔助下在梗塞部位的優(yōu)先蓄積,血液循環(huán)時間長MNET在缺血性中風的兩個階段發(fā)揮了獨特的治療作用:(i)溶栓前,通過快速清除自由基和及時供氧來挽救神經(jīng)細胞;(ii)溶栓后,通過儲氧抑制氧增加,清除自由基,避免再灌注損傷。MNET通過對病理微環(huán)境的階段性調(diào)節(jié),在缺血性腦卒中治療中具有誘人的應用前景。
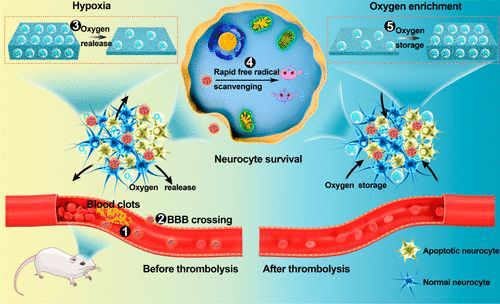
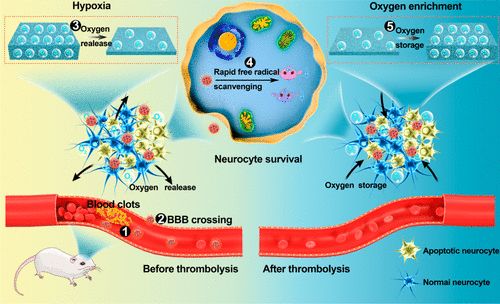
Jinjin Shi, Wenyan Yu, Lihua Xu, Na Yin, Wei Liu, Kaixiang Zhang, Junjie Liu, and Zhenzhong Zhang. Bioinspired Nanosponge for Salvaging Ischemic Stroke via Free Radical Scavenging and Self-Adapted Oxygen Regulating. Nano Letters 2019.
DOI: 10.1021/acs.nanolett.9b04974
https://doi.org/10.1021/acs.nanolett.9b04974
二、害而除之,新型血栓治療
7. Science Advances:血小板衍生的多孔納米馬達用于血栓治療
靜脈血栓形成,包括深靜脈血栓形成和肺栓塞,在世界范圍內(nèi)發(fā)病率很高,每年的發(fā)病率約為每密耳1-3例,這可能危及生命。目前,靜脈血栓形成的治療主要包括兩個階段。在早期階段,使用溶栓藥來重新血管化,在后期階段,使用抗凝藥來防止血栓形成的再生。靜脈血栓形成的治療困難包括藥物的半衰期短,利用率低以及在血栓部位的滲透性差。于此,南京鼓樓醫(yī)院史冬泉、南京師范大學毛春、Mimi Wan等人開發(fā)了一種具有血小板膜(PM)修飾的介孔/大孔二氧化硅/鉑納米馬達(MMNM/PM),用于依次靶向血栓溶解和抗凝藥物的治療。
本文要點:
1)由PM上的特殊蛋白質(zhì)調(diào)節(jié),納米馬達靶向血栓部位,然后PM可以在近紅外(NIR)照射下破裂以實現(xiàn)所需的順序藥物釋放,包括快速釋放溶栓性尿激酶(3小時)和緩慢釋放抗凝劑肝素(> 20天)。
2)同時,納米電機在近紅外輻射下的運動能力可以有效地促進它們在血栓部位的深層滲透,從而提高保留率。
3)體外和體內(nèi)評價結(jié)果證實,在靜態(tài)/動態(tài)血栓和大鼠模型中,來自PM的靶向能力和來自納米馬達的運動能力的協(xié)同作用可以顯著增強溶栓作用。
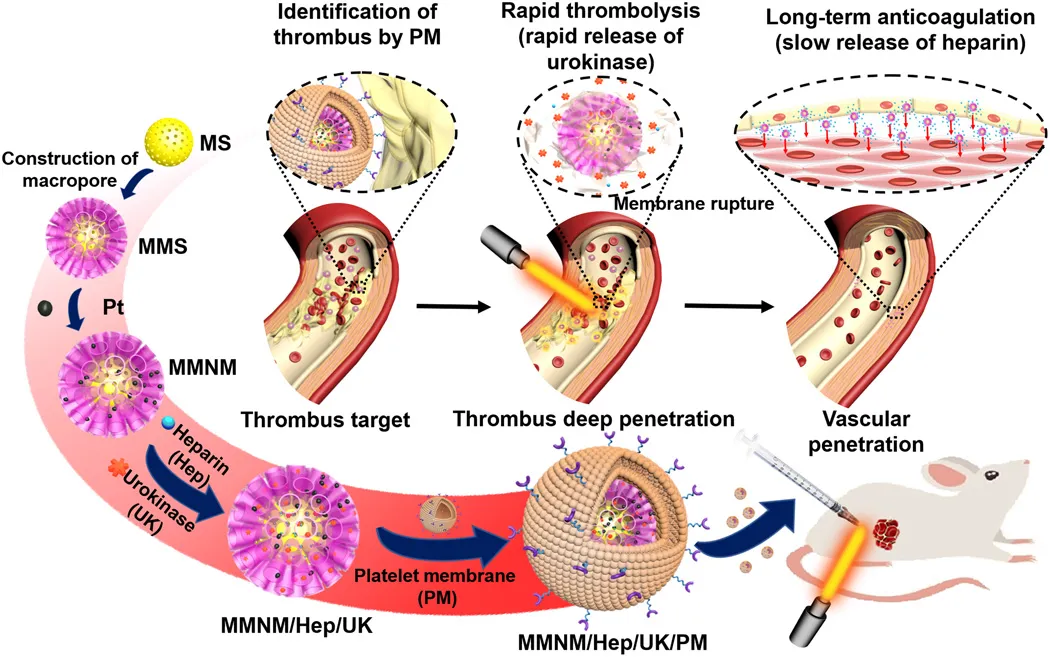
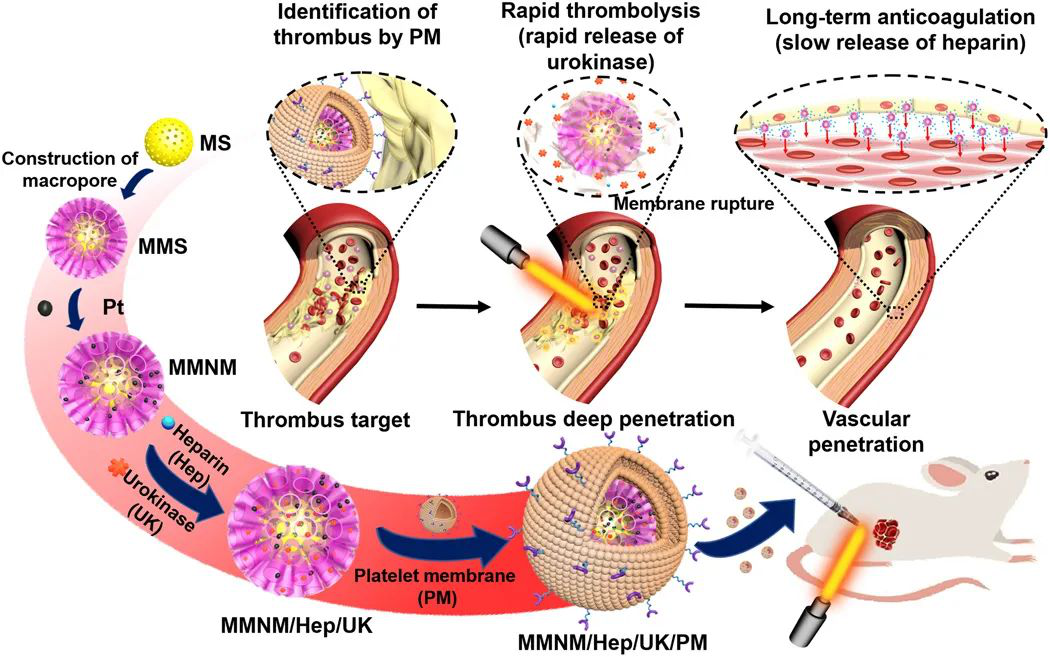
Wan M, et al. Platelet-derived porous nanomotor for thrombus therapy. Science Advances. 2020;6(22):eaaz9014.
DOI: 10.1126/sciadv.aaz9014
https://doi.org/10.1126/sciadv.aaz9014
8. AM:納米血小板逆轉(zhuǎn)血栓
在涉及血栓形成的疾病中,血液供應的快速切斷是全世界發(fā)病率和死亡率的主要原因。然而,由于目前的溶栓策略的半衰期短、靶向性低和意外的出血并發(fā)癥,該療法提供的結(jié)果非常有限。受血小板在止血和病理性血栓中固有作用的啟發(fā),國家納米中心聶廣軍研究員、李素萍研究員、Zhang Yinlong等人開發(fā)了血小板膜偽裝的聚合物納米顆粒(納米血小板),用于將溶栓藥物--重組組織纖溶酶原激活劑(rt-PA)靶向遞送至局部血栓部位。
本文要點:
1)量身定制的納米血小板可以有效地積聚在肺栓塞和腸系膜動脈血栓形成模型小鼠的血栓中,與游離rt-PA相比,其溶栓活性顯著增強。
2)此外,在缺血性中風模型中,納米血小板的治療效果優(yōu)于游離rt-PA。體內(nèi)凝血指標的分析表明,納米血小板具有較低的出血并發(fā)癥的風險。所開發(fā)的復合仿生納米血小板為在血栓形成疾病中提高溶栓治療的療效和降低出血風險提供了一種有希望的解決方案。
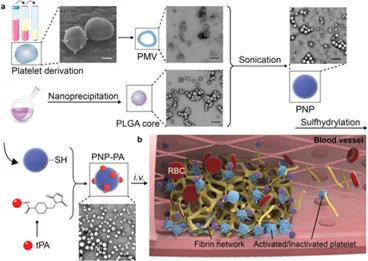
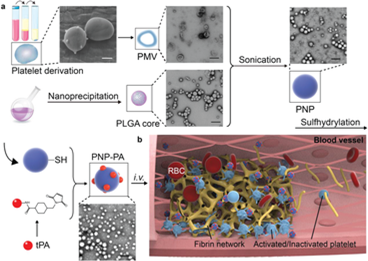
Xu, J., Zhang, Y., Li, S., Nie, G. et al, Engineered Nanoplatelets for Targeted Delivery of Plasminogen Activators to Reverse Thrombus in Multiple Mouse Thrombosis Models. Adv. Mater. 2019, 1905145.
https://doi.org/10.1002/adma.201905145
四、防而避之,血管支架必備條件
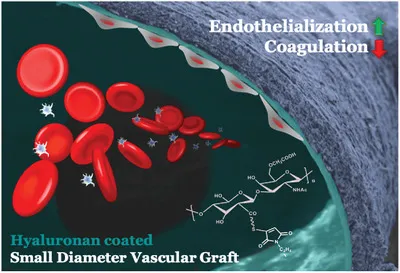
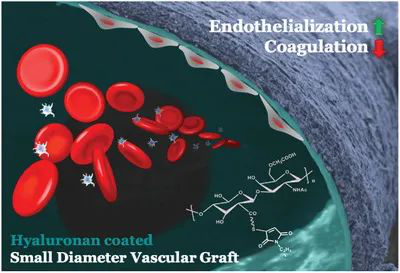
9. AFM:類似細胞被的水凝膠涂層用于小直徑血管移植物
新型的生物血管導管,例如脫細胞的組織工程化的血管移植物(TEVG),受到高血栓形成的阻礙。為了模擬內(nèi)皮細胞(ECs)上存在連續(xù)糖胺聚糖層的天然血管的抗血栓形成表面,美國耶魯大學Laura E. Niklason等人建立了透明質(zhì)酸(HA)修飾的表面,以有效地保護血小板免受膠原蛋白觸發(fā)的激活。
本文要點:
1)利用直徑為4毫米的脫細胞TEVG上存在的胺基,可通過雙官能硫醇反應性交聯(lián)劑構(gòu)建連續(xù)的HA水凝膠涂層,從而避免了非特異性膠原基質(zhì)的交聯(lián)。透明質(zhì)酸水凝膠層重建管腔壁,“隱藏”暴露在血液中的膠原蛋白。
2)體外血液測試表明,HA涂層的脫細胞TEVGs上粘附的血小板、纖維蛋白原吸收和血纖蛋白形成明顯低于未涂層的脫細胞TEVGs。HA表面在體外也抑制巨噬細胞粘附。
3)分別在大鼠和犬模型中使用HA涂層的脫細胞同源大鼠主動脈(直徑約1.5毫米)和TEVGs,可防止血栓形成,并保持正常的血流。除此之外,實驗還觀察到再內(nèi)皮化。HA涂層的TEVGs可能是即用型小直徑血管移植物,且具有雙重優(yōu)勢:抗血栓形成保護和促進內(nèi)皮細胞。
Dimitrievska, S., et al., Glycocalyx‐Like Hydrogel Coatings for Small Diameter Vascular Grafts. Adv. Funct. Mater. 2020, 1908963.
DOI: 10.1002/adfm.201908963
https://doi.org/10.1002/adfm.201908963
10. 血管支架批準上市 | 葛均波院士十年磨一劍終成果
據(jù)國家藥監(jiān)局官網(wǎng)和復旦大學中山醫(yī)院消息,由中國科學院院士葛均波教授領(lǐng)銜團隊與山東華安生物技術(shù)有限公司合作,歷經(jīng)十余年研發(fā)、科研攻關(guān)及臨床研究隨訪,研制出具有我國自主知識產(chǎn)權(quán)的生物可吸收冠脈雷帕霉素洗脫支架——XINSORB支架,于3月5日通過國家藥品監(jiān)督管理局審批上市。這也是我國最早開始自主研發(fā)的生物可吸收支架。
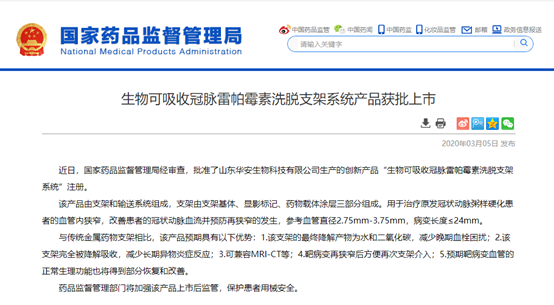
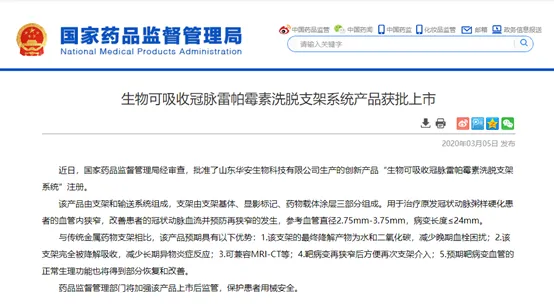
據(jù)悉,葛均波教授團隊自2005年就開始了生物可吸收支架的研發(fā)。2005年,研發(fā)團隊獲得了關(guān)鍵性專利:生物可降解載藥物高分子材料支架的制備方法。到了2013年,完成全國首例可吸收支架臨床試驗。接受XINSORB生物可吸收支架治療的第一例患者至今已完成5年隨訪。5年來,該患者未發(fā)生任何不良事件,多次復查造影均顯示原支架植入部位通暢,支架已幾乎完全吸收。
在XINSORB支架上市前,葛均波院士也已帶領(lǐng)團隊開始了第二代生物可吸收支架的研發(fā),目前該支架已完成長期動物實驗隨訪。而XINSORB支架上市后,也將繼續(xù)開展上市后臨床研究。
另外,在4月9日,國家藥品監(jiān)督管理局經(jīng)審查,批準了Cook Ireland Limited生產(chǎn)的優(yōu)先產(chǎn)品“藥物洗脫外周血管支架”注冊。
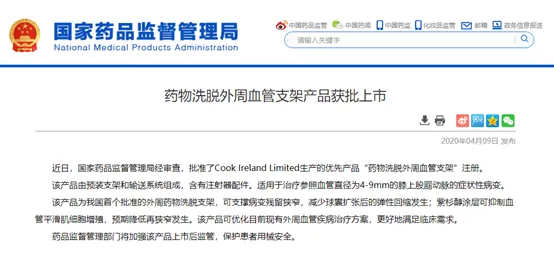
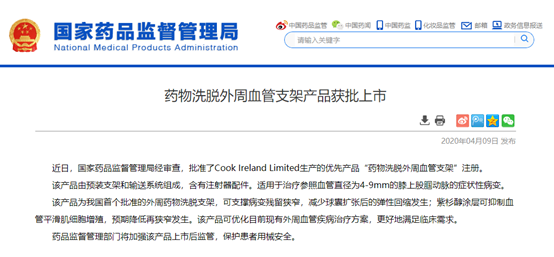
該產(chǎn)品為我國首個批準的外周藥物洗脫支架,可支撐病變殘留狹窄,減少球囊擴張后的彈性回縮發(fā)生;紫杉醇涂層可抑制血管平滑肌細胞增殖,預期降低再狹窄發(fā)生。該產(chǎn)品可優(yōu)化目前現(xiàn)有外周血管疾病治療方案,更好地滿足臨床需求。藥品監(jiān)督管理部門將加強該產(chǎn)品上市后監(jiān)管,保護患者用械安全。























