
Leaf Huang(黃力夫)博士,是北卡羅來納大學教堂山分校的藥物工程學和分子藥物學系杰出教授。長期從事基因治療和靶向藥物遞送領域的工作。他開創了脂質體非病毒載體的先驅,并于1992年設計了第一項臨床試驗的非病毒陽離子脂質載體,并榮獲了代表脂質體研究最高領域的Bangham終身成就獎。他還是22項美國和外國專利的發明人或共同發明人。同時黃教授還是6家生物技術公司的早期創始人。
黃力夫教授畢業于臺灣大學,1969年赴美留學,獲密西根州立大學博士學位。曾在田納西大學,匹茲堡大學任教,2013年獲得美國藥學科學家協會(AAPS)的杰出醫藥科學家獎。他目前的工作集中于在腫瘤和肝臟中進行基因轉移的納米載體,以及建立用于抑制腫瘤生長的cDNA,mRNA,siRNA,蛋白和多肽和治療癌癥和感染性疾病的疫苗的配體靶向遞送系統。
黃力夫教授的近期部分研究成果具體如下:
1. Adv. Drug. Deli. Rev:植物成分的抗癌活性及其針對腫瘤細胞和微環境的脂質體靶向策略

本文要點:
從中草藥(CHMs)中可以提取了多種可影響腫瘤進展和轉移的生物活性成分。為了進一步了解CHM在癌癥治療中的機制,本文總結了五類CHM及其有效成分對腫瘤細胞和腫瘤微環境的影響。
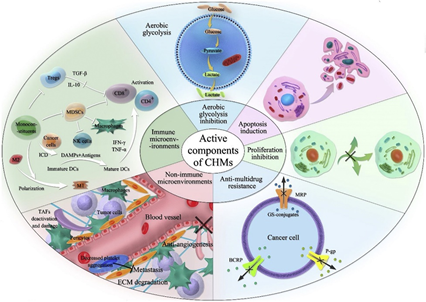
盡管具有治療潛力,但不良的理化性質(差的滲透性,不穩定性,高親水性或疏水性,毒性)和不良的藥代動力學特征(血液半衰期短和生物利用度低)限制了CHM的臨床研究。因此,通過相關的表面修飾技術開發脂質體,以實現針對癌細胞的靶向CHM遞送,即細胞外和細胞內靶標以及腫瘤微環境或脈管系統中的靶標。討論了這些植物成分的脂質體靶向的當前挑戰以及CHM應用的未來前景。
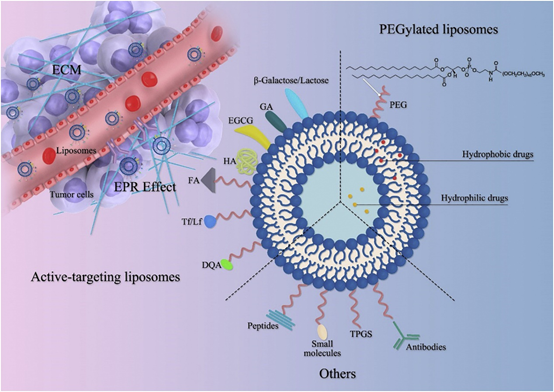
JingZhang, et al. Anticancer activities of phytoconstituents and their liposomaltargeting strategies against tumor cells and the microenvironment. Adv DrugDeliv Rev. 2020 May 28;S0169-409X(20)30039-9.
Doi:10.1016/j.addr.2020.05.006.
https://doi.org/10.1016/j.addr.2020.05.006
2. Adv. Drug. Deli. Rev:膜-殼納米顆粒用于癌癥納米醫學

本文要點:
癌癥是現代最嚴重的疾病負擔之一,據估計全球診斷出的患者人數從2018年的1810萬增加到2030年的2360萬。盡管傳統療法取得了重大進展,但它們仍然存在局限性,并且仍然療效遠非理想。因此,迫切需要安全,有效和廣泛應用的治療方法。在過去的幾十年中,基于膜-殼(MC)納米結構的新型遞送方法的開發用于遞送化學治療劑,核酸和免疫調節劑,已顯著改善了抗癌功效并減少了副作用。在這篇綜述中,描述了基于MC納米結構的抗癌藥物遞送策略,并討論了應用MC納米制劑克服臨床翻譯的遞送障礙的最新進展。
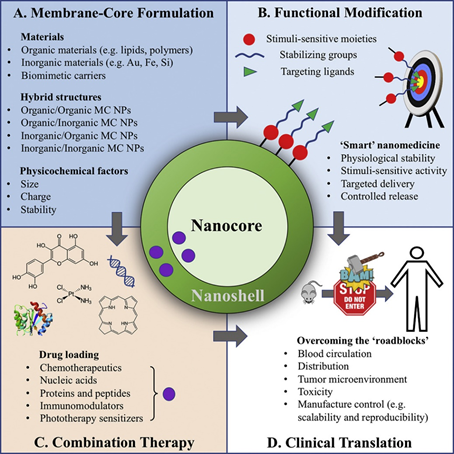
JianfengGuo, et al. Membrane-core Nanoparticles for Cancer Nanomedicine. Adv Drug DelivRev. 2020 May 22;S0169-409X(20)30038-7.
Doi:10.1016/j.addr.2020.05.005.
https://doi.org/10.1016/j.addr.2020.05.005
3. ACS Nano:奧沙利鉑和亞葉酸的納米共遞送實現與5-氟尿嘧啶協同化學免疫治療用于結直腸癌和肝轉移

亞葉酸(FnA),5-氟尿嘧啶(5-Fu; F)和奧沙利鉑(OxP; OX)的組合被稱為FOLFOX,已被用作II / III期以及發生肝轉移時大腸癌(CRC)患者的標準治療方法。盡管存活率得到改善,但是患者仍然遭受諸如功效低,毒性高和療程長的缺點。因此,需要減少劑量和/或周期的情況下提供相同或更好的抗CRC效力的可行而有效的替代方法。基于納米粒子的遞送系統可能會提供FOLFOX替代品。
本文要點:
(1)在這項研究中,合成了活性形式的OxP ([Pt(DACH)(H2O)2]2+),與FnA2–使用納米沉淀技術在油包水反向微乳液中開發了以氨乙基茴香酰胺(AEAA)為靶頭的PEG化脂質納米顆粒(即Nano-Folox)。其中,脂質包括DOPA,DOTAP,膽固醇,DSPE-PEG-AEAA。測得的Pt包封效率(EE)≈99%和負載能力(LC)≈67 wt%。
(2)通過Nano-Folox實現了OxP衍生物和FnA的共遞送。隨后將5-Fu用作游離藥物以促進Nano-Folox的治療功效。結果表明在原位CRC小鼠模型中,所得制劑顯著促進了鉑類藥物和FnA的血液循環和腫瘤蓄積。OxP與其他鉑(Pt)藥物不同,不僅可以提供抗癌細胞毒性作用,而且會誘導免疫原性細胞死亡(ICD)。因此,在原位CRC小鼠中表現出良好的化學免疫治療活性。另外,當與FOLFOX相比時,通過納米Folox和5-Fu的組合獲得了明顯更強的化學-免疫治療應答,而沒有顯示出毒性。此外,抗PD-L1單克隆抗體增強了Nano-Folox / 5-Fu的抗肝轉移能力。
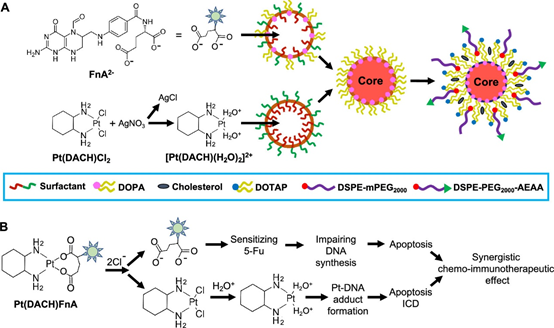
JianfengGuo, et al. Nano Codelivery of Oxaliplatin and Folinic Acid AchievesSynergistic Chemo-Immunotherapy With 5-Fluorouracil for Colorectal Cancer andLiver Metastasis. ACS Nano. 2020 Apr 28;14(4):5075-5089.
Doi:10.1021/acsnano.0c01676.
https://doi.org/10.1021/acsnano.0c01676
4. ACS Nano:淫羊藿素加劇線粒體自噬并與阿霉素協同誘導肝細胞癌的免疫原性細胞死亡

對化學療法和免疫療法均具有抗性的肝細胞癌(HCC)是最致命的惡性腫瘤之一。在肝癌經動脈化療中廣泛使用的阿霉素可以誘導免疫原性細胞死亡(ICD),但產生的免疫原性仍然較弱。本研究旨在基于一種稱淫羊藿素的免疫調節藥物,尋求提高ICD在肝癌中療效的策略。
本文要點:
(1)在這項研究中證明了淫羊藿素誘導線粒體自噬和細胞凋亡,并隨后激活HCC細胞中的ICD生物標志物。并且在兩種藥物的低劑量下,淫羊藿素和阿霉素的摩爾比為1:2的組合在ICD誘導中起協同作用。
(2)利用納米技術在藥物遞送中的優勢,開發了聚乳酸- 共-乙醇酸(PLGA)-聚乙二醇(PEG)-氨基乙基茴香酰胺(AEAA)納米粒子(NP),以同時包裹淫羊藿素和阿霉素。二者的共遞送重塑了免疫抑制腫瘤的微環境,并引發了強大的免疫記憶反應,從而有效改善了抗HCC治療的小鼠HCC模型的早期階段。此外,PLGA-PEG-AEAA 納米粒與樂伐替尼組合顯著延長了HCC晚期小鼠的存活時間。
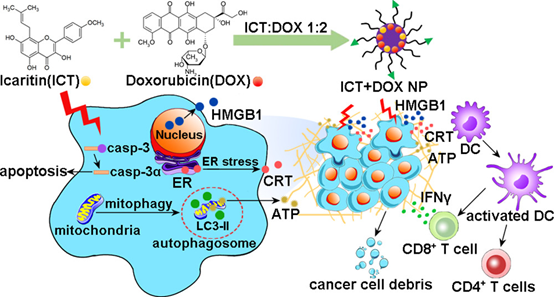
Zhuo Yui,et al. Icaritin Exacerbates Mitophagy and Synergizes With Doxorubicin to InduceImmunogenic Cell Death in Hepatocellular Carcinoma. ACS Nano. 2020 Apr28;14(4):4816-4828.
Doi:10.1021/acsnano.0c00708.
https://doi.org/10.1021/acsnano.0c00708
5. Biomaterials:納米葛根素調節小鼠三陰性乳腺癌模型中的腫瘤微環境并促進化學和免疫療法

腫瘤相關的成纖維細胞(TAF)是介導增生反應的關鍵基質細胞,并負責實體瘤中的耐藥性和免疫抑制性微環境的形成。先前的研究表明,脫靶地遞送遺傳毒性藥物以殺死TAF導致Wnt16的產生,這使得鄰近的腫瘤細胞具有耐藥性。因此,目前的方法正在尋找失活而不是殺死TAF的手段。活性氧(ROS)是多種促纖維化途徑的中心樞紐,對于TAF活化必不可少。
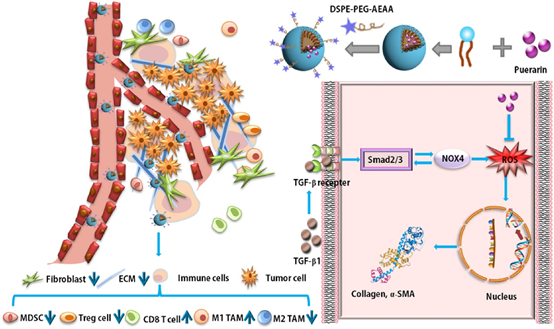
本文要點:
(1)本研究中證實了葛根素在活化的NIH3T3鼠成纖維細胞中顯示出優異的ROS還原效率,可以有效下調活化的成纖維細胞中ROS的產生。然而,葛根素的不良水溶性和生物利用度限制了其作為藥物的應用。因此,開發了一種新型的葛根素納米乳劑(nanoPue),以提高葛根素的溶解度和生物利用度。
(2)NanoPue顯著失活了基質微環境(例如,與PBS對照相比,nanoPue治療的小鼠中的TAF降低了約6倍),并促進了納米紫杉醇在增生性三陰性乳腺癌(TNBC)模型中的化療作用。而且,物理屏障的去除使細胞毒性T細胞的腫瘤內浸潤增加了2倍。此外,nanoPue激活的免疫微環境在TNBC模型中顯著提高了PD-L1單克隆抗體(α-PD-L1)的治療功效。
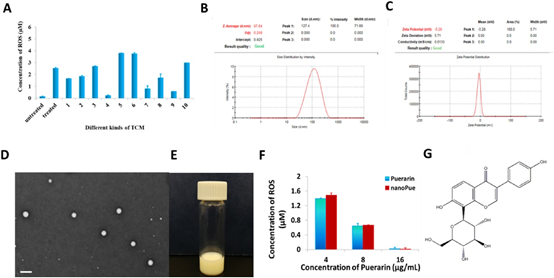
HuanXu, et al. Nano-puerarin Regulates Tumor Microenvironment and FacilitatesChemo- And Immunotherapy in Murine Triple Negative Breast Cancer Model. Biomaterials.2020 Mar; 235:119769.
Doi:10.1016/j.biomaterials.2020.119769.
https://doi.org/10.1016/j.biomaterials.2020.119769
6. ACS Nano:槲皮素和土木香內酯的納米共遞送通過協同免疫原性細胞死亡促進微衛星穩定的結直腸癌的抗腫瘤效應

已知微衛星穩定的結直腸癌(CRC)對免疫療法有抵抗力。在CRC中,DNA錯配修復系統(MMR)有缺陷或微衛星不穩定性(MSI-H)的患者對免疫治療的反應更敏感。不幸的是,只有5–15%的患者表現出MMR缺陷/MSI-H,并且檢查點封鎖免疫療法對于腫瘤被T細胞預浸潤的患者可能非常有效。不幸的是,對于結直腸癌患者,大約95%的患者人群對PD-1 / PD-L1阻斷治療無反應。在這項研究中,我們篩選了更多中藥,擬尋找誘導ICD的藥物。
本文要點:
(1)本研究發現槲皮素(Q)和土木香內酯(A)的組合以1:4的摩爾比誘導協同免疫原性細胞死亡(ICD)。為了實現按比例的包載和遞送,采用長循環膠束納米粒(QA-M)進行Q和A的遞送,具有高的包封效率和最佳比例的藥物報包載。QA-M由DSPE-PEG2000和TPGS制備。QA-M可延長血液循環并增加腫瘤蓄積。更重要的是,在進行協同免疫治療的靜脈注射后2和4小時,QA-M在腫瘤中保留了所需的藥物比率(Q與A的摩爾比= 1:4)。與PBS和游離藥物的組合相比,QA-M的治療對小鼠原位CRC的腫瘤生長有明顯的抑制作用(p<0.005)。
(2)納米療法的組合刺激了宿主的免疫應答,誘導長期腫瘤破壞和記憶腫瘤監視,與PBS和游離藥物的組合相比,存活時間中位數增加1.3倍。共遞送誘導的協同治療作用能夠通過誘導ICD,引起細胞毒性和調節免疫抑制性腫瘤微環境而重新激活抗腫瘤免疫力,并進一步證實了它們在CT26-FL3上觸發ICD和誘導細胞凋亡的協同作用,CT26-FL3是一種微衛星穩定CRC的鼠模型。
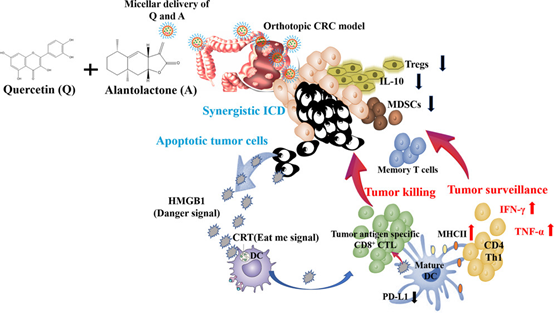
JingZhang, et al. Nanoformulated Codelivery of Quercetin and Alantolactone Promotesan Antitumor Response Through Synergistic Immunogenic Cell Death forMicrosatellite-Stable Colorectal Cancer. ACS Nano. 2019 Nov26;13(11):12511-12524.
Doi:10.1021/acsnano.9b02875.
https://doi.org/10.1021/acsnano.9b02875
7. Nature Communication:松弛素基因遞送減輕肝臟轉移并與檢查點療法協同作用

活化的肝星狀細胞(aHSC)介導的肝纖維化對于肝轉移的發展至關重要。在動物模型和臨床情況中,均已記錄了去除病因后肝纖維化的自發消退。但是,很少研究其潛在的生理機制。
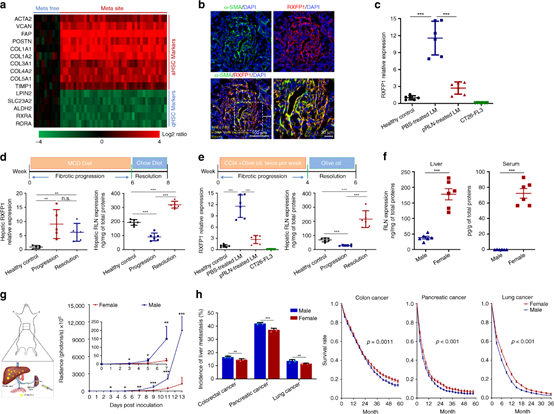
本文要點:
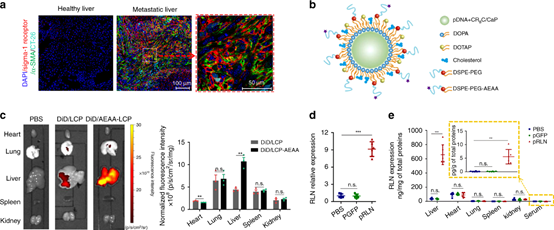
(1)發現肝臟中松弛素(RLN,一種抗纖維化肽)對肝纖維化的反應以及其在aHSCs上的主要受體(RXFP1)的上調。RLN的高表達可作為天然調節劑,使aHSC失活并解決肝纖維化。因此,內源性肝纖維化修復機制可通過增強的RLN表達用于肝轉移治療。利用氨乙基茴香酰胺偶聯的脂質-磷酸鈣納米顆粒來遞送編碼RLN的質粒DNA。納米顆粒優先靶向轉移性病變內的轉移性腫瘤細胞和aHSC,并將其轉化為原位RLN貯庫。
(2)表達的RLN逆轉了基質微環境。在大腸癌,胰腺癌和乳腺癌的肝轉移模型中,確認了RLN基因治療可顯著抑制轉移進程并延長生存期。此外, RLN表達治療后轉移灶內的免疫抑制環境轉變為免疫刺激狀態,具有更好的細胞毒性T細胞浸潤。RLN基因療法與PD-L1阻斷免疫療法的結合進一步產生了協同的抗轉移功效。
MengyingHu, et al. Relaxin Gene Delivery Mitigates Liver Metastasis and Synergizes WithCheck Point Therapy. Nat Commun. 2019 Jul 5;10(1):2993.
Doi:10.1038/s41467-019-10893-8.
https://www.nature.com/articles/s41467-019-10893-8
8. ACS Nano:血管擴張劑肼屈嗪可促進晚期纖維增生性腫瘤中的納米顆粒滲透
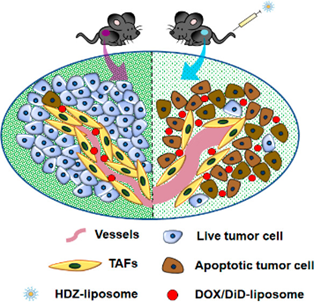
由于致密的基質和腫瘤內部有限的顆粒通透性,纖維增生性腫瘤通常對基于納米顆粒的化學療法具有抗性。在本文中,我們報道了肼苯噠嗪(HDZ)(一種抗高血壓血管擴張劑)將極大地促進納米顆粒在晚期增生性腫瘤中的滲透。
本文要點:
(1)首先,開發了HDZ-脂質體用于腫瘤選擇性遞送HDZ。在以15 mg / kg的劑量注射3次HDZ-脂質體后,在增生性黑色素瘤(BPD6)小鼠模型中,腫瘤基質明顯減少,同時腫瘤缺氧得到改善。此外,HDZ脂質體治療改變了免疫抑制腫瘤的微環境。
(2)使用負載DiD的脂質體作為模型納米顆粒表明,HDZ脂質體治療顯著增加了增生腫瘤內部納米顆粒的積累和滲透。一次HDZ-脂質體預處理后,再單次注射阿霉素-脂質體5 mg / kg即可在大小超過400 mm3腫瘤上產生強大的抑制作用。
Yanzuo Chen,et al. Vasodilator Hydralazine Promotes Nanoparticle Penetration in AdvancedDesmoplastic Tumors. ACS Nano. 2019 Feb 26;13(2):1751-1763.
Doi:10.1021/acsnano.8b07830.
https://doi.org/10.1021/acsnano.8b07830











