張良方,2002年進入美國伊利諾伊大學香檳分校化工系,在Steve Granick教授的指導下攻讀博士學位。2006~2008年加入麻省理工學院化工系,在Robert Langer教授的研究組進行博士后工作。2008年7月,加入加州大學圣地亞哥分校納米工程系任助理教授,于2012年3月晉升為終身副教授,2014年7月晉升為終身正教授。
2009年獲得美國化學會的Victor K. LaMer獎;2013年被《麻省理工學院技術商評》雜志評為“2013年度世界最杰出青年創新專家”;2014年獲美國化學工程師學會的Allan P. Colburn獎;2015年入選美國醫學和生物工程學會會士。
奇物論編輯部針對張良方教授近期的研究成果進行歸納總結,供大家學習和交流!
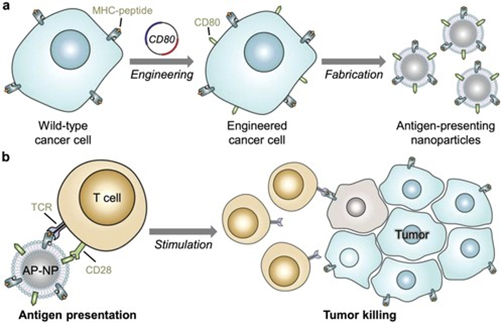
1. Advanced Materials:工程細胞膜包裹的納米粒子直接呈遞腫瘤抗原以促進抗癌免疫最近免疫療法的成功突出了利用免疫系統對抗癌癥的力量。為了使大多數以免疫為基礎的治療成功,必須調動具有正確腫瘤靶向特異性的T細胞亞群。當缺乏這種特異性時,為免疫系統提供處理和遞呈的腫瘤抗原物質是刺激抗原特異性T細胞群的一種常見策略。雖然原則上很簡單,但經驗表明,抗原呈遞過程的操作可能非常復雜,需要復雜的策略,而這些策略很難轉化。有鑒于此,美國加利福尼亞大學圣地亞哥分校的Liangfang Zhang、RonnieH. Fang等研究人員,報道了一種仿生納米顆粒平臺的設計,該平臺可用于直接刺激T細胞,而不需要專業的抗原提呈細胞。1)這些納米粒子是使用從癌細胞中提取的細胞膜涂層制造的,該涂層是為了表達共刺激標記而設計的。2)與膜表面自然呈現的多肽表位結合,最終的配方包含了促進腫瘤抗原特異性免疫反應所需的信號,啟動T細胞,可用于控制腫瘤生長。本文報道的方法代表了一種新興的策略,可用于開發多抗原,個性化的癌癥免疫療法。
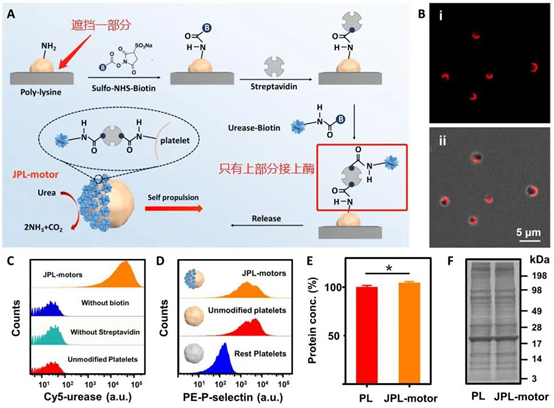
Yao Jiang, et al. Engineered Cell‐Membrane‐Coated Nanoparticles Directly Present Tumor Antigens to PromoteAnticancer Immunity. Advanced Materials, 2020.DOI:10.1002/adma.202001808https://onlinelibrary.wiley.com/doi/full/10.1002/adma.2020018082. 張良方/張學記院士等Science子刊 | 化被動為主動,天然血小板轉身變成主動遞藥系統!(深度解讀)美國加州大學圣地亞哥分校JosephWang、張良方教授聯合北京科技大學張學記院士等人通過用尿素酶對血小板表面進行不對稱功能化開發了一種獨特的細胞機器人系統。當暴露于天然燃料(尿素)時,酶通過將底物燃料轉化為不對稱的驅動力來推動血小板機器人,從而起到微馬達的作用。這種移動細胞被稱為Janus血小板微馬達(JPL馬達)。
Tang S, et al.Enzyme-powered Janusplatelet cell robots for active and targeted drug delivery.Science Robotics.2020;5(43):eaba6137.具有空間分辨隔室的管狀微電機被提供用于有效的特定地點貨物輸送,其具有后端鋅(Zn)推進劑發動機段和預先裝載貨物的明膠段,其進一步由pH響應帽保護。多室微電機顯示出強大的胃動力推進力,其壽命可調,具體取決于Zn段長度。這種推進通過推動和撞擊前端貨物段到胃壁上來顯著增強馬達在胃組織中的分布和保留。一旦微馬達穿透胃粘膜(pH≥6),其pH響應帽溶解,促進了自主局部貨物的釋放。加州大學圣地亞哥分校Joseph Wang和張良方等人系統地測試和討論了制造過程,物理化學性質和推進行為。1)增強保留。使用老鼠模型,裝載有模型貨物的多室馬達與單室馬達相比,顯示出均勻的貨物分布以及在胃襯里中大約四倍增強的保留,同時沒有顯示明顯的毒性。2)組合治療。除了基于明膠的隔室之外,治療有效載荷還可以加載到pH響應性帽中,導致同時遞送和順序釋放雙重貨物以進行組合治療。總體而言,這種多室微馬達系統提供了獨特的功能和優勢,將進一步推動合成微馬達的開發,用于生物醫學貨物的主動運輸和局部遞送。
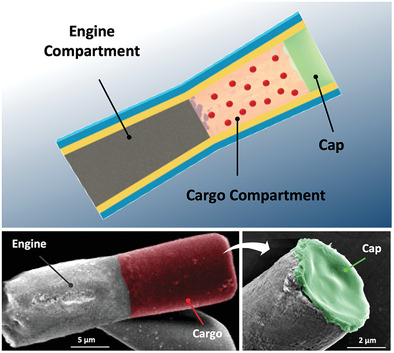
Esteban‐Fernández de ávila, et al. Multicompartment Tubular Micromotors TowardEnhanced Localized Active Delivery. Adv. Mater. 2020, 2000091.
DOI: 10.1002/adma.202000091https://doi.org/10.1002/adma.202000091長期以來,人們一直認為抑制磷脂酶A2(PLA2)可用于治療與PLA2活性升高有關的各種疾病。但是,仍然沒有安全有效的PLA2抑制劑。于此,加州大學圣地亞哥分校張良方教授報告了一種仿生納米顆粒設計,該設計可實現針對PLA2抑制的“引誘和殺死”機制(稱為”L&K-NP“)。1)L&K-NP由包裹有修飾的紅細胞膜的聚合物核制成,該膜具有兩個插入的關鍵成分:蜂毒肽和油氧乙基磷酰膽堿(OOPC)。蜂毒蛋白可作為PLA2引誘劑,與膜脂質一起“誘引”進入的PLA2進行攻擊。同時,OOPC充當抑制劑,可在酶攻擊時“殺死” PLA2。兩種化合物都被整合到L&K-NP結構中,從而消除了與自由分子相關的毒性。2)在研究中,L&K-NPs有效抑制PLA2誘導的溶血。在使用致死劑量的有毒PLA2的小鼠中,L&K‐NPs也能抑制溶血,并具有顯著的生存效益。此外,L&K‐NPs對小鼠沒有明顯的毒性。該設計為一種安全有效的抗PLA2方法提供了平臺技術。
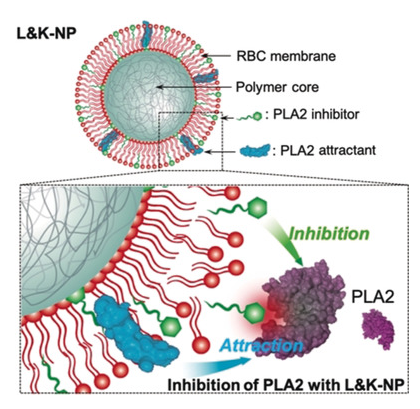
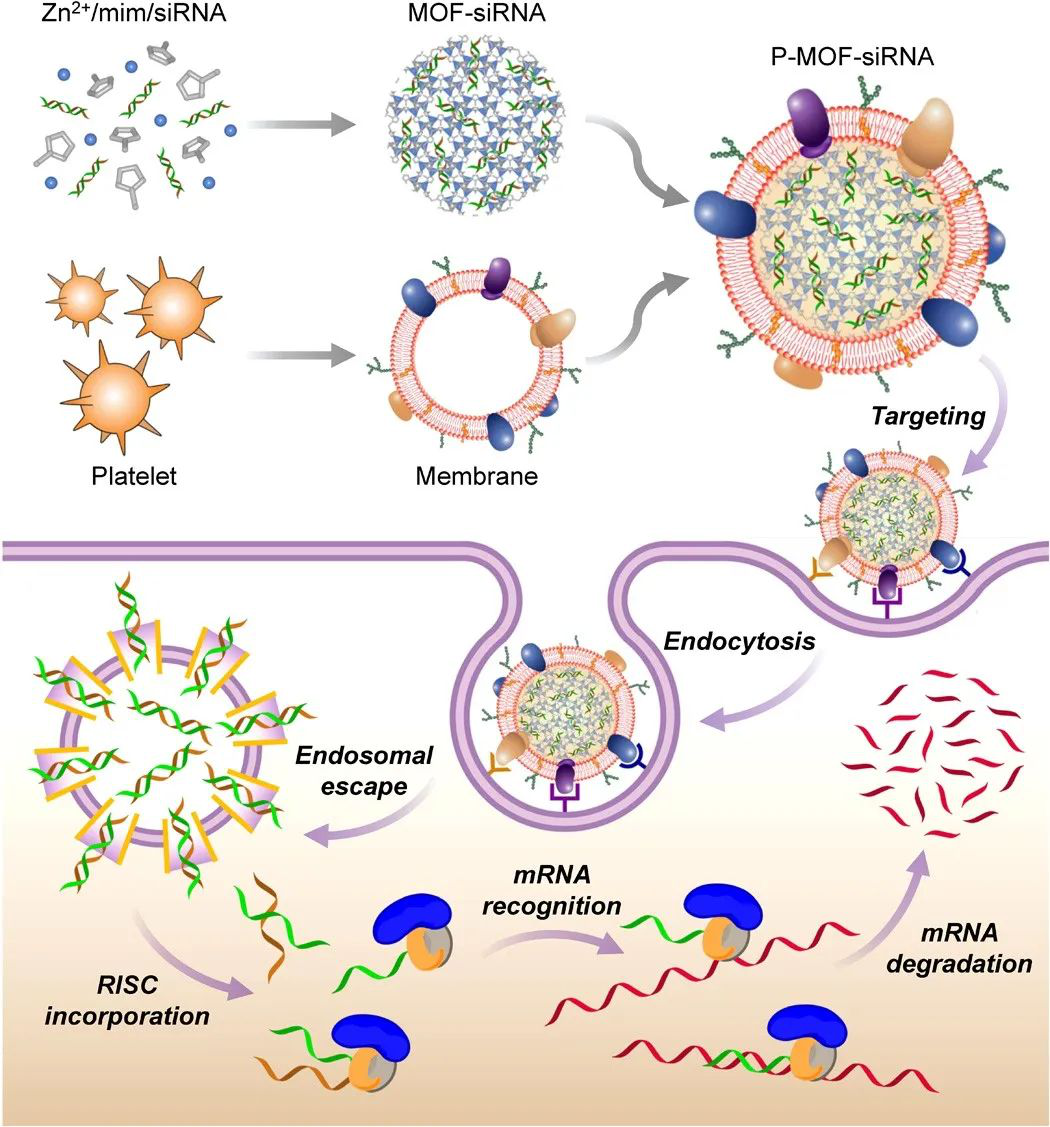
Zhang, Q., et al. (2020), ABiomimetic Nanoparticle to “Lure and Kill”PhospholipaseA2. Angew. Chem. Int. Ed..DOI:10.1002/anie.202002782https://doi.org/10.1002/anie.2020027825. Science子刊:血小板膜包裹MOF納米粒體內靶向基因沉默小干擾RNA(SiRNA)是一種強有力的基因沉默工具,已被廣泛應用于生物醫學領域,但在體內的治療應用面臨諸多挑戰。有鑒于此,美國加利福尼亞大學圣地亞哥分校的張良方教授、Ronnie H. Fang等研究人員,報道了一種血小板細胞膜包裹的金屬-有機骨架(MOF)納米遞送平臺,用于體內靶向遞送siRNA。本文要點1)MOF核心具有很高的載藥量,其對pH的敏感性使細胞攝取時的內體破壞成為可能。細胞膜涂層提供了一種與疾病底物進行生物接觸的自然方式。
2)結果表明,在體外可以對多個靶基因獲得較高的沉默效率。使用小鼠異種移植模型,觀察到顯著的抗腫瘤靶向性和治療效果。總體而言,本文提出的仿生納米遞送系統提供了一種在體內實現基因沉默的有效手段,并可用于擴大siRNA在一系列與疾病相關的應用中的適用性。Jia Zhuang, et al. Targeted gene silencing in vivo by plateletmembrane–coated metal-organicframework nanoparticles. Science Advances, 2020.DOI:10.1126/sciadv.aaz6108https://advances.sciencemag.org/content/6/13/eaaz6108?rss=16. Small:仿生納米海綿用于抑制全分泌致病蛋白細菌產生的體內殺傷性包裹完整紅細胞膜的聚合物納米顆粒可作為一種仿生納米海綿(RBC-NS)去吸收和中和與許多細菌感染相關的細菌毒性因子。耐甲氧西林金黃色葡萄球菌(MRSA)的全分泌蛋白(wSP)在小鼠體內可以誘導產生致死性。wSP不僅保持了細菌毒性的復雜性,同時也解決了活細菌感染的復雜性和動態性問題。張良方等人分析了RBC-NS對MRSAwSP的體外中和能力。通過小鼠模型的體內研究進一步證明, RBC-NS可顯著降低wSP誘導的致死率。此外,當小鼠服用亞致死劑量的MRSA上清液時,RBC-NS也可減少肺損傷并抑制脾臟核轉錄因子kappa B的活化。這些結果也為RBC-NS治療MRSA感染(如MRSA菌血癥和MRSA誘導的敗血癥)提供了系統的評價。
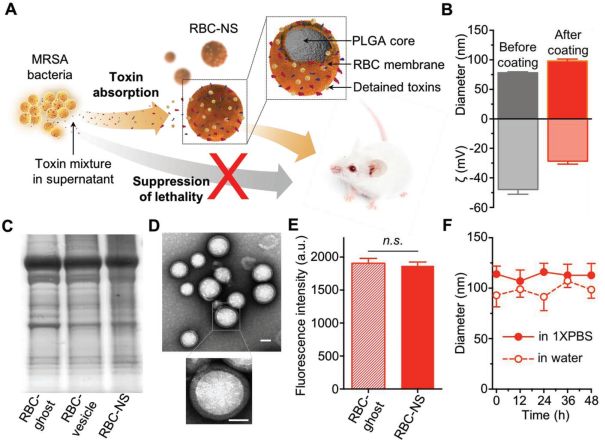
Chen, Y.J., Zhang, Y. et al. BiomimeticNanosponges Suppress In Vivo Lethality Induced by the Whole Secreted Proteinsof Pathogenic Bacteria.DOI: 10.1002/smll.201804994https://doi.org/10.1002/smll.201804994