靶向促凝血劑誘導的腫瘤血管選擇性血栓閉塞是腫瘤治療的一個重要研究方向。對于急性血管事件,強烈的治療效果通常發生在幾個小時內,導致治療時間比大多數其他療法短得多。促凝血劑靶向腫瘤血管也可廣泛應用于治療多種癌癥,因為腫瘤供血血管通常具有相似的特征。此外,促凝血治療不太可能引起耐藥性(目前臨床癌癥治療面臨的最大挑戰之一)。腫瘤特異性靶向凝血誘導蛋白組織因子(tTF)的胞外結構域,是血液凝固的主要起始因子,已通過配體工程實現靶向多種腫瘤血管標志物。然而,雖然以腫瘤血管為靶點的功能性tTF在動物模型中已被報道能迅速誘導血栓形成,但臨床上仍缺乏成功的應用。腫瘤治療需要有效,安全地梗塞腫瘤血管的新策略。
與tTF不同,凝血酶能夠通過直接激活血小板并在沒有其他輔助因子的情況下將循環的纖維蛋白原轉化為纖維蛋白而立即誘導血栓形成。因此,凝血酶應產生更有效和局部的閉塞作用,但腫瘤會復發。另外,腫瘤血管靶向/阻斷與細胞毒性藥物的結合可以更有效地抑制腫瘤的生長。但是,在先前的研究中,這兩種藥物是依序給藥的;這需要仔細選擇劑量和給藥計劃,因為次優的給藥和計劃可能導致兩種療法彼此相對。
成果簡介:
有鑒于此,國家納米科學中心聶廣軍研究員、趙宇亮院士、吳雁研究員等人開發了一種將凝血酶和化療藥物阿霉素(Dox)整合到單個納米載體中以同時殺死腫瘤的藥物共遞送納米系統。與兩種藥物的順序給藥相反,研究人員假設這樣的納米系統將通過同時影響腫瘤活力的兩個獨立方面(即腫瘤血液供應和癌細胞增殖)來引發協同效應,從而避免了與兩種單獨給藥的次優給藥和調度相關的問題。為了開發更經濟可行的納米載體,從而促進將血管阻斷療法轉化為臨床實踐,研究人員選擇了高分子大分子殼聚糖,由于其生物相容性和生物可降解性,被認為是一種可行的藥物材料,作為本研究中構建藥物共載納米系統的基石。

整體思路:
采用離子凝膠法成功制備了殼聚糖基高分子納米粒(NPs),該納米粒對Dox(約17%)和人凝血酶(約78%)具有較高的包封率。將具有CREKA序列的腫瘤歸巢五肽移植到NPs表面,產生具有活性腫瘤組織靶向能力的NPs。CREKA肽能夠特異性地識別纖維蛋白-纖維連接蛋白復合物(腫瘤血管壁和腫瘤基質中獨特地過度表達)。由此產生的NPs在腫瘤部位表現出凝血酶的受控釋放,局部引發腫瘤內血栓形成,從而剝奪了腫瘤的營養,同時積累了Dox,通過腫瘤內擴散殺死腫瘤細胞,包括位于腫瘤邊緣的細胞。
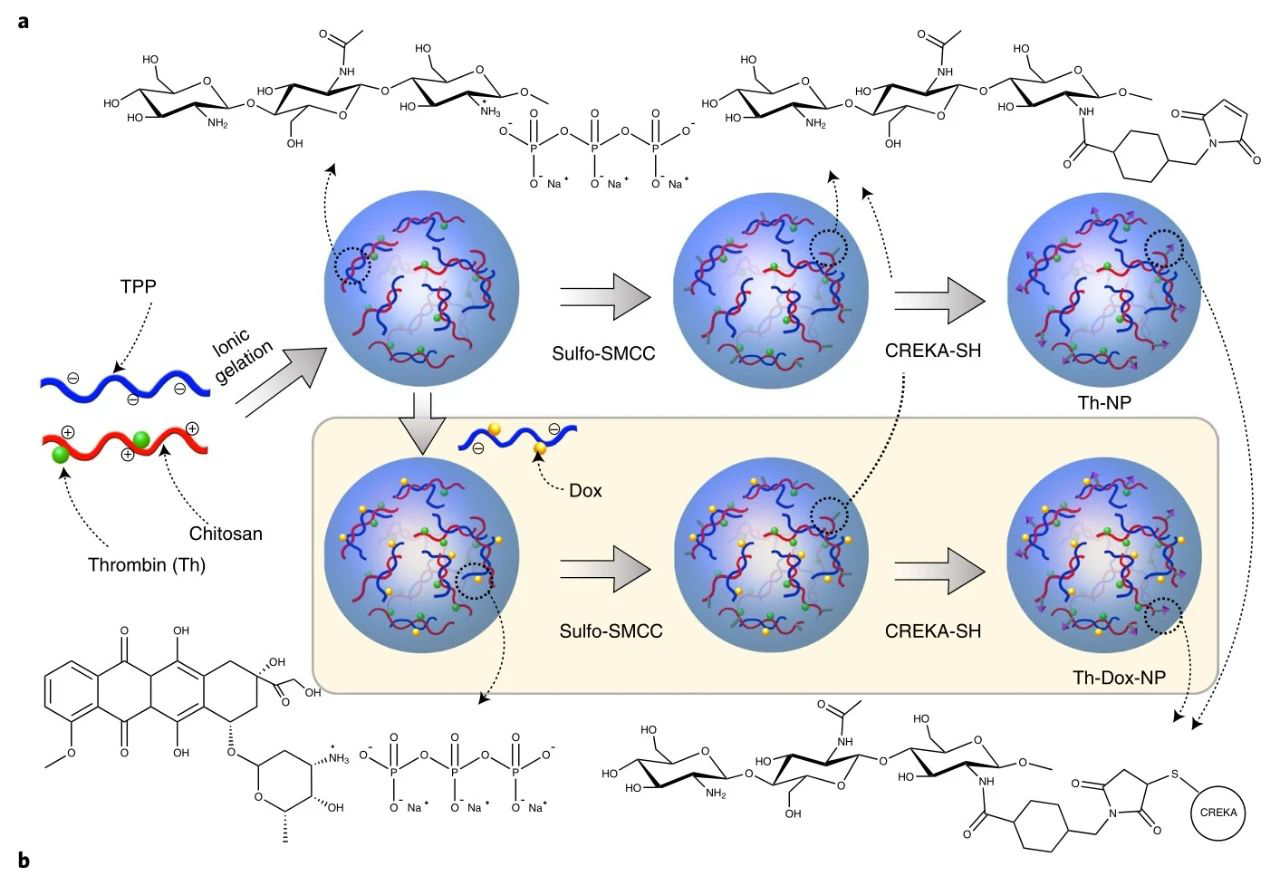

整體示意圖
選擇性靶向性
研究人員通過體內熒光成像評價納米載體的腫瘤靶向性和藥代動力學,結果表明,NPs在注射后主要被肝臟捕獲/清除,并通過腎臟迅速排泄,而靶向顆粒也顯示出相當大的腫瘤積累,而且相對于游離的Dox,Th-Dox-NP半衰期得以延長,其導致心臟組織中Dox濃度顯著降低(2.8倍)。這一發現是值得注意的,因為心肌病是游離Dox化療的劑量限制性副作用。Dox在腫瘤組織中積累的增加和心臟暴露的減少表明,Th-NP的封裝提高了Dox的治療功效。
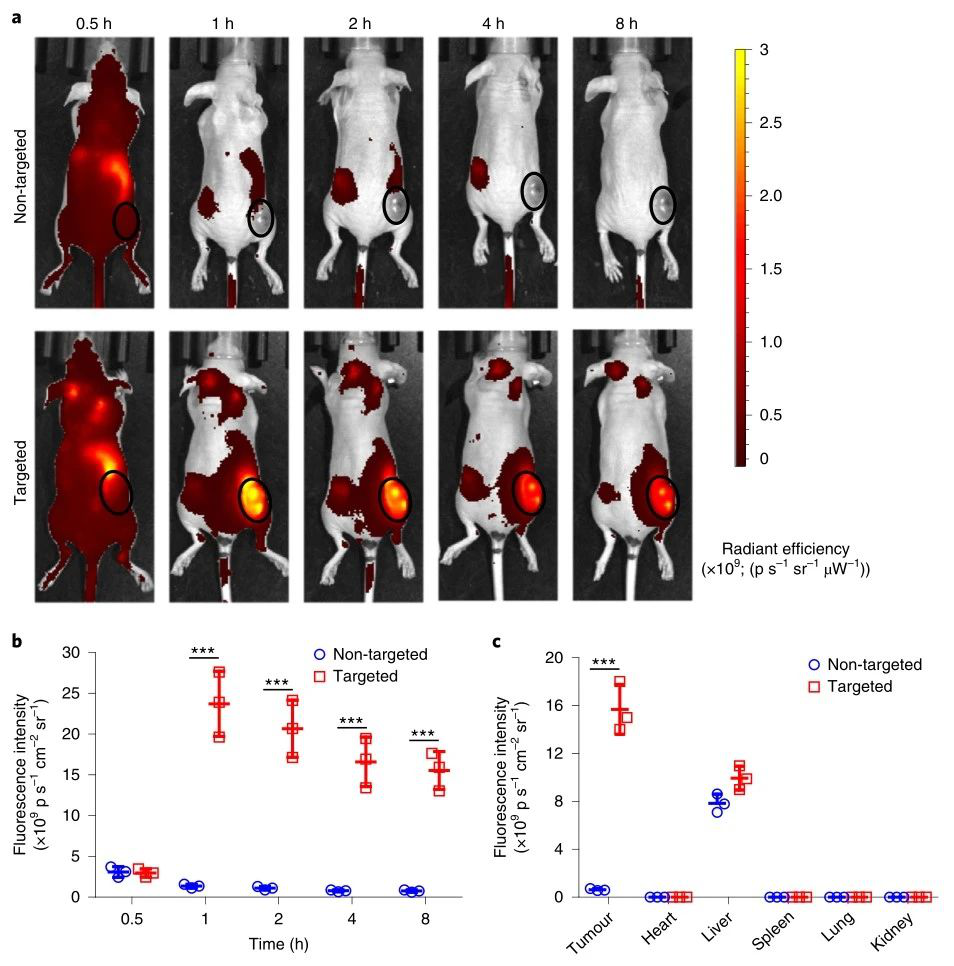
圖|腫瘤靶向性和藥代動力學
血栓形成
為了確定腫瘤中Th-Dox-NP的積累是否可以誘導血栓形成,研究人員用單尾靜脈注射Th-Dox-NPs(約2.30U凝血酶)對皮下接種MDA-MB-231乳腺腫瘤的小鼠進行了治療。注射后八小時,與對照組相比,腫瘤更明顯地被擦傷和變黑,表明由于血管破裂而積聚了血液。且其他器官均無明顯的可見的血塊,這表明Th-Dox-NP對腫瘤血管阻斷的高度選擇性。此外,Th-Dox-NP注射后72小時凋亡率達到92%。
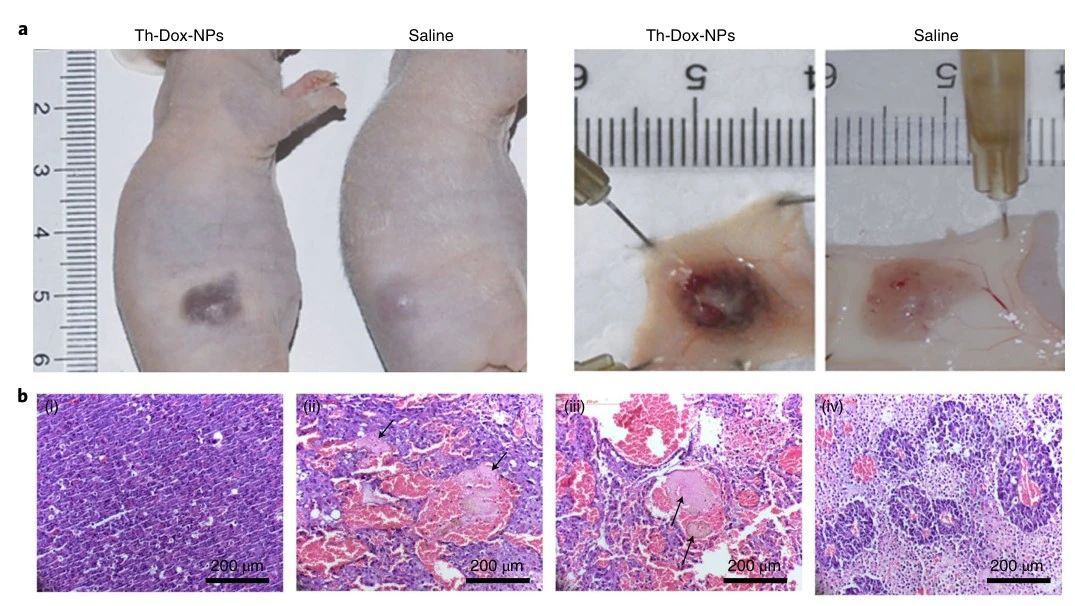
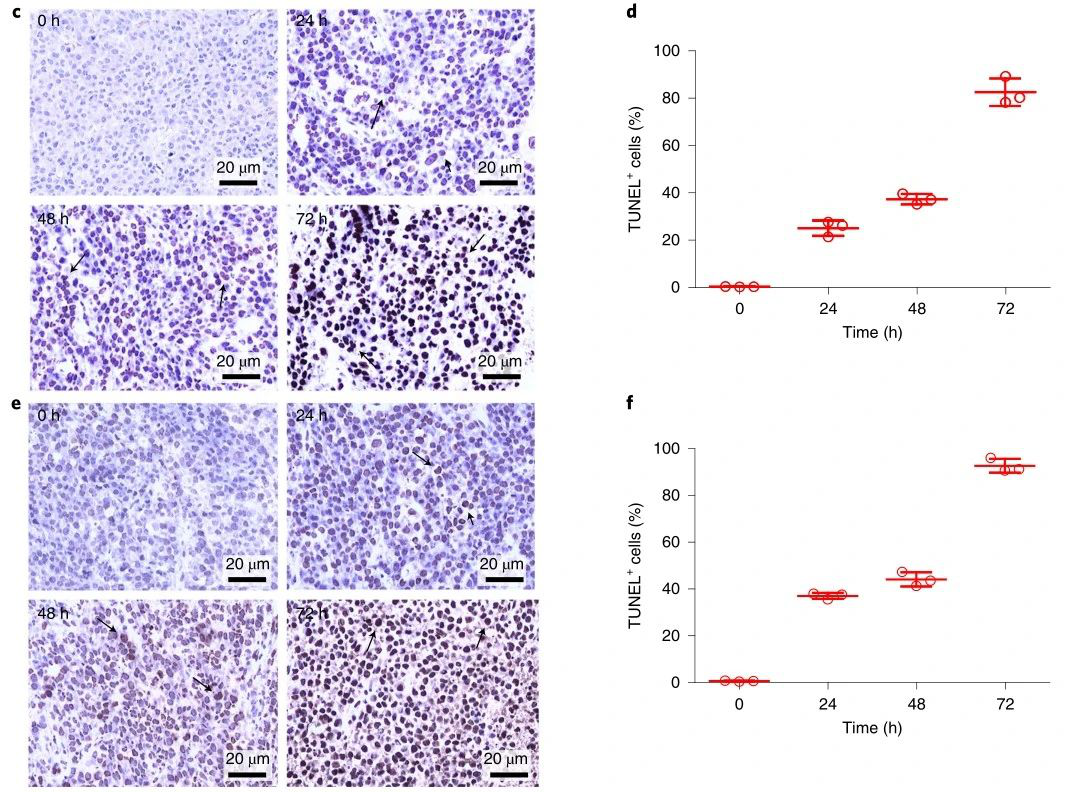
圖|th-Dox-NPs誘導血栓形成及腫瘤細胞凋亡
聯合治療效率大大提高
在抗腫瘤實驗中,接受Th-Dox-NPs的小鼠的中位生存期提高了> 45.0d,超過接受Th-NPs的小鼠35.0d和接受Dox-NPs的28.0d。重要的是,腫瘤的完全消退僅限于Th-Dox-NP組,其中80%的消退腫瘤沒有再生長,表明聯合治療的效率大大提高。此外,在小鼠和兔子的肝癌模型中,表明了這種組合策略適用于廣泛的血管化腫瘤。
長期安全性
在整個治療實驗中,未在小鼠中觀察到發病率或死亡率,這表明在目前的實驗條件下,Th-Dox-NPs不會引起嚴重的急性毒性。在動態高分辨率腦血流成像和各組織凝血情況等試驗中,均無造成明顯損傷。這些數據表明在目前的治療條件下Th-Dox-NP的長期安全性。
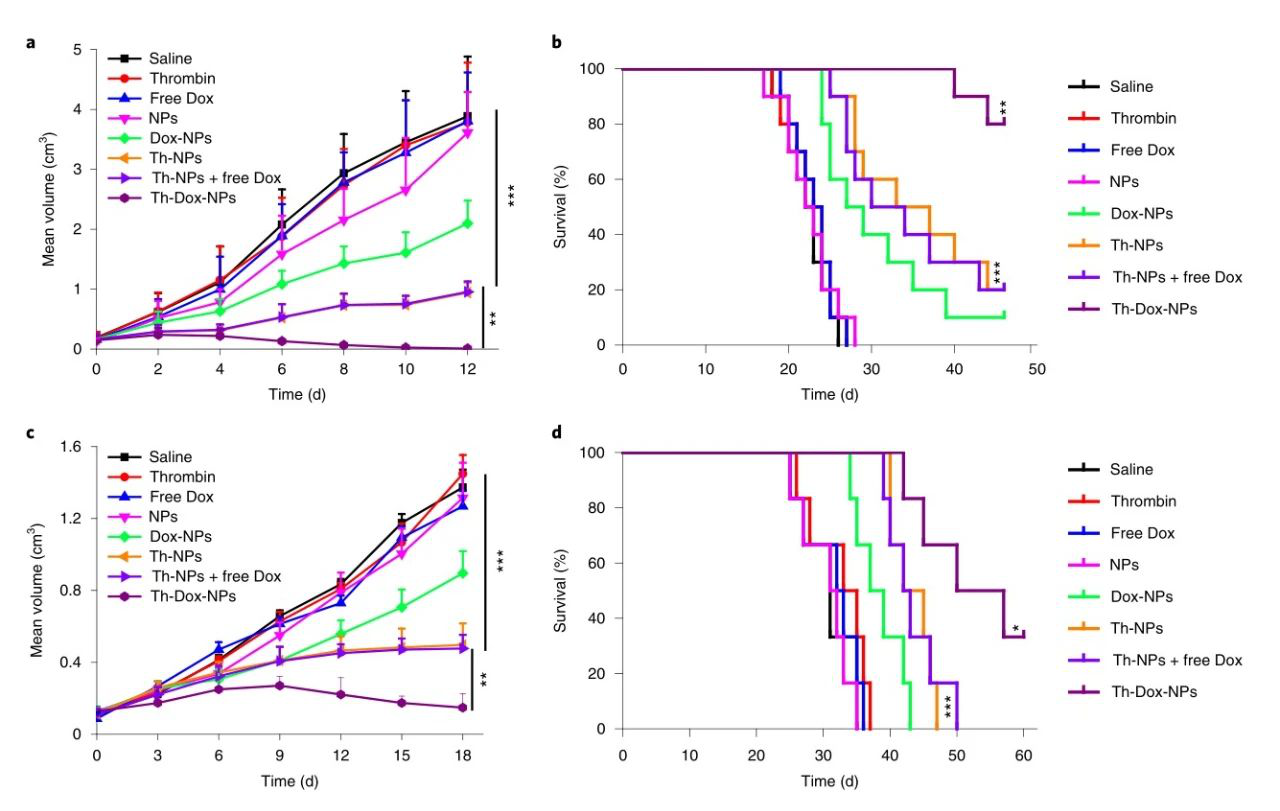
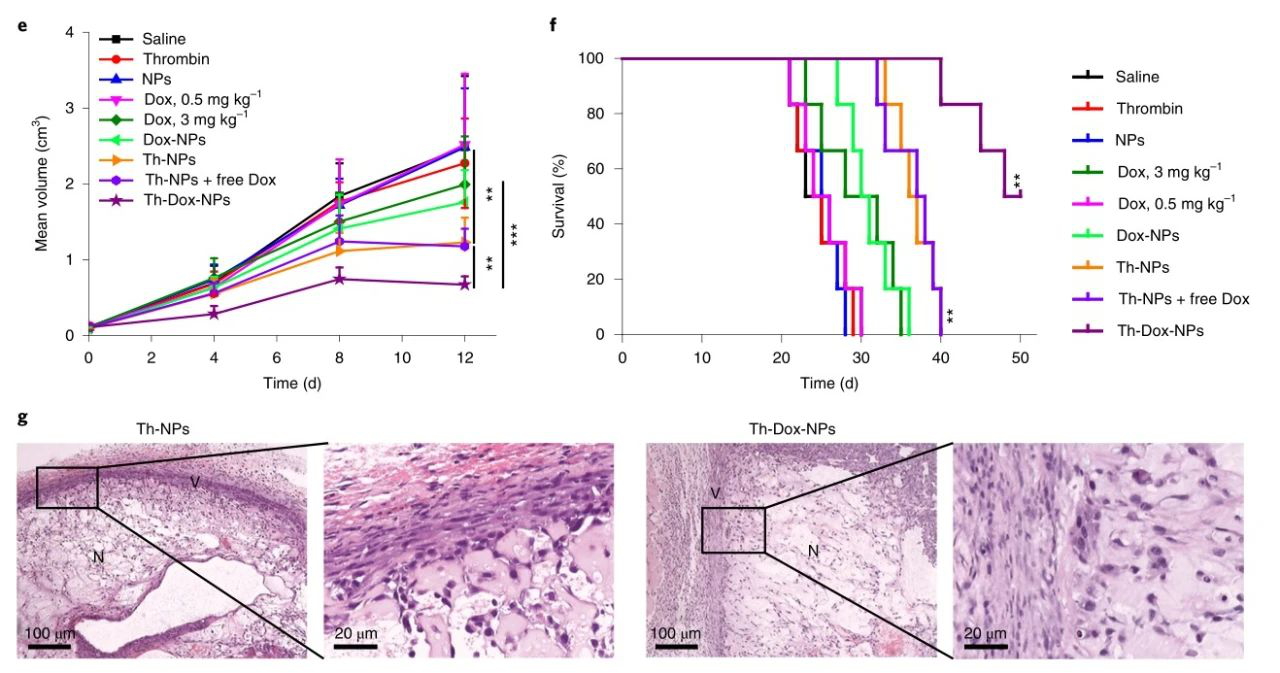
圖|抗腫瘤活性
總結與展望:
這項研究為基于凝血的腫瘤治療的進一步發展打開了一扇門,盡管在該領域進行了超過二十年的研究,但在該學科中幾乎沒有令人鼓舞的進展。因此,研究人員著手將阻斷劑與其他細胞毒性藥物結合起來,以對腫瘤治療和動物生存產生更持久的影響。
為了實現這一目標,本文探索了通過將兩種藥物整合到一種可生物降解的納米載體中來運送具有化學治療作用的血管閉塞劑的可行性,在這種載體中,殼聚糖NP可以有效制備并易于修飾以用于藥物遞送,并降解為水和二氧化碳。與現有的聯合治療策略(依次使用阻斷劑和細胞毒性藥物)相比,該策略由于同時攻擊腫瘤的兩個不同方面(血液供應和癌細胞增殖)而更有可能產生協同效益。通過選擇性地將凝血酶和化療性Dox共同遞送到具有主動腫瘤靶向機制的腫瘤中來實現這一目標。且這種方法還規避了優化連續給藥治療劑的劑量和時間安排的挑戰。
參考文獻:
Li,S., et al. Combination of tumour-infarction therapy and chemotherapy via theco-delivery of doxorubicin and thrombin encapsulated in tumour-targetednanoparticles. Nat Biomed Eng (2020).
https://doi.org/10.1038/s41551-020-0573-2











