
第一作者:劉翀
通訊作者:朱棣文,崔屹
通訊單位:斯坦福大學,芝加哥大學,SLAC國家加速器實驗室
研究亮點:
1. 為了提高低濃度Li的選擇性,該團隊利用了兩個有效途徑,第一個是利用TiO2涂層增加工作電極和海水之間的界面接觸并且提升Li的離子傳導;
2. 第二個是利用脈沖電化學方法降低了過電位,以驅動Li插入FePO4晶體結構,從而提高了選擇性和結構穩定性。
Li提取技術
儲能技術和電子產品的快速發展已將全球鋰需求提升到了2015年的約18萬噸碳酸鋰,預計到2030年將高達160萬噸碳酸鋰。其中140萬噸的需求將用于電動汽車(EV)和插電式混合動力汽車(PHEV)的鋰離子電池。到2030年,輕型汽車中有28%可能是電動汽車和插電式混合動力汽車,其中電動汽車約占80%。到2040年,大多數新型出售的輕型車輛將是EV。之所以放棄內燃機汽車,部分原因是全球溫室氣體排放引起的對氣候變化的關注以及對車輛排放PM2.5和NOx的健康問題日益關注。
關于Li資源,陸地上有4360萬噸Li,包括蘊藏在礦石中的1670萬噸和在鹽湖中的2690萬噸。目前,從鹽湖中提取Li(通常Li濃度在100至1000 ppm之間)主要是基于蒸發和化學沉淀。該方法中用于濃縮Li離子的預處理過程非常耗時。除了陸地資源,海水中存在2000億噸以上的Li,含量高出陸地5000倍,但Li的濃度僅為0.180 ppm。最近,從石油和天然氣開采過程中產生的水中獲得的Li也被列為考慮之中。在美國,石油開采期間每年產生25億加侖的水。假設采出水中Li的濃度為100 ppm,則采出水中每年將回收35萬噸鋰。
Li資源的供應問題被日益關注,一種高效的Li提取技術可以直接從海水中提取Li,開采過程中無需耗時的蒸發環節,將大大提高鋰的生產能力,以滿足未來幾十年對Li的預期需求。目前的相關研究包括開發吸附材料(例如MnO2或H2TiO3),利用選擇性透析。電化學方法是Li提取的一種嶄新且有吸引力的途徑,它可以利用新能源為電化學過程提供動力。在電化學提取Li的過程中,Li可以被電流驅動進入電極材料或通過Li選擇性膜實現分離。對于大多數使用電極材料的研究,目前重點還停留在對高濃度的Li鹽水的提取。對于Li濃度低得多的真實海水條件,提高選擇性是極具挑戰性的。
成果簡介
解決全球氣候變化和能源危機需要用Li離子電池驅動的電動汽車代替傳統燃料汽車。因此,在未來幾十年中,對Li元素的需求將急劇增加。海水中的Li含量超過2000億噸,是陸地礦石和鹵水資源總和的5000倍。開發有效的方法以從海水中直接提取Li以確保Li的供應非常有吸引力。然而,海水中Na的濃度比Li高4個數量級,而且Na與Li有相似的化學性質,這對Li的海水提取選擇性提出了很大的挑戰。
針對Li資源的供應問題,朱棣文,崔屹,劉翀等人開發了一種電化學方法,利用插層化學使用TiO2包覆的FePO4電極實現從海水中提取Li。針對海水里極低的Li/Na比,該研究團隊開發了脈沖靜置和脈沖靜置-反向脈沖靜置電化學方法來降低插層過電勢,并證明可以成功地提高Li的選擇性。此外,脈沖靜置-反向脈沖靜置方法還可以在Li和Na的共嵌入期間提高電極晶體結構的穩定性,并延長電極的壽命。此方法成功實現了從真實的海水中以1:1的Li: Na摩爾比回收Li,相當于1.8 × 104的選擇性。對于有較高的初始Li/Na比(1.6×10-3)的湖水,此方法實現了超過50:1的Li:Na的回收率。相關成果發表在Cell Press旗下的能源旗艦期刊Joule 上,題為“Lithium Extraction from Seawater through Pulsed Electrochemical Intercalation”。
要點1:通過電化學插層提取Li
電化學插層從海水中提取Li的過程如圖1所示。第一步,選擇能進行Li插層的工作電極。材料的選擇必須遵循以下規則:在鋰化和脫鋰期間,其電位在水穩定窗口之內。海水的pH值為8.2,與標準氫電極(SHE)相比,水穩定窗口設置為 -0.48V到0. 75V。在這項工作中,作者用脫Li的LiFePO4,也就是FePO4,作為工作電極,基于其具有在海水中穩定的鋰化和脫鋰的平臺。在Li提取期間,還存在用于配對對電極的選擇標準。由于多種原因需要避免使用產氧作為對電極反應。 a)它會導致海水環境的pH值發生明顯變化。b)溶解的氧氣會擴散到負極并還原為過氧化物。c)過氧化物會損壞FePO4電極。在本工作中,作者選擇NaFePO4作為對電極。在鋰的提取過程中,Na將釋放到海水中。由于從電極釋放的Na的濃度與背景Na相比濃度要低得多,因此可以最大程度地減少對海水的背景環境影響。在Li提取步驟中,將兩個電極放入海水中,并將系統保持在氮氣氣氛中(圖1b)。在第二步中,將充滿的FePO4電極放入新的回收溶液中,通過反向電壓將Li釋放到溶液中并同時排空FePO4電極。
從海水中提取Li的挑戰在于共存的Na離子。Li的化學性質與Na相似,但濃度低得多。 FePO4的Li嵌入電位相對于SHE為0.36 V,而Na的嵌入電位相對于SHE為0.19V。Li插層的電位差可以補償Li/Na的摩爾濃度比至0.0012。在鹽水或鹽湖水中,Li與Na的濃度比約為0.0018至0.3,根據圖1c所示的計算,插層化學應具有極高的Li選擇性。就海水而言, Li/Na的濃度比低至5×10-5,Na將與Li競爭嵌入到電極中。考慮到Li和Na之間的競爭,作者采取了不同的策略來促進Li的嵌入。
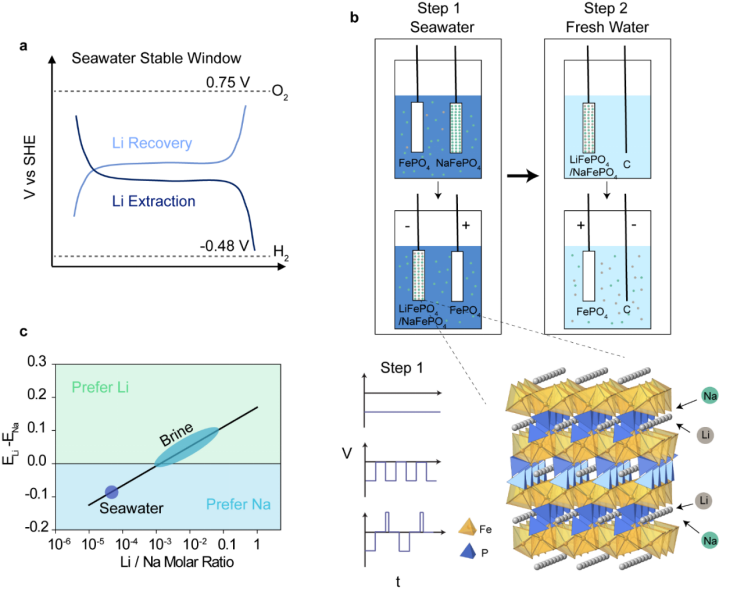
圖1. 通過電化學插層從海水中提取Li。a,示意圖描述插層電極選擇需要在海水穩定窗口內。b,Li提取步驟的示意圖。首先,使用FePO4電極和NaFePO4作為海水中的工作電極和對電極進行Li嵌入。然后,工作電極在回收溶液中再生并釋放提取的Li。c,使用FePO4電極計算初始Li與Na摩爾濃度不同時的Li和Na嵌入電位差。
要點2:脈沖電化學方法提高Li的選擇性
首先,為了增加電極與海水接觸,在電極制造后,作者在FePO4的表面引入了親水涂層。在這里,作者選用了通過原子層沉積法的TiO2作為涂層。Li在非晶態TiO2中的擴散率與FePO4處于同一數量級,因此薄涂層不會增加Li擴散的勢壘。此外,與Na相比,TiO2的Li擴散勢壘更小,這有助于改善Li對Na的選擇性。作者研究了兩種厚度的TiO2涂層,分別為3 nm和5 nm。TiO2涂層的厚度沒有顯著改變電極的電導率。在海水提鋰中,從電化學曲線(如圖2A所示)可以明顯看出,3 nm和5 nm的TiO2涂層都降低了Li插入的過電勢。然后,作者在淡水溶液中通過脫鋰過程測試了從電極回收的Li和Na。如圖2B所示,對于具有0 nm,3 nm和5 nm的TiO2涂層的FePO4電極,Li /(Li + Na)的摩爾比為30.2±2.1%,48.0±1.9%和44.9±7.4%。由于3 nm TiO2涂層具有最高的選擇性,因此作者在后續所有電化學方法選擇測試中都采用了這一條件。
接下來,作者對電化學方法進行優化以提高Li的選擇性。不同的電化學嵌入方法將導致不同的過電勢來驅動Li提取過程。作者將恒流插層方法與脈沖靜止和脈沖靜止-反向脈沖靜止方法進行了比較。對于脈沖靜止方法,測試了具有10 s靜止10 s插層(P10s)和1 s靜止1 s插層(P1s)的方法。電化學曲線示于圖2C。對于相同容量的鋰提取,脈沖停止方法P10s和P1s均顯示出比恒流方法小0.05V的過電勢。電極阻抗在所有測試中均相似。結果,在脈沖電化學方法P10s和P1s中,回收的Li /(Li + Na)摩爾比分別比恒定電流方法中的31.4±1.7%更高,分別為49.7±0.35%和47.4±5.1%(圖2D)。)。脈沖鋰化方法為電極提供了一個休息時間,使鋰和鈉重新分布在電極中的所有顆粒中,并確保所有顆粒中的鋰/鈉含量更加均勻,從而改善了電極的均一性并減少了插層的過電勢。除了脈沖靜止方法外,還測試了脈沖靜止-反向脈沖靜止方法。在這種方法中,在一個周期中既有正向脈沖又有反向脈沖。正向脈沖及其靜止周期均為10 s,振幅相同的反向脈沖及其靜止周期分別為2 s和10 s(P10sR2s)。在電化學過程中經常使用反向脈沖來產生更均勻的濃度前沿。如圖2D所示,該脈沖靜止-反向脈沖靜止方法的選擇性為50.2±0.78%。它也比恒流方法高。脈沖電化學方法的引入成功地促進了Li的嵌入。在這三種脈沖方法中,第一循環的選擇性類似于1:1的Li / Na回收比,這相當于Li對Na的海水選擇性為1.8×104。
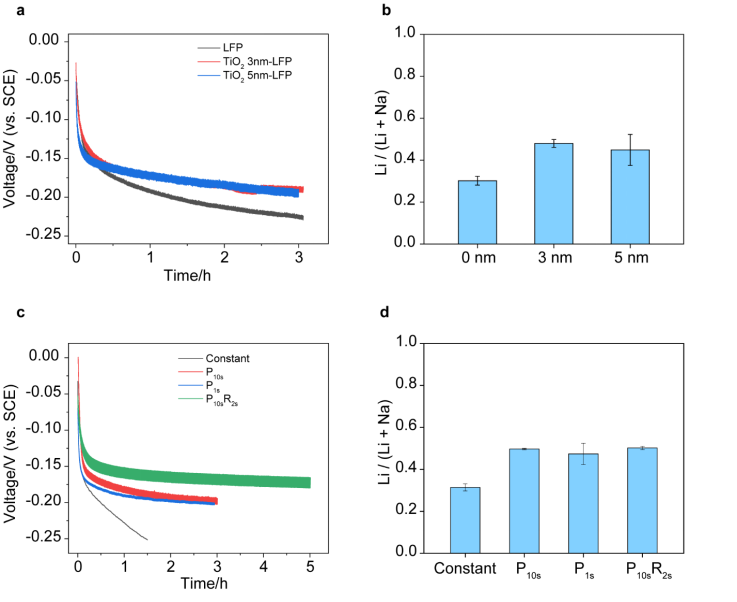
圖2. a,0 nm,3 nm和5 nm TiO2涂層的FePO4電極在海水中的插層電化學曲線。b,具有不同厚度的TiO2涂層的FePO4電極的Li選擇性。c,TiO2-FePO4電極通過不同的電化學方法在海水中的插層電話學曲線:恒定電流,P10s,P1s和P10sR2s。d,TiO2-FePO4電極采用不同的電化學方法的 Li選擇性。
要點3:循環穩定性測試
作者研究了三種脈沖電化學方法(P10s,P1s和P10sR2s)的循環穩定性。每個循環都涉及Li的提取和回收過程并測量Li的選擇性和法拉第效率。在循環測試中,這三種方法在穩定性方面存在明顯差異,如圖3所示。在脈沖方法P10s和P1s中,選擇性和庫侖效率都顯示出下降的跡象。P1s下降速度更快,在第5個循環后,選擇性從Li /(Li + Na)摩爾比50%降至31.9±0.40%。在第7個循環中,Li /(Li + Na)的摩爾比僅為13.5±0.68%。在P10s中,選擇性在第6個周期開始下降,而在第10個周期之前,選擇性在30-36%之間。在第10個循環中,選擇性下降至10.8±0.97%。但是,對于P10sR2s方法,在10個循環內沒有電極不穩定的跡象,并且循環的選擇性維持在50%。P10s和P1s方法中電極循環穩定性的下降可能是由于Li和Na的共嵌入行為引起的。在共嵌入過程中,Li和Na的擴散率不同,這可能導致擴散較慢的Na引起局部堵塞。相反,反向脈沖和靜止周期將允許Li和Na重新分布并減小電極的局部應力。同樣,作者假設反向脈沖可以幫助從電極中除去Na,因為Na脫嵌的電位比Li脫嵌的電位低。這有利于增強電極的長期穩定性。另外,作者通過將電極直接在海水中浸泡24小時,對TiO2-LiFePO4進行了穩定性測試,并通過溶解測量了電極中Li和Fe的含量。根據Li和Fe的濃度,計算出LiFePO4的質量負載,與原始質量負載相比沒有明顯變化,誤差分別為-2%和+4%。
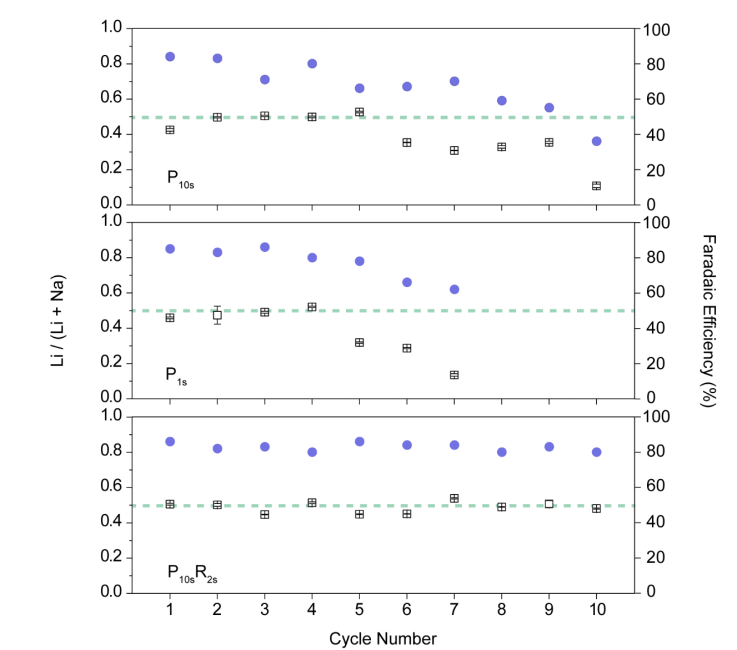
圖3. 在不同電化學方法進行循環穩定性測試的Li選擇性和法拉第效率結果。
要點4:電極循環后表征
作者使用掃描電子顯微鏡(SEM)和透射電子顯微鏡(TEM,圖4)對P10sR2s方法中的FePO4顆粒進行表征。在電極選擇性測試第10個循環后進行了另一次插入。從SEM圖像來看,電極的形貌只有微小的變化。SEM成像后,將FePO4顆粒從電極上超聲處理以進行TEM表征。圖4中顯示了三個顆粒代表電極上的粒子。Li元素用電子能量損失譜(EELS)表征。 Na和Fe元素通過能量色散X射線譜(EDX)進行表征。Fe用作LiFePO4的參考。Li EELS信號表明,插層遵循相變,類似于在電池陰極中的Li插層,其邊緣具有較高的Li濃度。在邊緣濃度較高的情況下,Na表征未提供相同的分布。但是,從該圖可知,Na均勻地存在于粒子表面,這表明Li和Na共存于結構中。同時X射線衍射(XRD)也確認了共插入。從形態方面來看,顆粒在循環后保持其完整性,但是在顆粒上發現了細小裂紋,這可能是由于插層后電極的膨脹引起的。
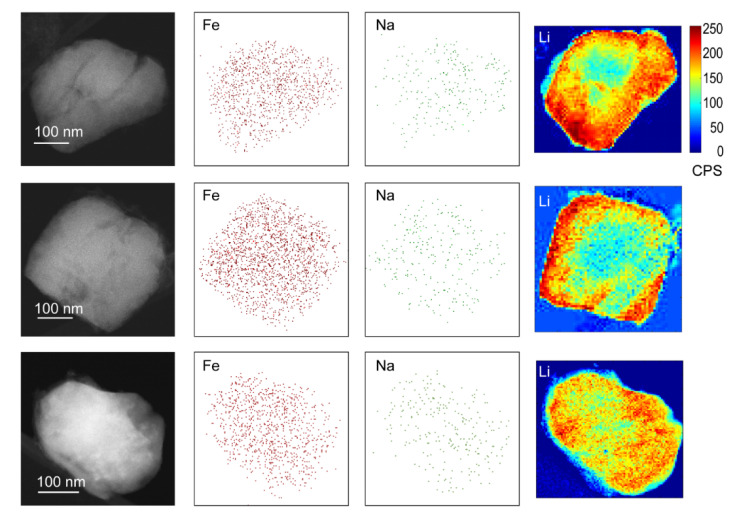
圖4. 使用P10sR2s電化學方法提取和回收Li的10個循環后,FePO4顆粒的TEM表征。從左到右:FePO4顆粒的TEM圖像,Fe EDX元素分布,Na EDX元素分布,和Li EELS元素分布。
要點5:電化學提Li的高選擇性和高收率
最后,作者證明了電化學插層可以從不同的Li:Na摩爾比的人造鹽水以及從猶他州鹽湖獲得的鹽湖水提取Li。測試了Li與Na之比為5.4×10-5, 5.0×10-4和4.0×10-3的模擬溶液。Li與Na之比為5.4×10-5類似于海水情況。如圖5所示,使用相同的P10s電化學方法,選擇性分別為50.2±0.78%,94.3±4.0%和接近100%(Na低于檢測限)。這表明如圖1c所示,在插入FePO4材料中,Li對Na的熱力學選擇性優勢。作者還從猶他州鹽湖收集了湖水。通過ICP-MS測量,湖水中含有21.4 ppm的Li和4.26×104 ppm的Na。Li和Na的濃度均高于海水中的濃度,Li/Na比為1.6×10-3。在電流為C/5的相同P10s電化學方法中,回收的Li/(Li + Na)摩爾比為98.1±1.0%。還測試了P10s電化學方法更高的1C電流速率。回收的Li/Li + Na)摩爾比為90.6±4.7%。更高的電流代表更高的生產率,并且結果顯示出電化學提Li具有高選擇性和高收率的巨大潛力。在實際應用中,作者提出希望在當前的回收步驟之后增加一個類似于鹽水開采的額外步驟,以將Li沉淀到Li2CO3中以進一步使用。
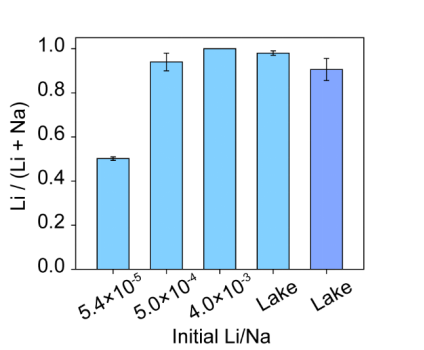
圖5. 使用P10s電化學方法和TiO2-FePO4電極在具有不同的初始Li/Na摩爾比和真實湖水的溶液中的Li選擇性結果。對于湖水,測試了兩種不同的流速。C/5速率結果顯示為淺藍色(左),而1C速率結果顯示為深藍色(右)。
小結
作者證明了用電化學插層法和FePO4電極能夠成功從海水和鹽湖水中提取Li。通過引入親水涂層以及脈沖電化學方法可以降低嵌入過電勢從而提高Li的選擇性。通過使用脈沖-靜止-反向脈沖-靜止的方法,作者實現了從海水中穩定提取Li的10個循環,Li / Na的回收率為1:1,這相當于1.8 × 104的選擇性。雖然電化學海水提Li顯示了巨大的潛力,這種方法需要穩定的進行成百上千的電化學循環。因此,即使在重復循環后有少量的Na插入電極材料中,也會導致應力裂紋和電化學容量的損失。以后的工作應尋求開發改進的親水性界面涂層,該涂層將作為防止Na侵入電極的屏障。此外,為防止電極在長期使用中結垢堵塞,必須對海水(或鹽湖水或采油后產生的水)中的微米,納米和粒子/分子進行過濾。作者認為這些障礙是可以克服的,這項工作對確保Li的充足供應以及提高電動汽車的大規模部署提供了可行的解決方案。
參考文獻:
Chong Liu et al. Lithium Extraction fromSeawater through Pulsed Electrochemical Intercalation. Joule, 2020.
DOI: 10.1016/j.joule.2020.05.017
https://www.cell.com/joule/fulltext/S2542-4351(20)30235-X
作者介紹:

第一作者:劉翀,芝加哥大學Pritzker分子工程學院Neubauer Family助理教授。2015年于美國斯坦福大學材料系獲得博士學位。2015-2018年于朱棣文和崔屹教授課題組從事博士后工作。主要研究方向有分離技術,水凈化空氣凈化技術,材料的設計和合成,電池及催化等。在Nature Nanotechnology,Nature Energy, Nature Communication, Nano Letters等雜志發表30多篇論文。

通訊作者:朱棣文,斯坦福大學物理系以及分子和細胞生理學系William R. Kenan Jr.教授。1997年諾貝爾物理獎得主。美國國家科學院,美國藝術與科學研究院,美國哲學學會和臺灣中央研究院的院士,以及中國科學院和韓國科學院的外籍院士。美國AAAS協會主席。在Science,Nature等雜志上發表超過300篇文章。

通訊作者:崔屹,1998年在中國科學技術大學獲得理學學士學位,2002年在哈佛大學獲得博士學位,2003-2005年在加州大學伯克利分校從事博士后研究,現為美國斯坦福大學材料系終身教授,英國皇家化學學會會士,美國材料學會會士,電化學學會會士。現任Nano Letters副主編、美國灣區太陽能光伏聯盟(Bay Area Photovoltaics Consortium)主任以及美國電池500聯盟(Battery500 Consortium)主任。崔屹教授課題組研究方向包括高能硅負極、高能鋰離子電池、鋰金屬電池、電催化二氧化碳還原、電催化水分解、氧還原、智能調節人體溫度的高分子纖維織物、高效過濾PM 2.5顆粒、冷凍電鏡等研究領域。在Science, Nature等雜志發表超過300篇論文。H因子為166(Google Scholar),授權國際專利40余件。獲得獎項包括2019年度Dan Maydan獎, 2019 Nano Today獎,2017年度Blavatnik青年科學家獎, 2015年MRS Kavli Distinguished Lectureship in Nanoscience, Resonate Award for Sustainability,2014年Nano Energy獎,2013年IUPCA(國際理論化學與應用化學聯合會)新材料及合成杰出獎,2011年哈佛大學威爾遜獎,2010年斯隆研究基金,2008年KAUST研究獎,2008年ONR 年輕發明家獎,2007年MDV創新獎等,2004年入選“世界頂尖100名青年發明家”。











