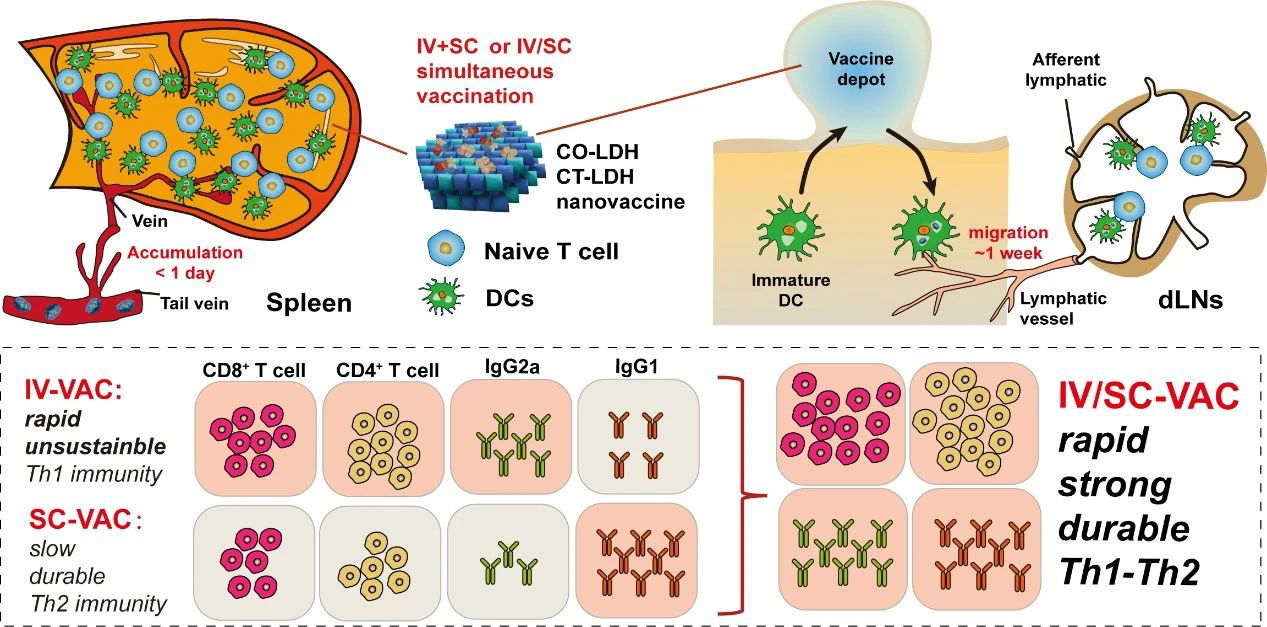
“疫苗結節”的形成對于免疫應答的維持有重要作用,但也因此導致疫苗誘導抗腫瘤免疫應答速率過慢,從而無法有效抑制惡性腫瘤的快速生長。如何在不改變疫苗組分的前提下,使疫苗能夠快速誘導并維持強烈的抗腫瘤免疫應答,是當前腫瘤治療性疫苗研究的難點之一。為此,中國科學院過程工程研究所劉瑞田研究員、昆士蘭大學澳大利亞生物工程與納米技術研究所許志平教授和張凌宵博士等人首次提出聯合靜脈免疫(IV-VAC)和皮下免疫(SC-VAC)的腫瘤疫苗接種新策略,成功實現強烈的抗腫瘤免疫應答的快速誘導與維持。
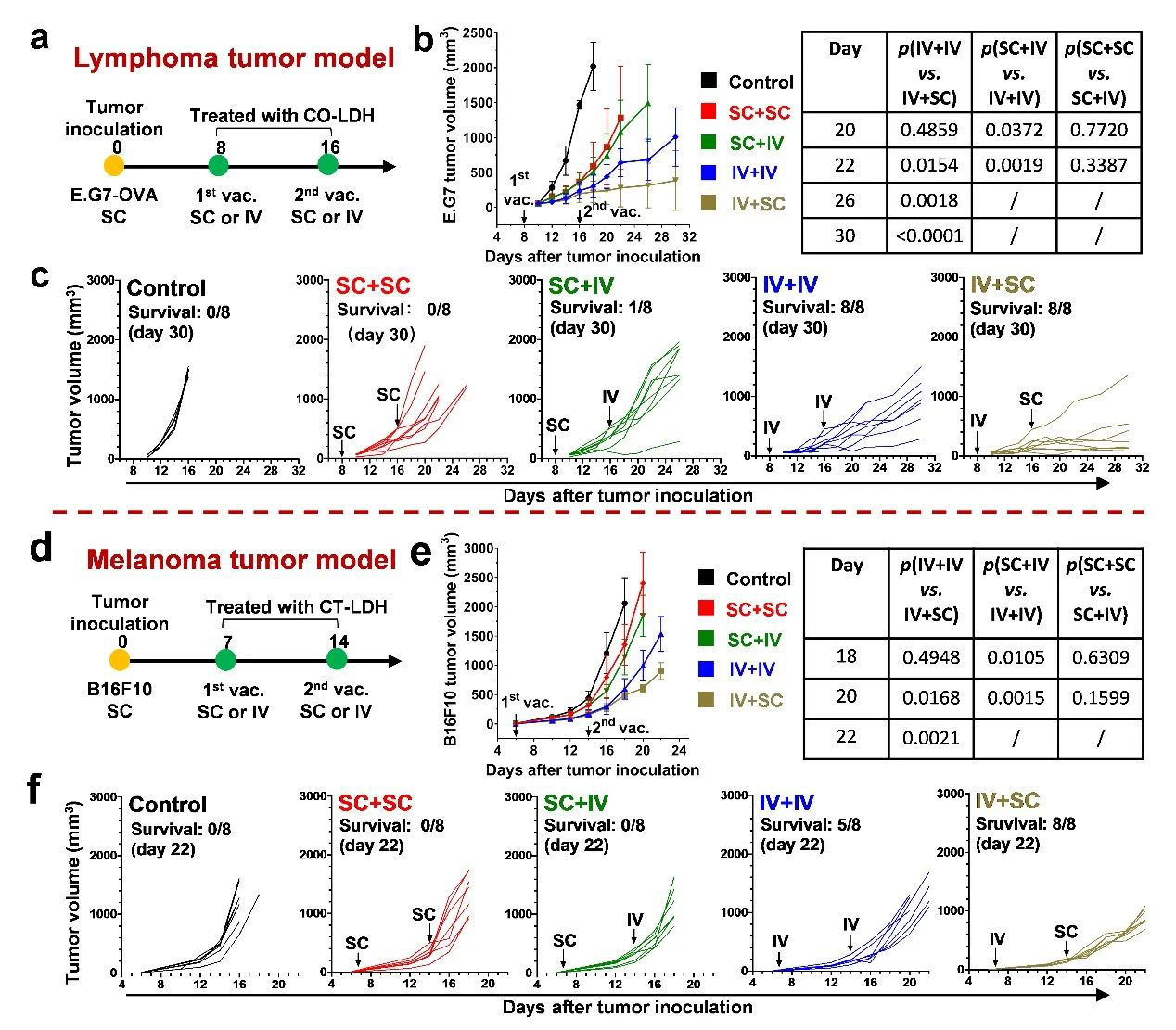
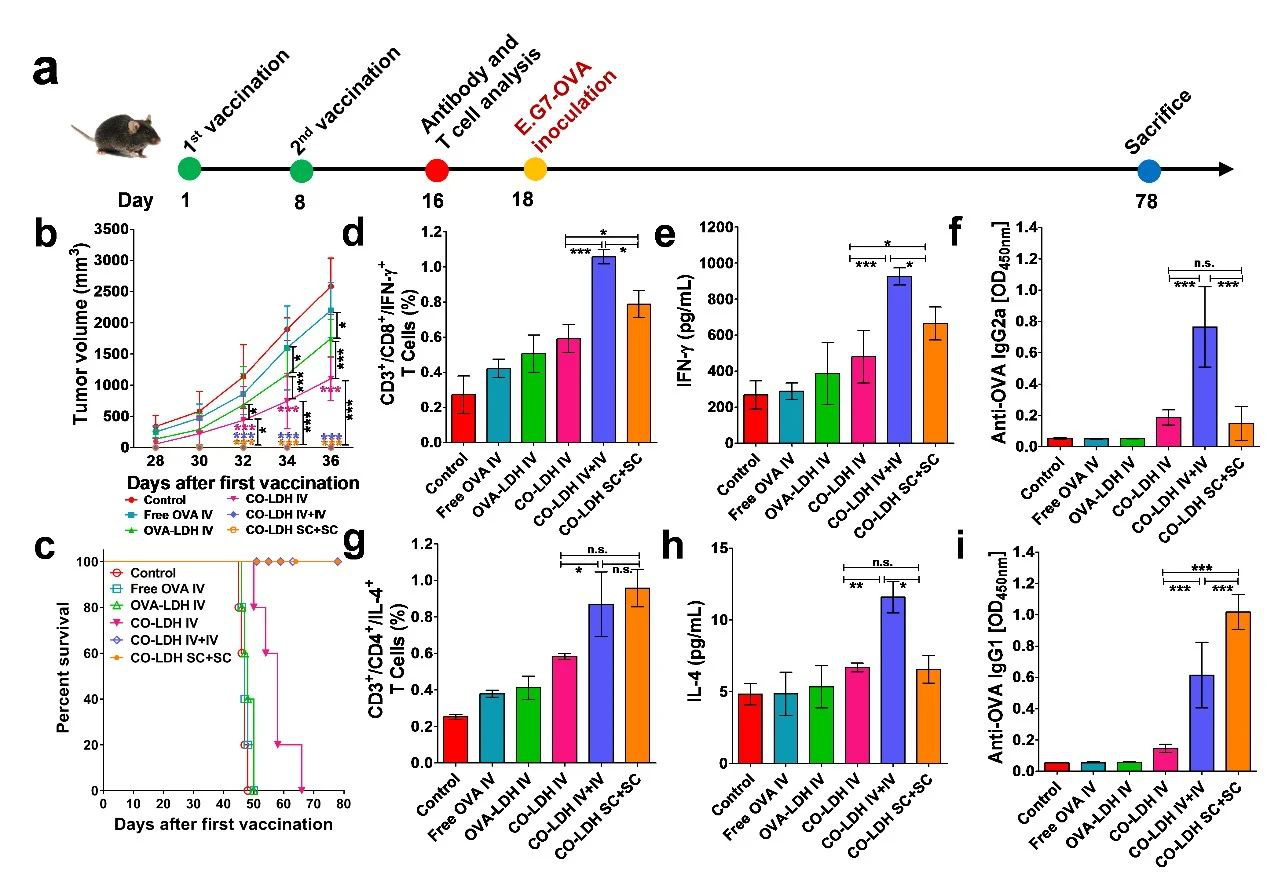
團隊的前期研究充分證明新型“CpG-水滑石(C-LDH)協同佐劑”具有很高的佐劑活性,能夠顯著增強疫苗誘導抗腫瘤免疫應答的能力(Biomaterials, 2014, 35: 9508-9516)。同時,借助于“白蛋白包覆”技術(J. Mater. Chem. B, 2015, 3: 3331-3339),LDH疫苗能夠在體內保持良好的分散狀態,在皮下注射后主動遷移至淋巴結,顯著提高了疫苗的抑瘤效率(Biomaterials, 2018, 174: 54-66)。基于上述研究,本工作分別制備了用于小鼠E.G7-OVA淋巴瘤和B16F10黑色素瘤免疫治療的CO-LDH(OVA抗原)和CT-LDH(BSA-Trp2抗原)納米疫苗,通過體內實驗證實納米疫苗接種新策略顯著提升疫苗的抑瘤效率。1)“IV初免 + SC加強”(IV + SC)的疫苗接種策略(即在腫瘤早期使用IV-VAC進行初次免疫,隨后使用SC-VAC進行免疫加強),能夠在腫瘤早期快速誘導機體產生強烈的抗腫瘤免疫應答來抑制腫瘤生長,并在SC-VAC的幫助下維持并逐步加強免疫強度。這種疫苗接種新策略表明,相同的疫苗僅通過優化免疫接種策略,即可顯著提高疫苗的抑瘤效率。
2)疫苗在IV-VAC時被脾臟迅速捕獲(<1天),而在SC-VAC時則主要停留在注射位點,緩慢刺激皮下免疫細胞和淋巴結(dLNs)。體內研究表明,IV-VAC可快速誘導強烈且偏向Th1的免疫應答,但免疫持續性較差;SC-VAC緩慢誘導偏向Th2的免疫應答,但免疫應答逐步增強且持久。

3)在免疫預防E.G7-OVA淋巴瘤實驗中,在IV + IV或SC + SC疫苗接種策略下,與IV + SC策略一樣,疫苗均有充足的時間來誘導強烈的抗腫瘤免疫應答,從而有效預防腫瘤生長。類似地,當疫苗以肌肉注射或腹腔注射方式接種時,小鼠體內均未觀察到腫瘤生長。這表明疫苗的免疫應答誘導快慢是決定治療性腫瘤疫苗療效的關鍵。
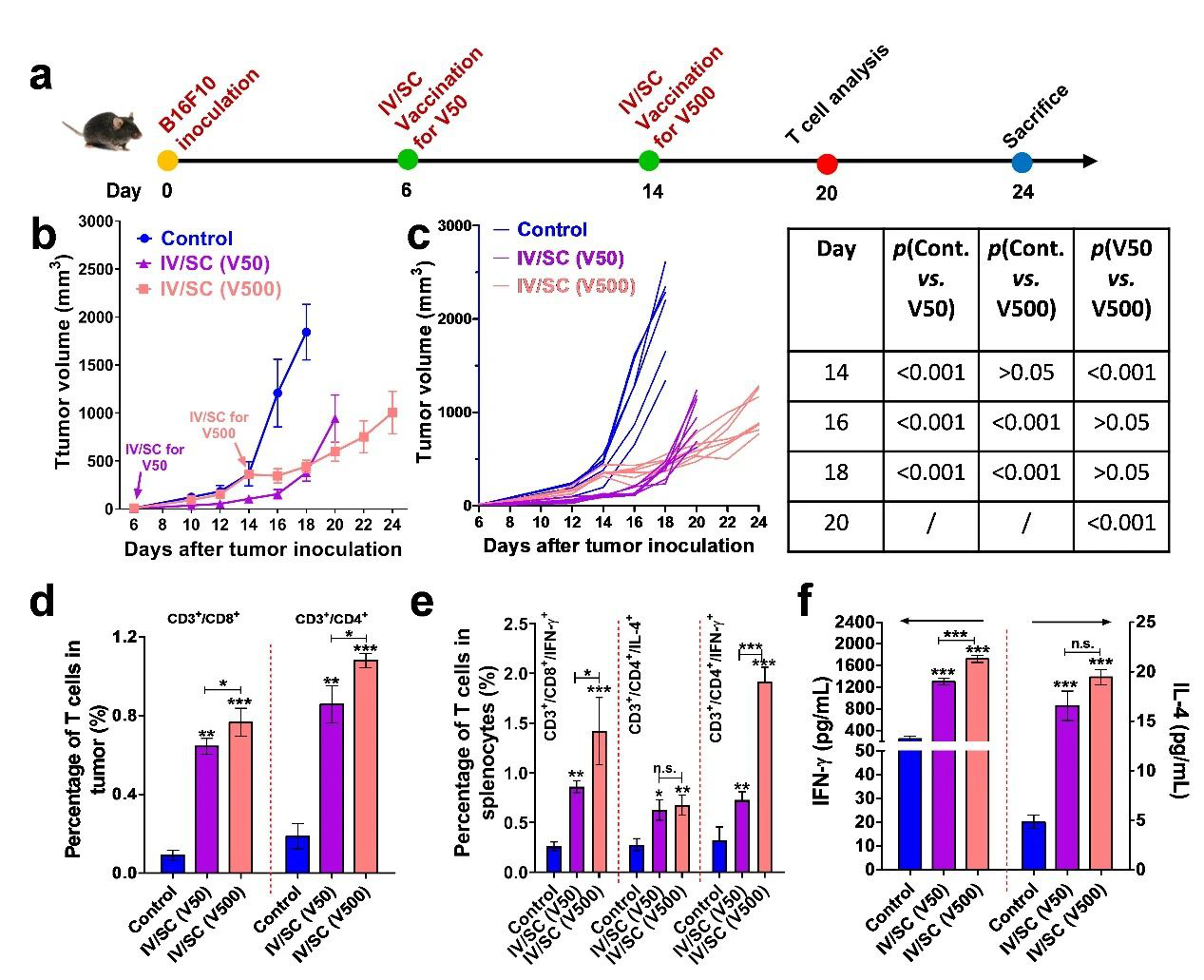
4)在免疫治療中晚期B16F10黑色素瘤時,通過單次同時IV-VAC和SC-VAC(IV/SC)接種疫苗,能夠同時刺激二級淋巴器官(脾臟和dLNs),從而快速誘導強烈的抗腫瘤免疫應答來迅速抑制小鼠中晚期腫瘤(~500 mm3)生長。這種IV/SC同時接種策略相對前述IV + SC前后接種策略,能夠在更短時間內誘導更高水平的抗腫瘤免疫應答。在臨床上,或許可以結合現有的疫苗,通過對中晚期腫瘤患者采用IV/SC同時接種方式進行多次免疫治療來有效延緩腫瘤生長,從而為選擇最佳的治療方案提供足夠的時間窗口。
Lingxiao Zhang, et al. Nanovaccine’s rapid induction ofanti-tumor immunity signifcantly improves malignant cancer immunotherapy. NanoToday, 2020, 35, 100923.https://doi.org/10.1016/j.nantod.2020.100923