鄭南峰/傅鋼Nature Catalysis:跨越近180年,由單原子分散催化劑重新認識堿金屬助劑效應
阿Q
2020-07-14
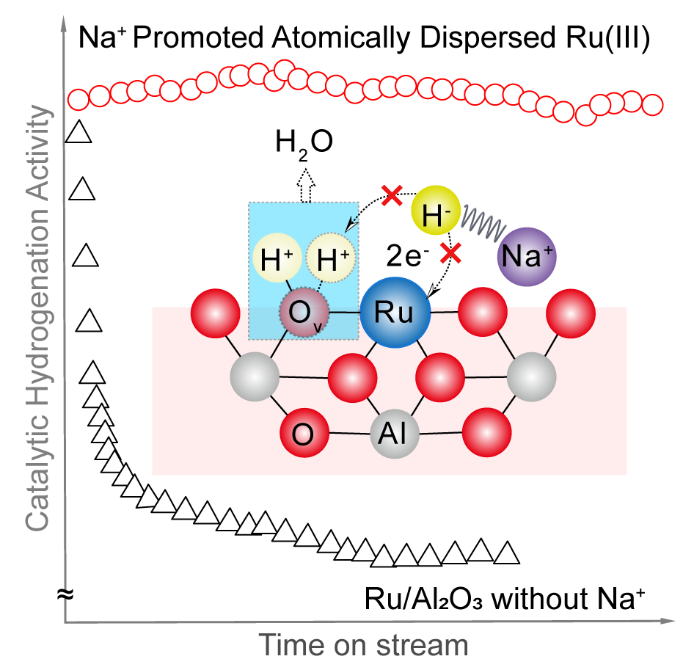
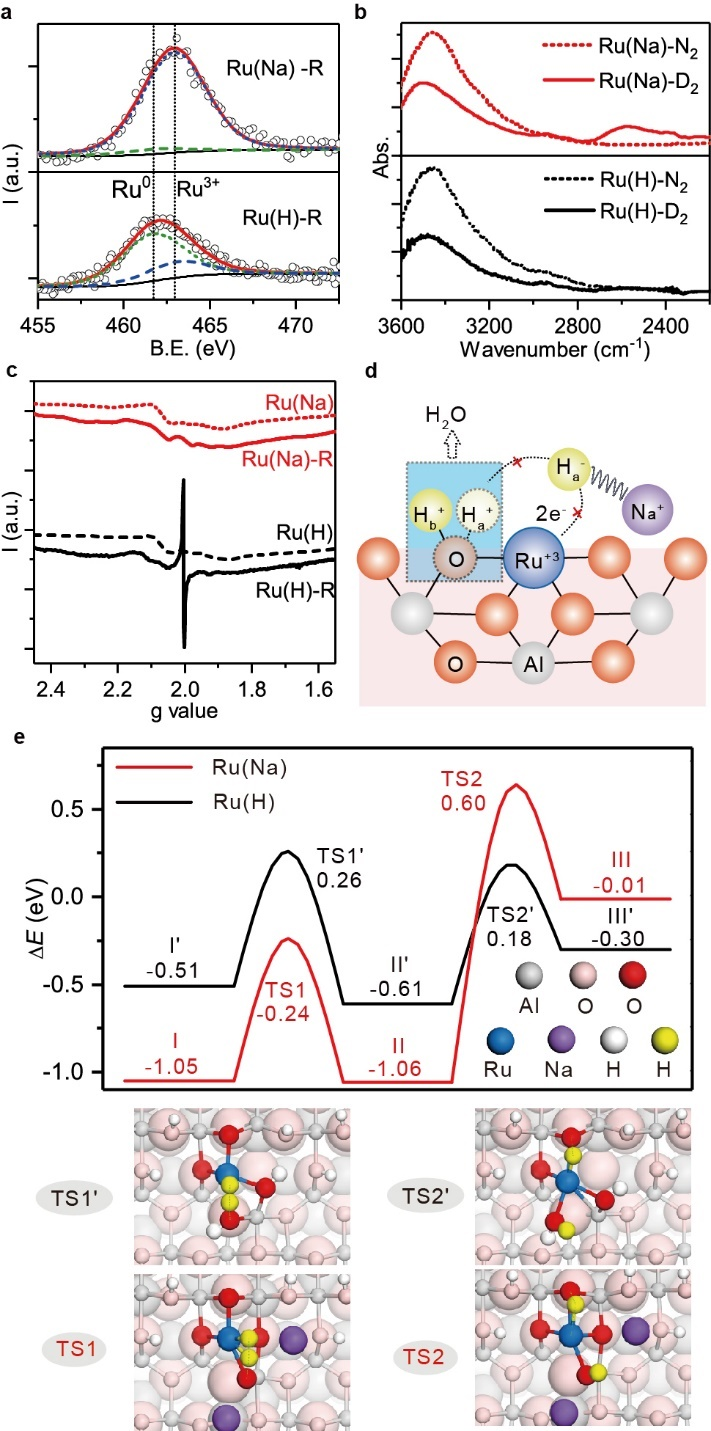
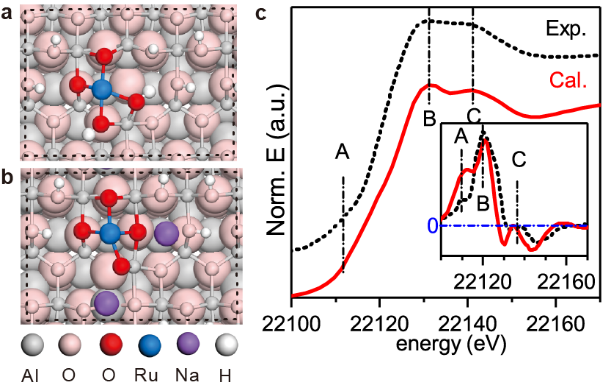
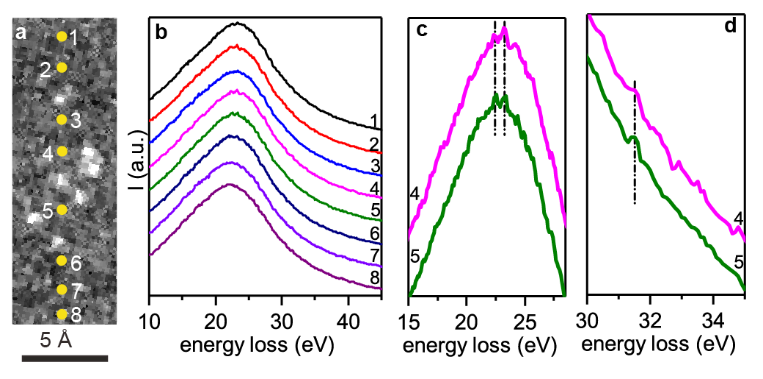
第一作者:Ruixuan Qin、Lingyun Zhou1. 構筑了結構明確的單原子分散Ru催化劑(有Na+和沒有Na+穩定的兩種催化劑)。2. 揭示了堿金屬離子提升金屬催化材料加氫性能的分子機制。多相催化加氫廣泛應用于藥物、染料、食品添加劑、香料等精細化學品的工業生產。氧化物負載的金屬納米粒子是多相催化加氫的一類重要催化劑。為了確保金屬顆粒高度分散度和穩定性,金屬納米顆粒與氧化物載體之間往往需要形成較強的Md+-O2-鍵。在催化加氫過程中,分子H2可以在Md+-O2-界面異裂為氫化物(M-Hδ-)和質子(O-Hδ+)物種,或在零價、低價金屬位點上均裂形成兩個氫物種。然而,解離后的氫物種往往具有很高活性,除了參與底物加氫外,還可以將界面處帶正電荷的金屬物種還原為零價金屬,破壞金屬-氧化物界面間的化學作用,并直接導致催化金屬物種團聚,催化性能下降。這一問題對于單原子分散金屬催化劑可能會更為嚴重,因為這時金屬物種多以帶部分正電荷的陽離子形式分散在載體上,在加氫反應(特別是高溫高壓下的反應)中非常容易被還原聚集形成金屬納米顆粒。因此,如何獲得穩定高效的高分散金屬催化劑仍然是多相加氫催化領域的一個重要挑戰。自1845年首次報道以來,堿金屬在多相催化領域已成為“萬能”助劑,用于改性金屬催化劑,以提升系列重要催化反應(例如氧化、脫氫、加氫、費托、三效催化、合成氣轉化、電解水等)的性能。長期以來,堿金屬的電子助劑機制一直存在爭議。一種觀點認為堿金屬作為電子供體,通過與催化活性金屬組分間的電子轉移作用,改變反應物和中間體在表面的吸附和反應行為,從而提升催化性能。但是催化反應中使用的堿添加劑多以堿金屬離子而非金屬態的堿金屬的形式存在,使得電子效應在其中的作用機制變得含糊不清。另一種流行的觀點是堿金屬離子通過其周圍的氧原子與活性金屬位點間接相互作用。這種相互作用有助于穩定小金屬納米顆粒甚至原子級分散的金屬位點,防止它們在加氫反應條件下還原聚集。有鑒于此,廈門大學鄭南峰教授、傅鋼教授及其合作者以選擇性催化加氫為目標反應、氧化物負載的金屬催化劑為催化劑體系,通過構筑結構明確的單原子分散金屬催化劑,揭示了堿金屬離子提升金屬催化材料加氫性能的分子機制。在合成Al2O3負載的單原子分散Ru催化劑(有Na+和沒有Na+穩定的兩種催化劑)的基礎上,實驗與理論計算緊密結合,研究團隊證明了位于Al2O3負載的單原子Ru催化中心附近的Na+離子在提升催化加氫性能中扮演著兩種重要角色:(1)有效地制止催化金屬Ru(III)中心上Hδ-物種向附近氧物種轉移,防止單原子分散Ru(III)的還原團聚;(2)通過穩定帶負電的加氫反應中間體和過渡態,促進單原子Ru(III)的催化加氫活性。系統研究表明,堿金屬離子促進的Ru1/Al2O3催化劑對多種惰性芳香族底物的氫化具有很高的活性和穩定性,并存在獨特的H/D反同位素效應。作者采用沉積-沉淀法,以RuCl3為前驅體,γ-Al2O3為載體,分別使用NH3·H2O和NaOH作為沉淀劑制備得到了含有Na+與不含Na+的Ru/Al2O3催化劑,Ru(Na)和Ru(H)。在150℃,3 MPa H2條件下,以丙酮加氫為模型反應進行催化性能評價。如圖1a所示,Ru(Na)和Ru(H)初始催化活性接近,但是Ru(H)隨著反應時間延長活性逐漸降低,而Ru(Na)則在32小時內始終保持較高的催化活性。為研究催化劑穩定性的表現是否與結構相關,作者對反應前后的催化劑進行了同步輻射X射線吸收譜表征,其中反應前的兩種催化劑中的Ru都呈單原子分散。對于反應后的催化劑,如圖1b所示,雖然傅里葉變換R空間圖中Ru(Na)和Ru(H)在1-2 ?(未矯正鍵長)的信號非常接近,但是在2-3 ?區域信號有明顯區別。進一步通過小波分析可以看出(圖1c,d),反應后的Ru(Na)第二殼層對應的信號為Na或者Al,即存在Ru-O-Na/Al結構,說明Ru(Na)催化劑反應后為仍主要以單原子形式分散。而Ru(H)反應后有明顯的Ru-Ru散射信號,即不含堿金屬離子的催化劑容易在加氫條件下發生團聚。為進一步驗證XAS分析結果,作者進一步開展了原位CO漫反射紅外(CO-DRIFTS)表征。結果發現還原處理后的Ru(Na)表面主要包括頂位吸附和多羰基形式的CO信號(~2065, 2105 cm-1),而還原后的Ru(H)表面則同時出現了頂位和橋位吸附形式的CO(~2055, 1990 cm-1)。說明還原處理后Ru(Na)中的Ru依然是高分散形式,而Ru(H)中的Ru則發生還原團聚。HAADF-STEM證實(圖1e),反應后的Ru(Na)催化劑中的Ru主要是以單原子形式分布的,且原子分辨的EELS譜則表明,Ru周圍存在Na+(圖2)。
因為單原子分散度Ru在Al2O3表明主要以Ru-O配位形式存在,這意味著Na+的存在有利于穩定Ru/Al2O3中Ru的高價態。如圖3a所示,準原位XPS實驗表征發現,Ru(Na)中的Ru在150 ℃ H2還原后依然幾乎全部以Ru(III)形式存在,而同樣條件下的Ru(H)中的Ru則大部分被還原。原位H-D交換實驗表明(如圖3b所示),在200℃ D2處理后Ru(Na)表面出現了顯著的-ODx信號(~2300-2800 cm-1),而Ru(H)表面則幾乎沒有-ODx信號。該結果說明D2在Ru(Na)表面可以通過異裂形式活化,或者活化后與表面-OHx物種發生交換;而Ru(H)表面D2活化后不容易與周圍-OHx交換或者交換后形成的-ODx物種在高溫下容易脫水消除。
為了驗證-ODx物種的穩定性作者進一步對還原反應后的催化劑進行了EPR表征,從圖3c可以看到,Ru(Na)反應前后主要信號都為Ru(III),而Ru(H)反應后則在g=2.002處出現了F+心(F center)特征信號,即氧空穴處容納有未成對電子。熱重測試同樣表明,在H2或者N2氣氛下Ru(H)表面失水都比Ru(Na)嚴重。因此,結合以上實驗結果可以證實Na+的存在可以抑制Al2O3表面原子分散的Ru(III)被還原,進而抑制了Ru的聚集。
圖3. Na+在穩固氫化物和穩定原子分散的Ru(III)中的關鍵作用
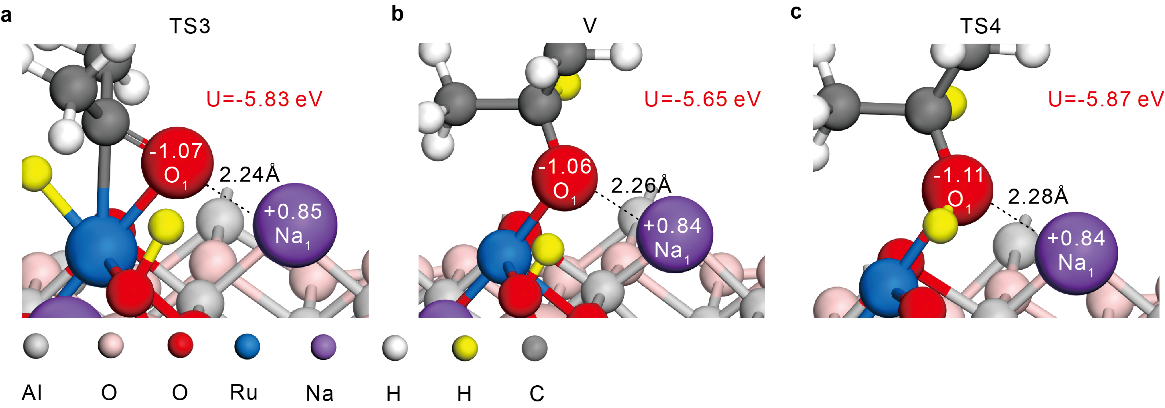
密度泛函理論(DFT)計算進一步揭示了Na+對于單原子Ru(III)的穩定作用機制。如圖4所示,作者根據實驗表征結果細致構建了Ru(Na)和Ru(H)單原子模型,并考察了H2在兩種模型上的解離和進一步還原Ru的過程。計算表明, H2異裂為氫化物(M-Hδ-)和質子(O-Hδ+)物種在這兩種單原子模型催化劑上反應能壘相近(0.81 vs. 0.77 eV)。二者的差異實際上在Hδ-物種向晶格氧轉移同時將Ru(III)還原為Ru(I)這一步(圖3d)。如圖3e所示,Ru(H)中Ru的還原能壘和熱力學吸熱分別為0.79 eV和0.31 eV,而在Ru(Na)上的相應能壘和吸熱分別為1.66 eV和1.05 eV。該結果說明單原子Ru(III)周圍Na+的存在不會抑制H2的活化,但可以穩定Ru(III)-O2-界面防止其被還原破壞。
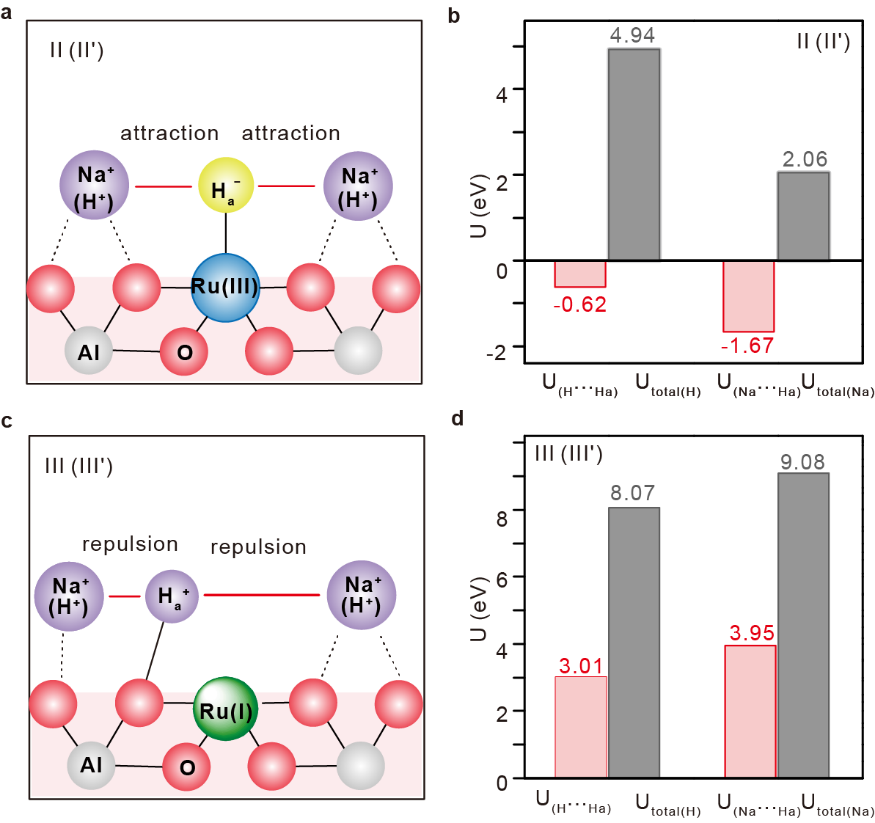
為了進一步理解Na+穩定Ru(III)的深層原因,作者應用靜電相互作用模型進行了分析。如圖5所示,由于Na的電負性小于H(0.93 vs 2.20),所以離子形式的Na+具有比H+更大的Bader 電荷。對于異裂后的狀態,Na+可以與Ru(III)-Hδ-中的Hδ-產生更強的靜電吸引作用(圖5a,b),而對于Hδ-遷移還原Ru后形成的H+,則具有更強的靜電排斥作用(圖5c,d)。因此,Na+穩定實質是可以有效穩定Ru(III)-Hδ-物種。
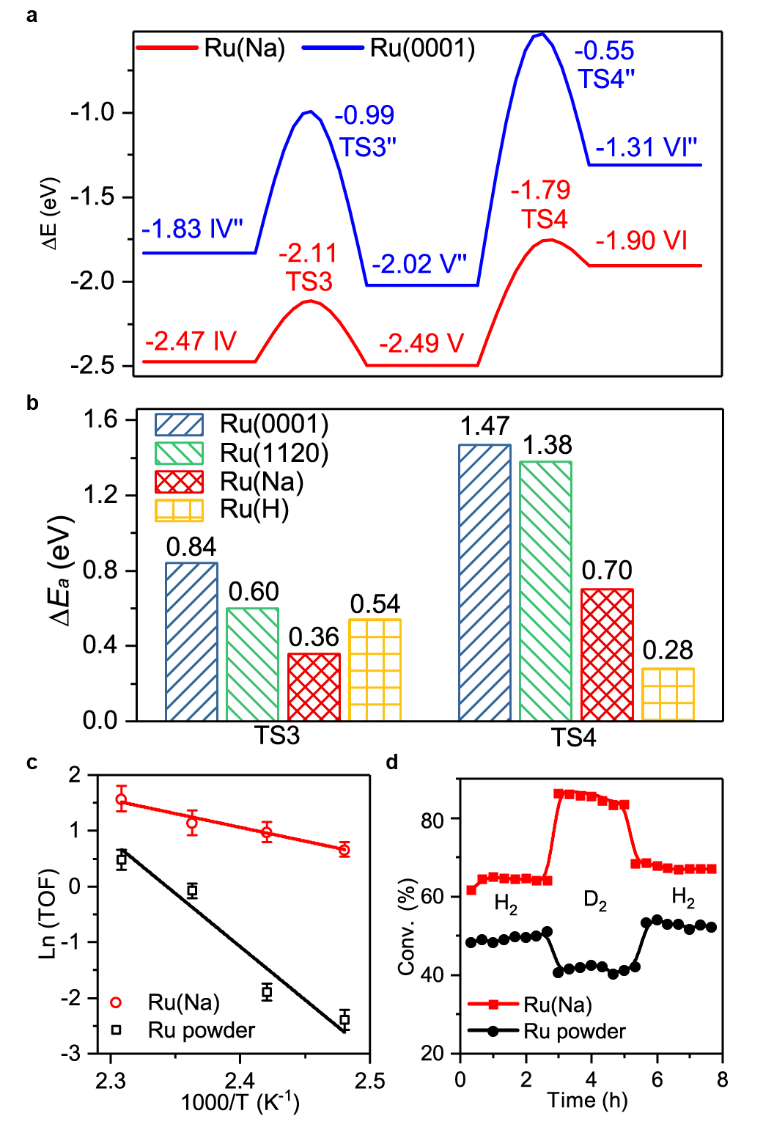
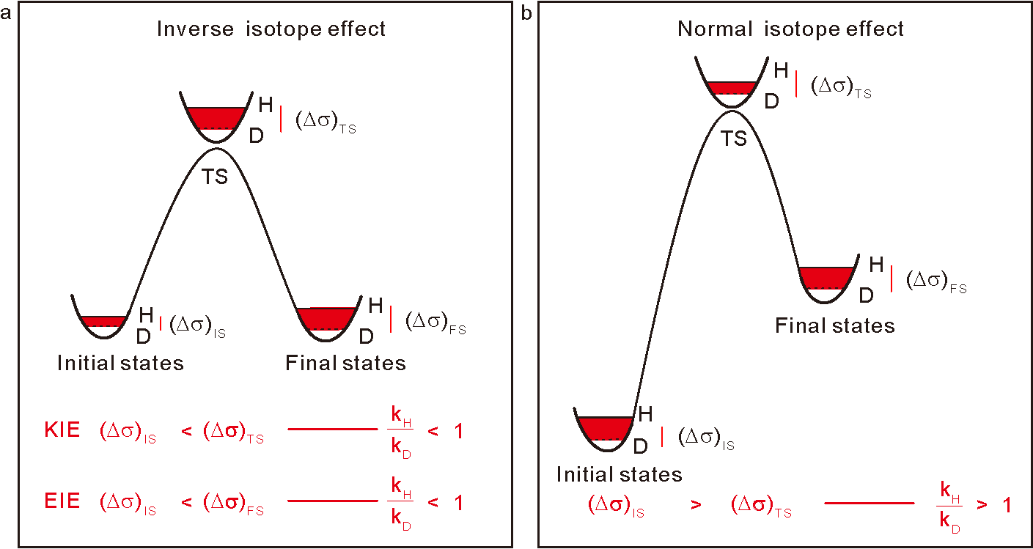
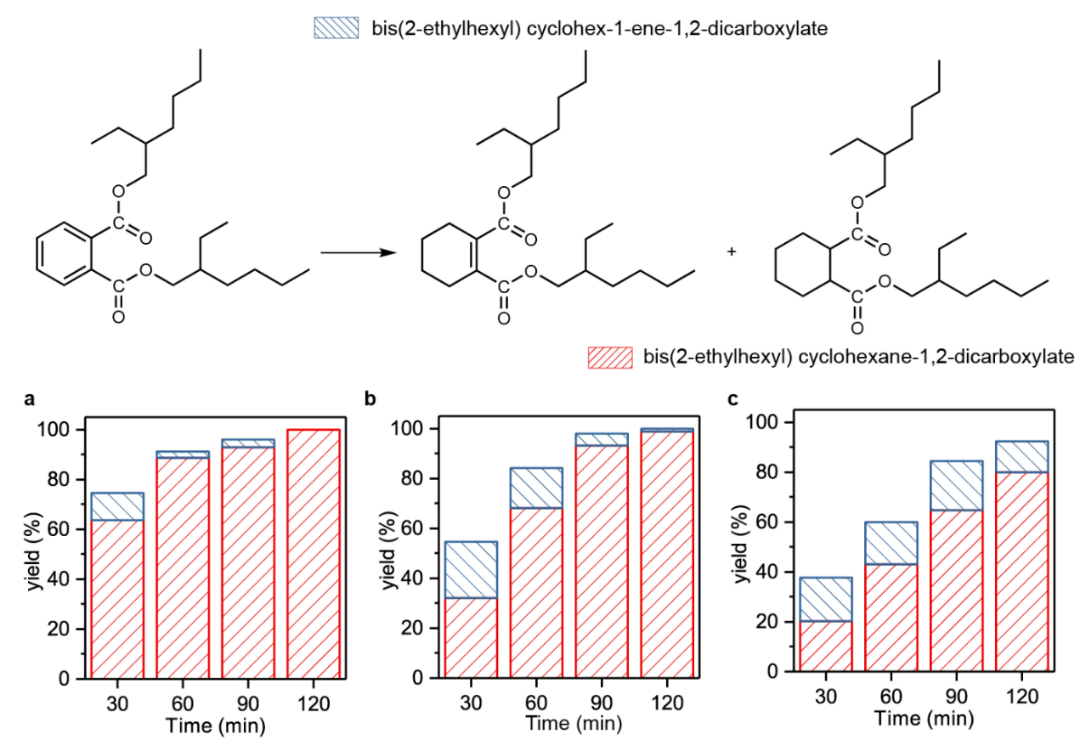
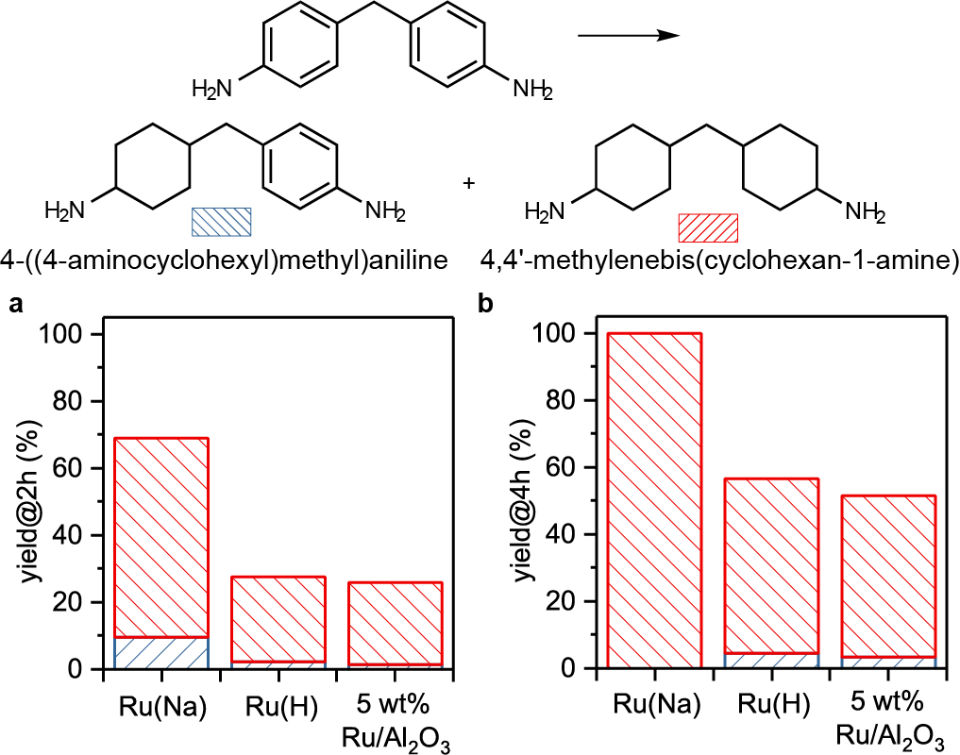
為了進一步證明單原子分散形式的Ru-O界面相對于還原后的Ru納米顆粒或者簇合物更有利于C=O的催化加氫,作者進一步計算了Ru(Na),Ru(H), Ru(0001)以及Ru(1120)表面丙酮加氫分步反應能壘。如圖6a,b所示,Ru(0001)和Ru(1120)表面反應能壘遠高于Ru(Na)和Ru(H)表面的兩步加氫反應能壘。為了驗證這一計算結果作者進一步測試了Ru(Na)和金屬Ru粉催化丙酮加氫的表觀活化能,如圖6c所示,單原子分散的Ru的加氫活化能遠低于金屬Ru 粉。作者認為單原子分散的Ru(III)物種之所以比金屬Ru粉具有更高的催化加氫活性,一方面是因為活化后的H物種在Ru(III)位點具有比金屬Ru表面更低結合能從而有利于H的轉移;另一方面,在單原子分散的Ru-O界面處異裂形成的Ru(III)-Hδ-和O-Hδ+物種與極性C=O鍵之間的離子共振同樣可以促進加氫過程。計算發現,丙酮在Ru(Na)和Ru(H)表面加氫的能壘低于H2的異裂能壘,說明丙酮加氫反應的決速步為H2解離。為了驗證這一結果,作者進一步測試了金屬Ru粉和Ru(Na)催化丙酮加氫的H/D同位素效應。如圖6d所示,Ru粉表現出典型的二級動力學同位素效應,而Ru(Na)則具有反同位素效應。同位素效應一般包括熱力學平衡同位素效應equilibrium isotopic effect和動力學同位素效應kineticisotopic effect,如圖7所示,從簡化后的同位素模型(僅考慮決速步)可以發現,對于H/D取代零點能差(ΔZPE),當終態值(ΔZPE)FS大于初始態(ΔZPE)IS時則表現出熱力學平衡反同位素效應(inverse equilibrium isotope effect (iEIE));當終態(ΔZPE)FS大于過渡態(ΔZPE)TS時則表現出動力學反同位素效應(inverse kinetic isotopiceffect (iKIE)),反之則表現出正同位素效應。對于本例中Ru(Na)中的以H2解離作為決速步的反應過程,作者將計算模型中的H替換為D,同時分析兩種取代形式的相關振動能級差((Δσ)H-D),結果證明對于Ru(Na)反應同時具有熱力學反同位素效應(iEIE)和動力學反同位素效應(iKIE)。產生反同位素效應的主要原因是由于H2異裂的始態零點能主要貢獻為H-H振動,過渡態/終態涉及的Ru-H和O-H振動則波數相對較小,H/D取代零點能差較低。上述結果中,由于Ru(Na)和Ru(H)催化丙酮加氫反應決速步均為H2解離,且二者決速步能壘相當,因而Ru(Na)和Ru(H)表現出相當的初始催化活性,這點可以從圖1a催化實驗結果得到證實,也就是說Na+離子的存在并沒有影響催化加氫的活性,只是通過影響活性物種的穩定性間接影響表觀催化活性。但是由圖6b可以發現,丙酮加氫兩步氫物種轉移的能壘相對大小卻與Na+的存在與否密切相關。在Ru(Na)表面第一步Hδ-的轉移能壘更低,Hδ+的轉移相對困難(0.36 eV vs 0.70 eV);而Ru(H)表面第一步相對較難,第二步相對容易(0.54 eV vs 0.28 eV)。這一結果說明Na+與表面加氫反應物種同樣存在一定相互作用,從而影響了反應勢能。如圖8所示,Na+可以與Hδ-轉移后形成的負電中間體產生靜電相互作用,那么對于一些較難發生加氫過程的底物分子,堿金屬離子與加氫反應中間體之間的相互作用則可能直接促進催化加氫活性。確實,對于草酸二甲酯(DMO)加氫反應,計算表明Ru(Na)表面反應有效能壘比Ru(H)表面催化過程降低了0.1 eV(1.00 eV vs 1.10 eV),實驗上同樣也發現Ru(Na)催化劑的初始活性高于Ru(H)的初始催化活性。此外,Ru(Na)在該反應中仍然具有較高的催化穩定性,而Ru(H)則在反應過程中則快速失活。圖8. 催化加氫過程中底物表面Na+和O的相互作用原理圖根據以上研究結果,作者進一步將堿金屬離子促進的單原子Ru催化劑應用于其他復雜、具有工業應用價值的底物分子加氫過程。如下表及附圖所示,Na+穩定的單原子Ru催化劑在苯酚、愈創木酚、di(2-ethylhexyl)phthalate(DEHP)、4,4'-methylenedianiline(MDA)甚至雜環分子吡啶加氫反應中都表現出優越的催化性能。表1. Ru(Na)、Ru(H)和商業Ru/Al2O3催化劑活性的比較 | | |
| | |
| | | | |
| | | |
| | | | |
| di(2-ethylhexyl)phthalate | | | | |
| | | | |
| | | | |
以上研究結果表明堿金屬陽離子可以通過靜電相互作用穩定金屬位點上解離生成的Hδ-物種,有效抑制單原子高分散的Ru(III)的還原團聚。需要指出的是,在復雜體系中,堿金屬對催化活性的促進作用有可能是結構效應(如還原團聚)的衍生結果,不能簡單地采用電子效應來解釋催化性能。Ruixuan Qin, Lingyun Zhou, Pengxin Liu, Yue Gong, Kunlong Liu, Chaofa Xu,Yun Zhao, Lin Gu, Gang Fu*, Nanfeng Zheng*. AlkaliIons Secure Hydrides for Catalytic Hydrogenation. Nature Catalysis DOI:10.1038/s41929-020-0481-6https://www.nature.com/articles/s41929-020-0481-6
加載更多

3536

版權聲明:
1) 本文僅代表原作者觀點,不代表本平臺立場,請批判性閱讀!
2) 本文內容若存在版權問題,請聯系我們及時處理。
3) 除特別說明,本文版權歸納米人工作室所有,翻版必究!