2020年7月3日,Science Advances發表了浙江大學彭麗華副教授、高建青教授等人題為“Engineering bacterial outermembrane vesicles as transdermal nanoplatforms for photo-TRAIL–programmed therapy against melanoma”的研究論文,該研究為手術、光療聯合藥物干預的腫瘤程序性治療提供了一種高效、安全、普適的納米遞送平臺。該論文浙江大學彭麗華副教授為第一及通訊作者,高建青教授與南京大學寧興海教授為共同通訊作者。研究得到國家重點研發計劃、國家自然科學基金的資助。
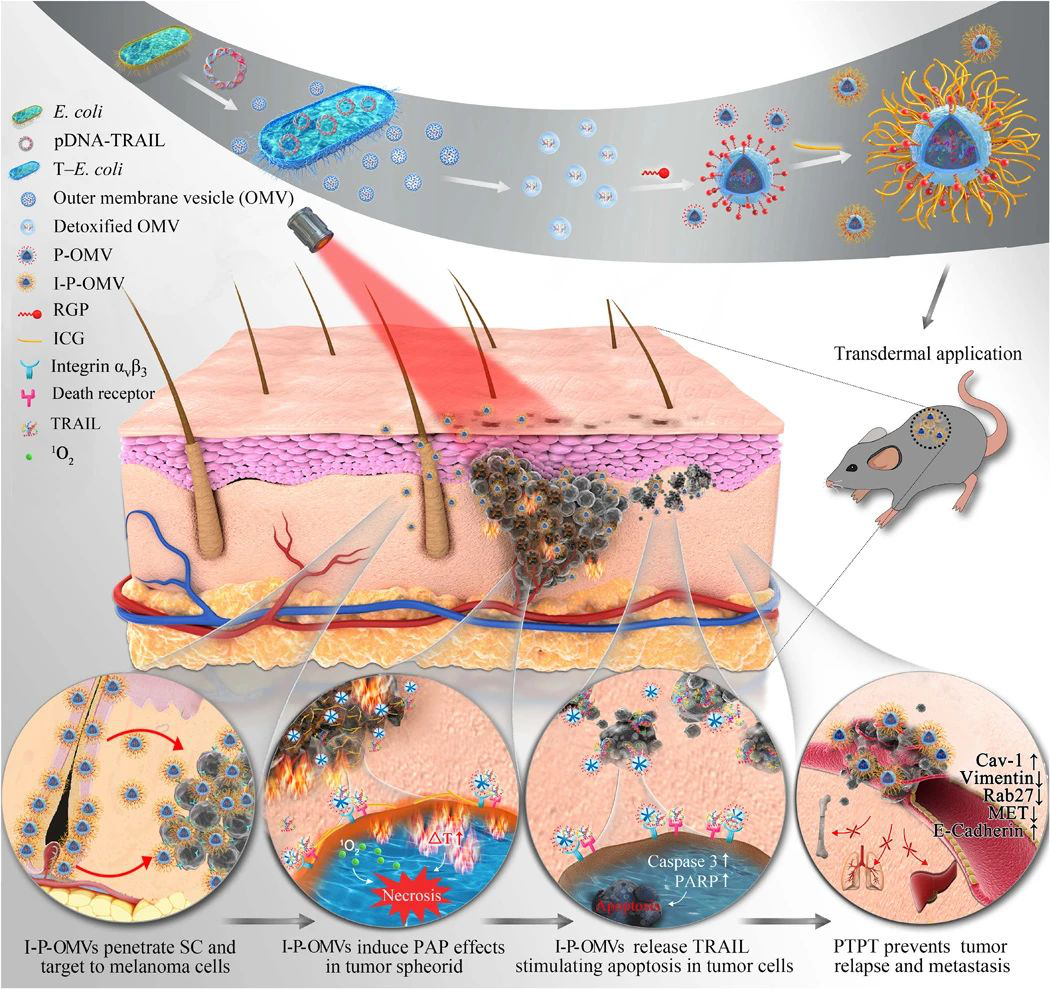
皮膚黑色素瘤是一種位于表皮基底層與真皮層、進展快、轉移迅速的惡性腫瘤。臨床常采用手術切除及光熱治療來清除腫瘤實體,但病灶深部殘留及彌散性分布的黑色素瘤細胞易導致術后腫瘤快速復發及轉移。研究人員利用轉基因工程菌制備納米囊泡并脫毒,采用自主合成篩選的黑色素瘤細胞靶向肽與光敏劑共同修飾囊泡,首次構建了一種自帶活性蛋白,且兼具透皮、靶向功能,能同時提供光熱干預、控制釋放活性蛋白的多功能納米制劑(I-P-OMVs)。P-OMVs具有顯著的光熱效應,并能在近紅外光刺激下快速釋放單線態氧與目標蛋白,對鼠源和人源黑色素瘤細胞均表現出顯著的抑制增殖、遷移,加速凋亡的作用。采用分子測序及驗證結果表明I-P-OMVs+NIR對黑素瘤細胞調控凋亡和轉移的分子網絡具有綜合的多向調節作用,顯著提升了黑色素瘤細胞對TRAIL蛋白的敏感性,顯著增強了TRAIL蛋白對耐受腫瘤細胞的干預效果。

I-P-OMVs能通過納米尺寸效應與皮膚的融合作用高效穿透皮膚角質層,并進一步精確識別黑色素瘤細胞,高度富集于腫瘤部位,在近紅外刺激下,通過光熱效應清除腫瘤實體,并響應釋放活性蛋白,誘發殘存的腫瘤細胞凋亡,實現光熱-蛋白程序性干預,經I-P-OMVs+NIR治療后,第二天腫瘤幾乎完全消失,腫瘤組織內部凋亡顯著。隨著時間延長,各治療組出現不同程度的腫瘤復發,但I-P-OMVs+NIR 組復發率最低,在觀察期內沒有鑒定出明顯的黑色素瘤細胞,大大增強了抗腫瘤效果,與此同時,腫瘤組織的轉移性得到顯著得抑制,為人體淺表腫瘤的治療提供了全新策略。該策略在多種皮膚科疾病治療中亦具有廣闊的應用前景。

作者簡介:浙江大學彭麗華副教授致力于生物材料結合納米技術構建新型經皮與局部智能遞藥系統,用于抗腫瘤、基于干細胞誘導的神經、皮膚再生的特色研究,取得了系列創新性成果,以第一或通訊作者在Science Advances、Advanced Functional Materials、Journal of Controlled Release、Biomaterials等知名雜志發表SCI論文40余篇,受到國內外同行廣泛的正面引用,以第一發明人授權國家發明專利8項,相關技術及成果在藥劑學、組織工程學、再生醫學等領域具有廣闊的應用前景。擔任國際控釋協會仿生制劑專委會委員、世中聯經皮給藥專委會副秘書長、基因治療SCI核心期刊Current Gene Therapy 客座主編、《中草藥》(中英雙刊)與《中國現代應用藥學》青年編委,2019 Elsevier雜志社優秀審稿人。Li-Hua Peng,Mao-Ze Wang, et al. Engineering bacterial outer membrane vesicles astransdermal nanoplatforms for photo-TRAILprogrammed therapy against melanoma. Science Advances (2020). DOI: 10.1126/sciadv.aba2735






