腫瘤放射治療(RT)是利用放射線治療腫瘤的一種局部治療方法。放射線包括放射性同位素產生的α、β、γ射線和各類x射線治療機或加速器產生的x射線、電子線、質子束及其他粒子束等。大約70%的癌癥患者在治療癌癥的過程中需要用放射治療,約有40%的癌癥可以用放療根治。放射治療是惡性腫瘤治療中最常用的方法之一,臨床上常與放射增敏劑聯合應用以提高治療效果。以下為奇物論編輯部針對近期最新發表在頂刊上的關于光熱致敏放療的研究和綜述論文進行整理,供大家學習和交流!1. Adv. Drug. Deli. Rev:熱療可以改變腫瘤生理以提高化療和放療的療效
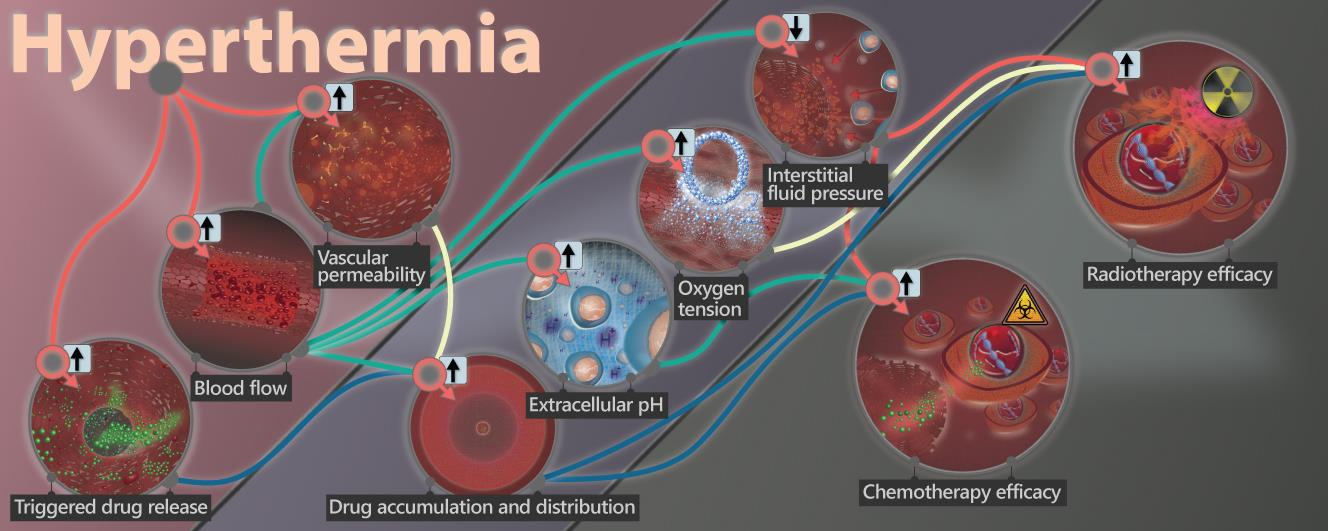
多倫多大學Michael Dunne對利用熱療改變腫瘤生理狀況以提高化療和放療的效果的相關研究進展進行了綜述介紹。(1)熱療已被證明在可以臨床上成功地提高化療和放療對實體腫瘤的療效。臨床前和臨床研究表明,靶向熱療能夠以依賴于溫度和時間的方式增加腫瘤內的血流灌注,而腫瘤內血液循環的改變可引起明顯的生理變化,包括血管通透性增強、乏氧改善、組織間液壓降低、生理pH值恢復正常等。(2)腫瘤內發生的這是生理上的變化可以積極地影響小分子和納米化療藥物在腫瘤內的積累和分布,同時也能夠提高對放療敏感的腫瘤比例。并且,熱療也可以觸發熱敏試劑的藥物釋放,從而進一步改善化療藥物的在瘤內的積累、分布和療效。Michael Dunne. et al. Hyperthermia can alter tumor physiology and improve chemo- and radio-therapy efficacy. Advanced Drug Delivery Reviews. 2020https://www.sciencedirect.com/science/article/pii/S0169409X203008312. Biomaterials:輻射前后輕度熱療可使放射治療更加敏感

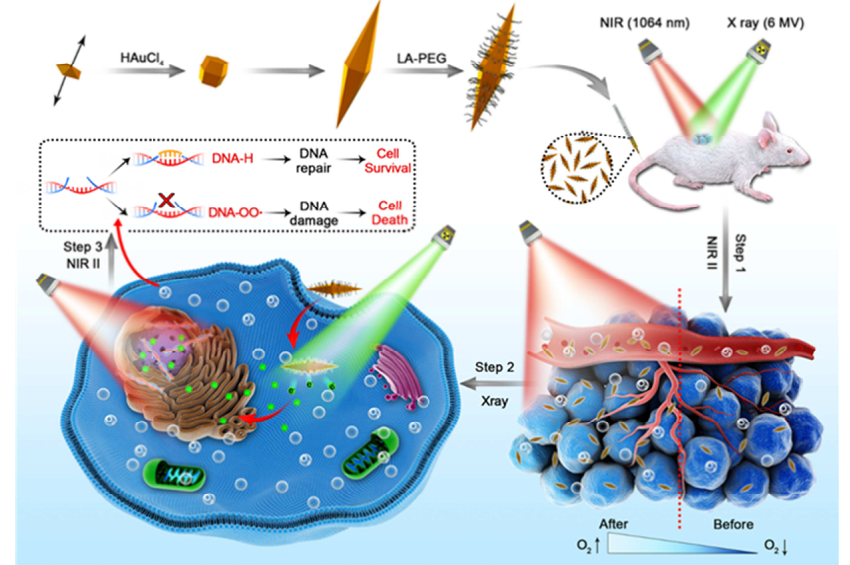
低氧誘導的放射抵抗、DNA損傷不足和多種DNA修復機制嚴重阻礙了腫瘤放射治療的臨床應用。在此,中國科學技術大學王育才、中山大學姚燕丹等人展示了一種雙熱療策略,通過減輕腫瘤缺氧和防止輻射誘導的DNA損傷修復來加強放射治療。1)以聚乙二醇化納米雙錐(PNBys)為光換能器,近紅外激光能很好地控制腫瘤熱療溫度,且副作用極小。2)PNBys在NIR-II窗口具有窄的縱向局域表面等離子體共振峰,具有較高的消光系數(2.0×1011M-1 cm-1)和良好的光熱轉換效率(44.2%)。3)放療前PNBys誘導的輕度熱療(MHt)可以使血管擴張、血液灌注和缺氧緩解,從而增加腫瘤細胞對放射治療的敏感性。另一方面,放療后的MHt抑制輻射引起的DNA損傷的修復。4)在小鼠乳腺腫瘤EMT-6模型中,PNBys通過聯合放療前后的MHt發揮出層次性優越的抗腫瘤作用。因此,不同于單純的RT和MHt的結合,PNBys將MHT前后與RT的結合開辟了一條新的有前景的抗癌途徑。Quan Li, et al. Pre- and post-irradiation mild hyperthermia enabled by NIR-II for sensitizing radiotherapy, Biomaterials, 2020.https://doi.org/10.1016/j.biomaterials.2020.1202353. Biomaterials:ROS致敏放療與納米光療聯合治療徹底根除原位乳腺癌并抑制轉移

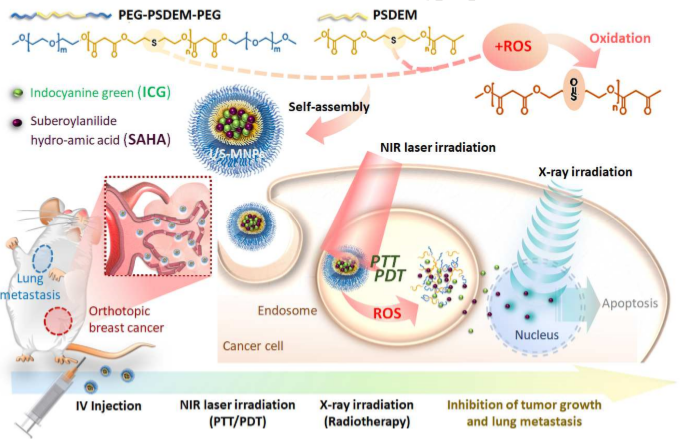
放射治療(RT)是惡性腫瘤治療中最常用的方法之一,臨床上常與放射增敏劑聯合應用以提高治療效果。為了開發一種利用局部組織對光介導反應的反應,及使用ROS誘導的RT敏化的多種治療方式相組合的智能治療策略,臺灣清華大學Hsin-Cheng Chiu等人開發了一種新的納米光療系統。1)此納米治療藥物由聚硫代丙二酸二乙酯(PSDEM)和PEG-PSDEM-PEG組裝而成,以琥珀酰苯胺異羥肟酸(SAHA)為RT敏化劑,吲哚菁綠(ICG)為光熱/光動力學劑,在近紅外線照射和X射線放射治療下表現出結構變化和釋放治療有效載荷的能力。2)隨著腫瘤部位發生了高度局部性和可控性的反應,活性氧(ROS)引發的SAHA卸載和熱療誘導的氧氣的血管通透性導致靶組織在RT中顯著增敏,進而與光動力/光熱療法(PDT/PTT)相結合,提高了治療效果。3)體外研究表明,用ROS誘導的致敏RT處理4T1乳腺癌細胞后,細胞內DNA雙鏈受到損傷,細胞增殖受到抑制。同時,由于光介導的治療與致敏的RT的聯合作用,與單獨使用RT的效果相比,細胞存活率也顯著降低。4)將PDT/PTT納米光療技術與ROS誘導的低劑量(6 Gy)致敏RT聯合應用,6只4T1乳腺癌小鼠中有5只小鼠的原發腫瘤被完全根除并抑制了肺轉移,60天內存活率高達83%。Te-I.Liu, et al. New combination treatment from ROS-Induced sensitized radiotherapy with nanophototherapeutics to fully eradicate orthotopic breast cancer and inhibit metastasis. Biomaterials, 2020.DOI: https://doi.org/10.1016/j.biomaterials.2020.120229https://doi.org/10.1016/j.biomaterials.2020.1202294. ACS Nano:刺激響應性納米放射增敏劑—增強腫瘤滲透性和放療敏感性

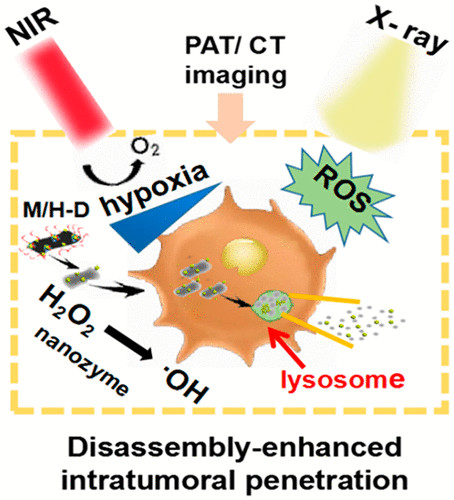
開發一種有效的納米放射增敏系統,在保留正常組織的同時,提高癌細胞的輻射劑量,使放射治療(RT)變得敏感,是一種非常理想的方法。在此,中國科學院高能物理研究所谷戰軍、尹文艷、首都師范大學王強等人構建了一種腫瘤微環境(TME)響應性可拆卸二硫化鉬/二氧化鉿(MoS2/HfO2) 葡聚糖(M/H-D)納米放射增敏劑。1)M/H-D可以降解并釋放TME中的HfO2納米粒子,以增強HfO2納米粒子在近紅外照射下對腫瘤的穿透能力,從而解決了HfO2納米粒子內化不足的瓶頸。2)近紅外光熱療法提高了TME中M/H-D納米輻射增敏劑的類過氧化物酶催化效率,其可以選擇性地催化腫瘤內過表達的H2O2使其轉化為高度氧化的羥基自由基(·OH)。因此,這種對TME敏感的精準納米放射增敏作用提高了輻射效率,有效增強了腫瘤的氧合作用,同時實現了腫瘤的有效抑制,此外,還可結合計算機斷層掃描和光聲成像進行實時監測。Wenhui Fu, et al. Stimuli-Responsive Small-on-Large Nanoradiosensitizer for Enhanced Tumor Penetration and Radiotherapy Sensitization. ACS Nano, 2020.DOI: 10.1021/acsnano.0c03094https://doi.org/10.1021/acsnano.0c03094