
?成功合成了射頻響應性雙價金納米簇多功能血管栓塞劑(dvGC@PNAs),用于實體瘤的綜合介入治療。
?具有高含量的Au(I)離子,其Au(I)離子包繞Au(0)的核殼型納米結構dvGC@PNAs表現出獨特的RF誘導的加熱效果。
?dvGC@PNAs極大地改善了TAE手術后的腫瘤缺氧免疫微環境,誘導了良好的免疫效應,增強了RFA和TAE的抗腫瘤協同作用。
血管栓塞術(TAE)在肝癌臨床治療上發揮著重要作用。然而由于肝癌血管系統的高度異質性,TAE對于肝癌乏血供區域治療效果不佳。射頻消融(RFA)對于乏血供腫瘤組織具有良好的治療效果,但在血流豐富的腫瘤區域,由于血流的散熱作用,RFA消融溫度迅速降到50 oC以下,導致“熱沉積”效率降低。TACE和RFA聯合應用可在一定程度上提高腫瘤組織的“熱沉積效應”,改善腫瘤的熱分布。然而,如何高效協同TAE與RFA的治療效果,在肝癌綜合介入治療中仍是一個巨大的挑戰。有鑒于此,華中科技大學國家納米工程中心楊祥良/趙彥兵課題組成功制備了具有射頻響應的多功能納米血管栓塞劑dvGC@PNAs,并與協和醫院鄭傳勝團隊合作,對其TAE-RFA聯合肝癌介入治療的療效及其協同機制進行了評價。

示意圖
1)成功制備了具有射頻響應的多功能納米血管栓塞劑dvGC@PNAs,并對其組成結構進行了表征。
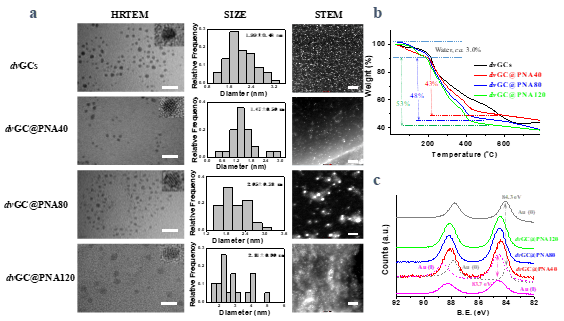
材料物化表征
2)通過溫敏溶膠-凝膠相變特性,dvGC@PNAs兼具超液化的導管通過性和“鑄型”性的逐級血管栓塞性,很好地解決了血管栓塞劑面臨的“流動-栓塞困境”。并通過射頻響應特性改善富血供腫瘤區域的熱沉積效率與分布,提高了TAE/TACE與RFA的協同抗腫瘤效果。
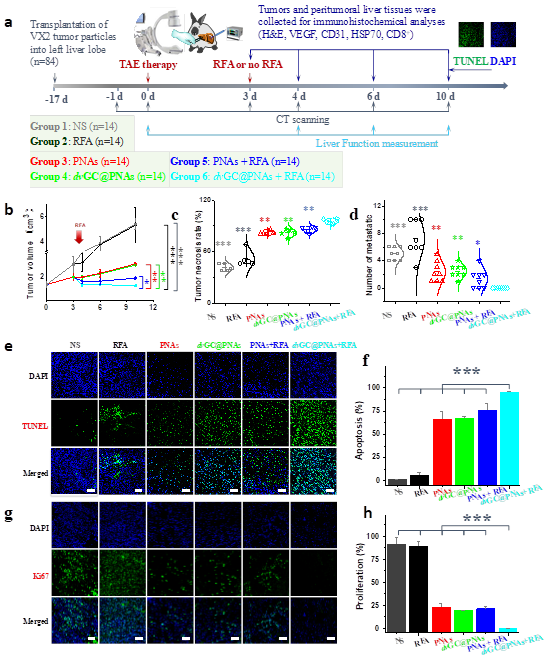
體內抗腫瘤
3)dvGC@PNAs可顯著改善栓塞術后的缺氧微環境,激發特異性腫瘤免疫反應,殺滅殘存肝癌細胞,有效地抑制了肝癌的復發與轉移。
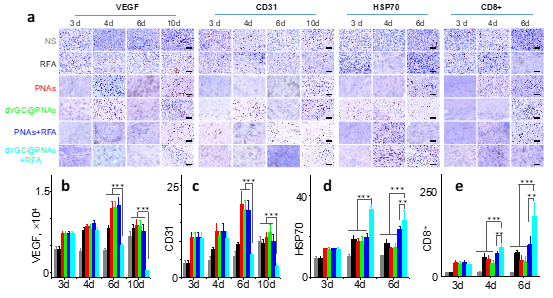
免疫組織化學評價
綜上所述,射頻響應的dvGC@PNAs血管栓塞劑兼具良好的流動性和栓塞性,并有效改善富血供腫瘤區域的熱沉積效率與分布,緩解栓塞術后缺氧程度,并激發特異性腫瘤免疫反應,從而高效協同TAE-RFA聯合抗腫瘤效果,為發展新型多功能血管栓塞材料提供了有益的思路和策略。Ling Li, Xiaopeng Guo, Xiaole Peng, HongsenZhang, Yiming Liu, Han Li, Xiaojun He, Dingwen Shi, Bin Xiong, YanbingZhao, Chuansheng Zheng, Xiangliang Yang, Nano Today, 2020.DOI:10.1016/j.nantod.2020.100934https://doi.org/10.1016/j.nantod.2020.100934










