1. 唐本忠/王東AM:全能的納米AIE!只用一個分子,即可實現所有的光診療方式!
光診療學近年來引起了人們的極大興趣,因為它允許在光照開始時進行實時診斷和同時進行原位治療,從而為癌癥研究開辟了一條新的途徑。為了構建光診療系統,人們不斷探索各種診斷成像和治療方法。有鑒于此,香港科技大學唐本忠院士和深圳大學王東等人報告了基于單個AIEgen的簡單且全能的光診療法。只需一個分子就實現了所有的光診療形式,包括熒光成像(FLI),光聲成像(PAI),光熱成像(PTI),光動力療法(PDT)和光熱療法(PTT)。
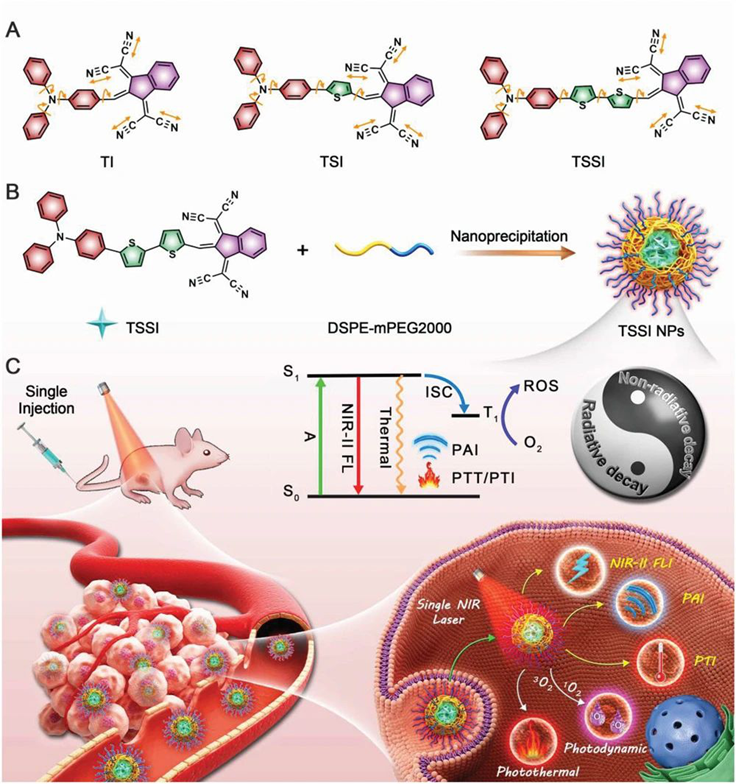
Zhang,Z., et al., An All‐Round Athlete on the Track of Phototheranostics:Subtly Regulating the Balance between Radiative and Nonradiative Decays forMultimodalImaging‐Guided Synergistic Therapy. Adv.Mater. 2020, 2003210.
https://doi.org/10.1002/adma.202003210
2. Science Advances:AIEgen偶聯的上轉換納米顆粒通過雙模式ROS激活根除實體瘤
活性氧(ROS)對于調節抗腫瘤免疫反應至關重要,在此反應中氧可誘導免疫原性細胞死亡,促進抗原呈遞并激活免疫細胞。有鑒于此,新加坡國立大學的劉斌、劉小鋼和中國醫學科學院北京協和醫學院的孔德領等研究人員,報告了近紅外(NIR)驅動的免疫刺激劑的發展,該過程基于上轉換納米顆粒與聚集體誘導的發光發光劑(AIEgens)的結合,以整合ROS的免疫學效應,從而增強適應性抗腫瘤免疫反應。
本文要點
1)瘤內注射的AIEgen上轉換納米顆粒在高功率NIR照射下產生高劑量ROS,從而誘導免疫原性細胞死亡和抗原釋放。
2)這些納米顆粒還可以捕獲釋放的抗原,并將其遞送至淋巴結。
3)在隨后的低功率NIR淋巴結治療后,會產生小劑量的ROS,以通過激活樹突狀細胞進一步觸發有效的T細胞免疫反應,從而防止局部腫瘤復發和遠處的腫瘤生長。
利用雙模泵浦光驅動AIEgen耦合的上轉換納米顆粒為腫瘤免疫治療提供了一個強有力的、可控的平臺來激活自適應免疫系統。
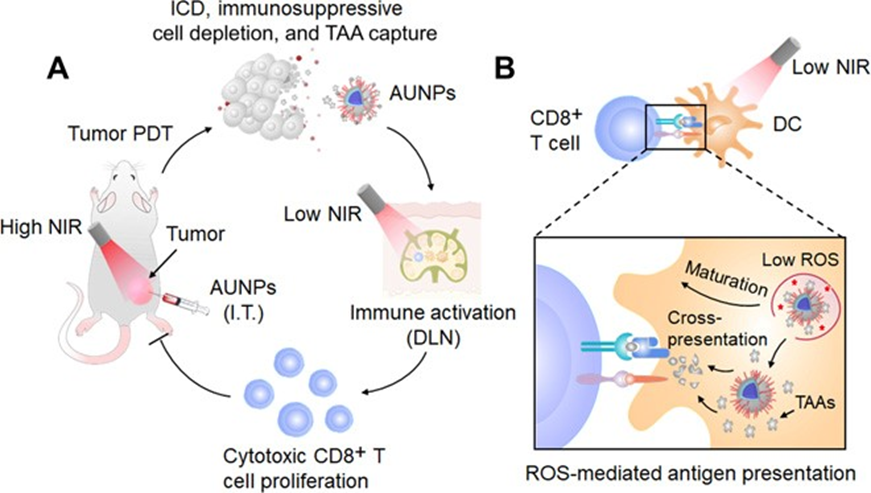
Duo Mao, et al. AIEgen-coupled upconversion nanoparticleseradicate solid tumors through dual-mode ROS activation. Science Advances,2020.
DOI:10.1126/sciadv.abb2712
https://advances.sciencemag.org/content/6/26/eabb2712
3. Nano Today:高度穩定和明亮的AIE點,可用于活體大鼠的NIR-II解讀
新興的第二近紅外(NIR-II)熒光成像技術為小鼠等小動物的活體成像顯示出了巨大的前景,但其向大鼠等大型動物的轉移仍有待發展。于此,香港科技大學唐本忠院士、浙江大學錢駿教授等人首次報道了基于聚集誘導發射(AIE)點對活體大鼠腦血管系統和主要器官的全面的NIR-II解讀。
本文要點:
1)AIE點同時具有高亮度、不同處理的穩定性和良好的生物相容性。由于發射范圍長、亮度高,AIE點超過1200 nm的體內NIR-II熒光顯微成像能夠可視化具有高空間分辨率(?4μm)和深穿透(700μm)的大鼠腦血管,代表了迄今為止在該領域實現的鼠腦成像的最高穿透深度和最佳分辨率。
2)NIR-II AIE點還可以在腦血栓形成早期實時檢測微小血管阻塞。此外,以高對比度的方式對大鼠胃腸道和膀胱進行活體無創監測,有助于更好地了解消化系統和排泄過程。這項工作將對發展先進的NIR-II技術在大型動物成像中的應用提供新的見解,為實際應用帶來廣闊前景。
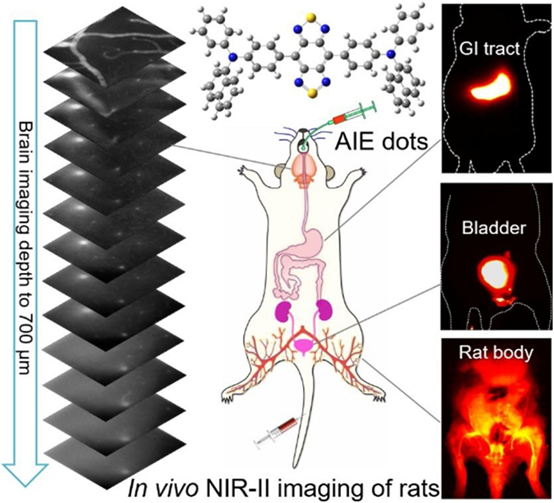
Ji Qi, et al., Highly stable and bright AIEdots for NIR-II deciphering of living rats. Nano Today 2020.
https://doi.org/10.1016/j.nantod.2020.100893
4. Angew:光誘導的自逃逸球形核酸用于實現高效的非陽離子基因遞送
開發非陽離子基因載體和實現功能核酸在胞漿內的有效內體/溶酶體逃逸是基因遞送領域所面臨的兩大挑戰。新加坡國立大學劉斌教授提出了一種自逃逸球形核酸(SNA)概念,其具有內體/溶酶體逃逸能力,可以實現光控的非陽離子基因遞送。
本文要點:
(1)在該體系中,實驗將Bcl-2反義寡核苷酸(OSAs)偶聯于聚集誘導發光(AIE)的光敏劑(PS)納米顆粒的表面以形成核-殼SNA。一旦SNA被腫瘤細胞吸收,在光照下,AIE PSs產生和累積的1O2會破壞溶酶體結構,從而實現OSA的逃逸。
(2)體外和體內實現結果表明,基于AIE的核-殼SNA可在不需要任何轉染試劑的情況下顯著下調抗凋亡蛋白(Bcl-2),進而誘導腫瘤細胞發生凋亡。

Leilei Shi. et al. Light Induced Self-Escapeof Spherical Nucleic Acid from Endo/Lysosomefor Efficient Non-Cationic Gene Delivery. AngewandteChemie International Edition. 2020
DOI: 10.1002/anie.202006890
https://onlinelibrary.wiley.com/doi/10.1002/anie.202006890
5. Materials Horizons:用于高時空分辨率癌細胞成像和化療的光活化二氫生物堿
全身給藥的化療藥物治療效果差,毒性大。相反,光活化癌癥治療可以實現圖像引導的精確控制治療劑量和位置。然而,傳統的光激活化學療法通常需要通過繁瑣的合成過程,在化療藥物上增加光反應基團,從而導致不良的毒副產物,嚴重制約了其應用。有鑒于此,華南理工大學的唐本忠、高蒙等研究人員,提出了一種新的基于光氧化脫氫反應的光活化癌癥治療策略,該策略僅與作為副產物的水結合。
本文要點
1)為了證明這一策略的有效性,研究人員利用天然二氫苯駢[c]菲啶類生物堿DHCHE和DHSAN作為光活化治療劑,通過在光照射下原位轉化成細胞核靶向的CHE和SAN來實現癌細胞的選擇性成像和殺傷。
2)值得注意的是,膽堿酯酶具有聚集誘導發射(AIE)特性,可用于精確控制光活化治療劑量。
這種基于光氧化脫氫反應的光活化策略有望在臨床上用于精確的癌癥治療。
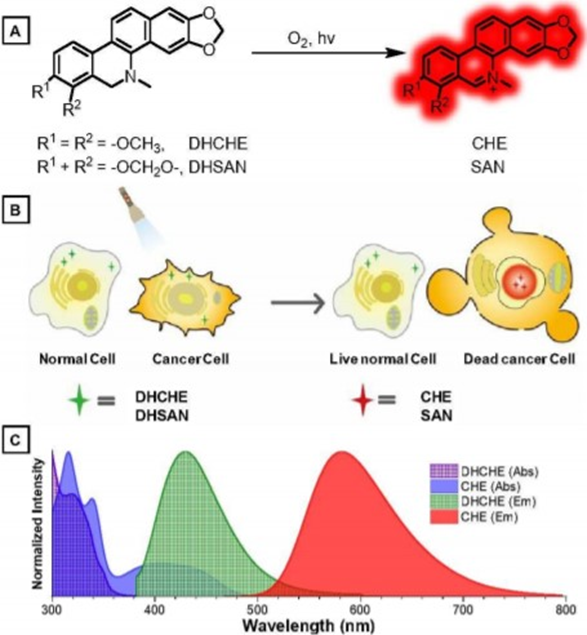
Xia Ling, et al. Photoactivatable dihydroalkaloids for cancer cellimaging and chemotherapy with high spatiotemporal resolution. MaterialsHorizons, 2020.
DOI:10.1039/d0mh00931h
https://pubs.rsc.org/en/content/articlelanding/2020/mh/d0mh00931h#!divAbstract
6. Chem. Sci:高亮度AIE點用于NIR-II熒光成像和NIR-I光聲成像
目前,在NIR-II區具有高光致發光量子產率(PLQYs)的AIE發光分子仍然十分有限,西安交通大學黨東峰老師、孟令杰教授和中科院深圳先進技術研究院張鵬飛提出了一種通過調節分子聚集來提高探針NIR-II熒光性能的有效策略。
本文要點:
(1)實驗合成的供體-受體AIE點(DTPA-TBZ)不僅在NIR-I區有良好的吸收率,而且在NIR-II區也有良好的熒光信號,其發射波長可延伸至1200 nm。得益于這種改進的分子內限制和聚集策略,DTPA-TBZ的絕對PLQY值可達8.98%。實驗同時也以IR 26作為參考,證明該AIE點可表現出高達11.1%的相對PLQY。
(2)最后,實驗將該AIE點應用于進行高性的能NIR-II熒光成像和NIR-I光聲(PA)成像,證明其可通過NIR-II成像實現對腹部血管、后肢血管和腦血管的高信號背景比的可視化成像,并能夠通過PA成像以清晰地觀察體內腫瘤。這些結果表明,通過調整DTPA-TBZ中的分子聚集,可以同時實現良好的NIR-II吸收和在NIR-II區的高發射熒光,因此可以作為一種雙模態成像平臺用于對癌癥進行精確診斷。
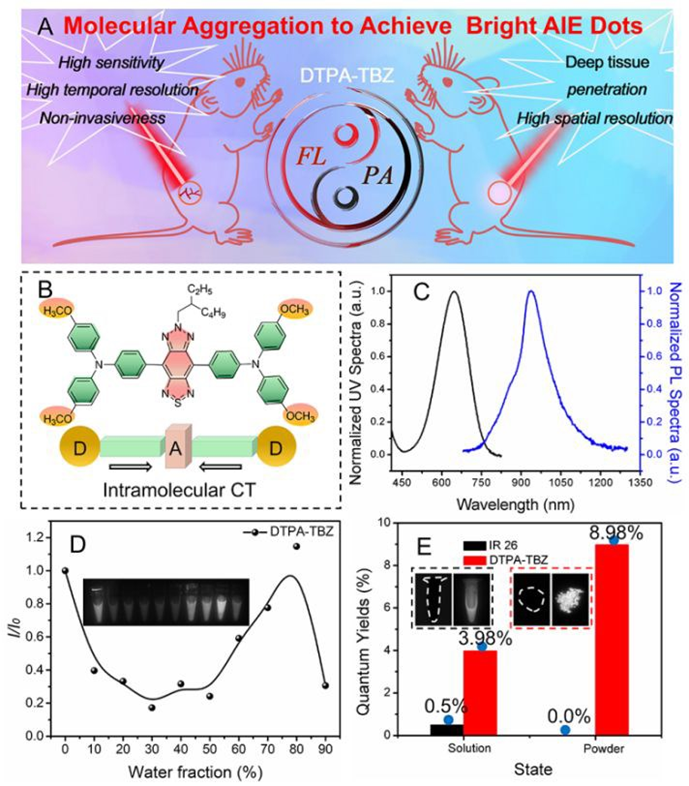
Yanzi Xu. et al. Tuning molecularaggregation to achieve highly bright AIE dots for NIR-II fluorescence imagingand NIR-I photoacoustic imaging. ChemicalScience. 2020
https://pubs.rsc.org/en/content/articlelanding/2020/sc/d0sc03160g#!divAbstract
7. Anal. Chem:可激活的納米探針通過MSOT和AIE近紅外熒光成像實現術前定位和術中導航
對腫瘤進行準確的定位和完整切除是保障手術成功的關鍵。因此,能夠在術前定位腫瘤位置和在術中確定腫瘤邊緣的方法是非常理想的。華南理工大學吳水珠教授和曾鈁教授開發了一種可被激活的納米復合探針,并將其用于術前多光譜光聲學斷層成像以定位原位肝腫瘤以及在術中通過近紅外熒光成像進行導航。
本文要點:
(1)該分子探針包括電子供體、受體和識別部分,可與牛血清白蛋白形成納米復合探針。該探針對腫瘤細胞中過表達的硝基還原酶有特異性響應進而被激活。被激活的探針具有AIE特性和很強的NIR-I/NIR-II熒光和光聲信號,可用于雙模成像。
(2)由于該探針可以對肝腫瘤細胞中的硝基還原酶進行原位反應,因此可以對早期的原位肝腫瘤進行檢測。此外,實驗也利用該納米復合探針獲得了術前肝臟原位腫瘤的三維MSOT圖像,以及NIR-I/NIR-II熒光圖像,從而為術中腫瘤切除提供了重要的指導。
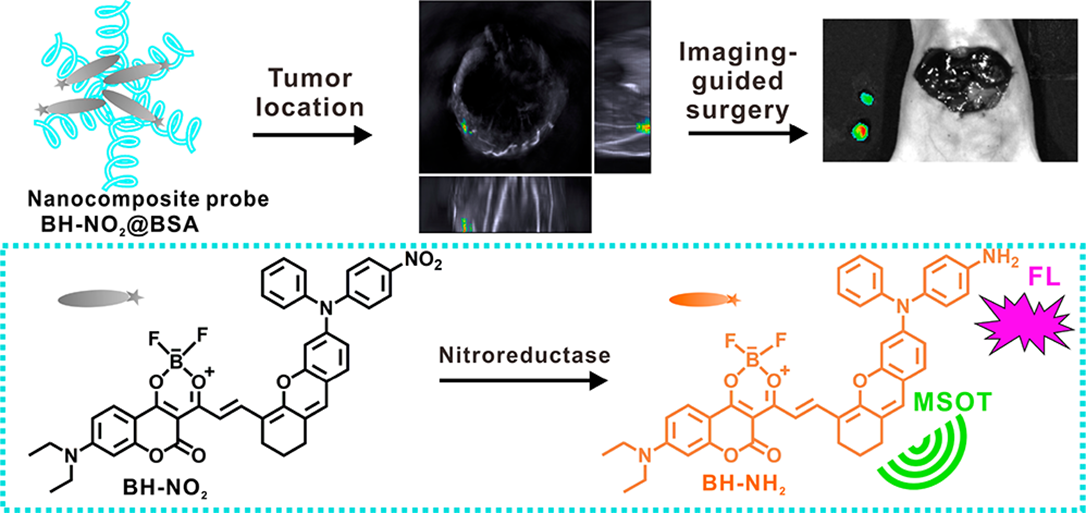
Zhuo Zeng. et al. Activatable NanocompositeProbe for Preoperative Location and Intraoperative Navigation for OrthotopicHepatic Tumor Resection via MSOT and Aggregation-Induced Near-IR-I/IIFluorescence Imaging. AnalyticalChemistry. 2020
DOI: 10.1021/acs.analchem.0c01596
https://pubs.acs.org/doi/10.1021/acs.analchem.0c01596


















