使用免疫檢查點調節劑的免疫療法徹底改變了腫瘤學領域,遠遠超出了某些患者的臨床療效。它對癌癥患者具有更全面的視野,從而在治療效果和毒性評估中產生了根本性的變化。巴黎薩克雷大學CarolineRobert近日在Nature Communications上發表評論文,闡述10年來免疫檢查點研究之路。

腫瘤免疫療法的復興之路
過去十年來,癌癥治療中最重要的成就無疑是引入靶向T細胞的免疫調節劑來阻斷免疫檢查點CTLA-4和PD1或PDL1。2011年,第一個阻斷免疫檢查點(CTLA4)的抗體ipilimumab被批準。隨后迅速開發出了針對PD1(pembrolizumab和nivolumab)和PDL1(atezolizumab和durvalumab)的單克隆抗體。抗PD1/PDL1抗體已成為某些處方最廣泛的抗癌療法。現在,以T細胞為靶標的免疫調節劑可以用作單一藥物,也可以與化學療法結合作為治療約50種癌癥的第一線或第二線治療方法。有超過3000項評估T細胞調節劑的有效臨床試驗,占所有腫瘤學試驗的約2/3。
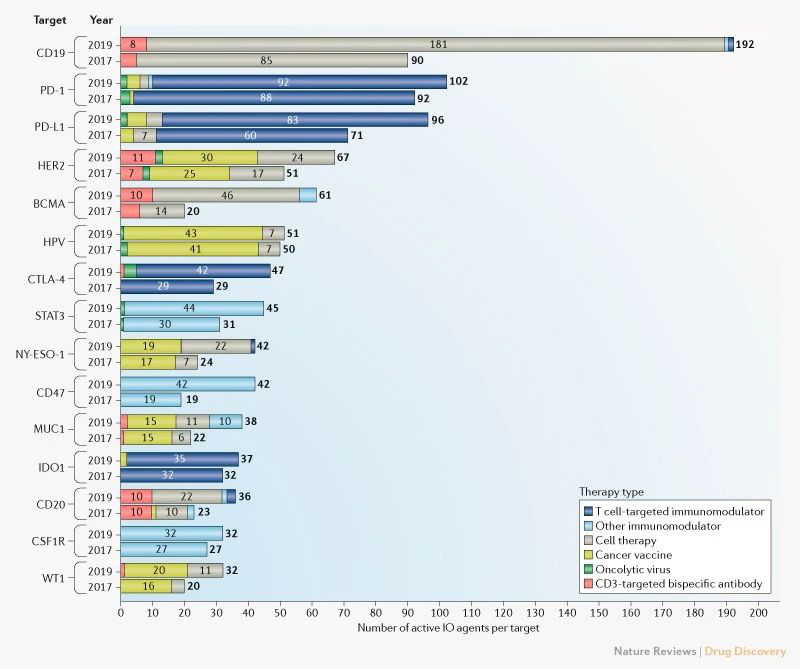
當前管線中的特定免疫腫瘤學靶點(Nature Reviews Drug Discovery)
然而,十年前,就在免疫檢查點抑制劑(ICI)時代來臨之前,實體腫瘤免疫療法處于嚴峻的形勢。那時候是基于免疫細胞因子,例如白細胞介素2或α-干擾素,它們的效果不佳且毒性很高。臨床研究試驗測試了多種形式的癌癥疫苗,這些疫苗大多無效。免疫療法在國際腫瘤學會議上的聽眾越來越少,而與新興的靶向治療領域有關的會議卻泛濫成災。然而,在ICI免疫療法取得首個成功之后,直到今天,情況發生了逆轉,免疫療法引領了這一領域,免疫學家重新獲得了對癌癥研究的重大影響,如2018年諾貝爾醫學獎授予ICI免疫療法先驅者James Allison和Tasuku Honjo。
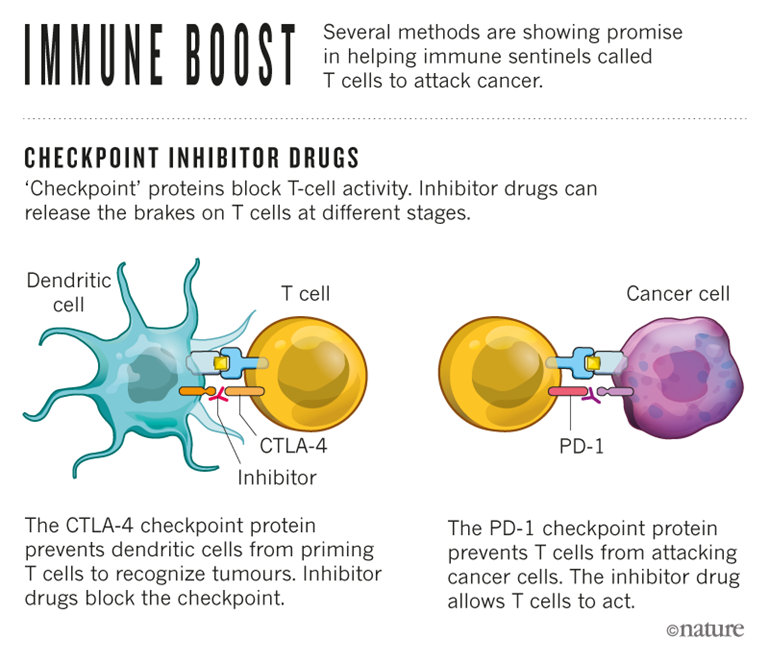
免疫檢查點抑制劑(圖自Nature)
癌癥治療的全新視野
由于ICI在某些侵襲性癌癥(例如轉移性黑色素瘤)的治療方面取得了巨大的臨床進展,因此在癌癥治療領域的這一榮譽無疑是當之無愧的。ICI免疫療法遠遠超出了對某些患者的顯著療效,以多種方式革新了腫瘤學領域。它改變了醫生評估治療效果或處理不良事件的方式。除單純的癌細胞外,它還使人們對癌癥患者有了更全面的認識,并在免疫學家,腫瘤學家和其他器官專科醫生之間產生了新的富有成果的互動。
實際上,依靠通過激活宿主免疫系統來破壞癌癥的免疫療法取得了成功,從而使人們對癌癥有了更完整的認識。現在,它不僅考慮了要靶向和破壞的癌細胞,還考慮了癌癥的免疫環境。研究人員現在完全意識到對培養的癌細胞系和免疫功能低下的動物進行的常規癌癥藥物臨床前測試的意義不大。后者完全忽略了免疫系統。新的和更可靠的臨床前模型使用免疫能力強的動物現在被更廣泛地使用。
現在,用于轉化和臨床研究的新工具包括免疫參數,例如腫瘤浸潤T細胞的存在和活化狀態,免疫檢查點PDL1的表達或腫瘤突變負荷(TMB)的評估。另一方面,對于ICI免疫療法,源自高度突變的腫瘤的多種新抗原的潛力似乎是應答的有利因素。這就是為什么吸煙者的肺癌特征是高煙草誘導的遺傳體細胞突變,其免疫治療的反應優于非吸煙患者的TMB相關性肺癌。高TMB與免疫治療反應之間的相關性導致抗PD1藥物被批準用于與突變的DNA修復缺陷(微衛星不穩定性)有關的高度突變的癌癥。這是癌癥治療史上罕見的例子,無論潛在的腫瘤類型如何,都已根據生物學機制批準了該藥物。
即使在轉移灶的大小最初增加之后,ICI免疫療法仍可以誘導延遲的腫瘤反應。這樣的假性進展可能是由于免疫療法的功效延遲或由于免疫細胞的初始募集而導致暫時性腫瘤尺寸增加。因此,通常用于監測對化學療法或靶向療法的反應的常規標準放射學評估標準(RECIST-1.1)不適用于這些新的反應動力學。iRECIST(免疫RECIST)評估系統已納入了新的評估標準指南,包括確認或證實腫瘤增加的延遲時間。此外,我們還必須修改評估ICI的臨床試驗的主要終點。
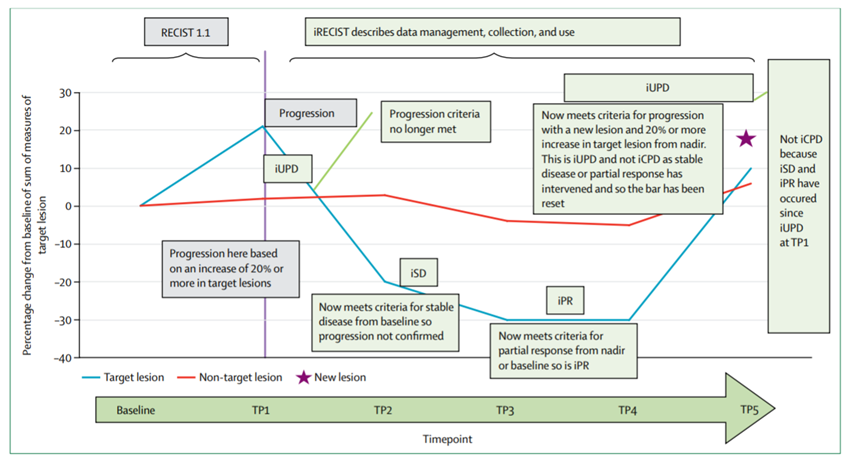
圖|RECIST-1.1和iRECIST評估標準(The Lancet Oncology)
另一個重大變化與免疫治療相關的不良事件類型有關。由于ICI作用機制依賴于抑制免疫激活的生理制動,因此它們通常具有脫靶效應,從而導致免疫介導的各種器官或組織發炎。它們有時可能很嚴重,尤其是當同時使用抗CTLA和抗PD1時,會產生高達60%的3-5級不良事件。盡管很少見,但ICI相關的死亡可能在嚴重的醫源性事件(如心肌炎,腦炎或急性垂體炎)不易診斷并用高劑量類固醇和更有效的免疫抑制劑治療時發生。這種不良事件的新范圍要求治療的腫瘤科醫生與各種器官專科醫生以及內科醫師之間進行快速有效的互動,以優化各種免疫相關不良事件的管理。
希望治愈,但只是少數患者
盡管停止治療,ICI的最令人印象深刻的成功之一是長期緩解,這為某些患者的治愈帶來了巨大希望。在達到完全緩解的黑色素瘤患者中,這意味著所有可見轉移灶都完全消失。大約有20%的黑色素瘤患者接受或不接受抗CTLA-4的抗PD1治療。現在已經廣泛接受的是,對于此類患者,至少經過6個月的治療即可中止治療,因為據估計,在目前可用的5年隨訪中,其復發風險小于10%。在ICI時代之前,如此長時間的完全緩解是完全不可想象的。但是,并非所有類型的癌癥都能像黑色素瘤那樣做出反應,因此關于其他癌癥的中止治療可能性的數據還不成熟。
在黑色素瘤中,抗PD1輔助治療的一年被證明可以減少手術切除局部淋巴結轉移后的復發風險(III期)。在其他類型的癌癥中,例如肺癌,ICI目前被評估為輔助療法。對患者和醫生來說,一項重大變化是基于以下事實:不良事件的影響在轉移性癌癥患者或接受輔助治療的患者中以降低復發風險為目的。在后一種情況下,必須謹慎評估引起嚴重或永久性不利影響的可能性。例如,在轉移性疾病的背景下,接受抗PD1治療的患者中多達10%發生甲減的風險被認為是可以接受的。在輔助情況下,必須一直接受激素替代治療直至生命終了的10%風險必須與預期的治療收益相平衡。
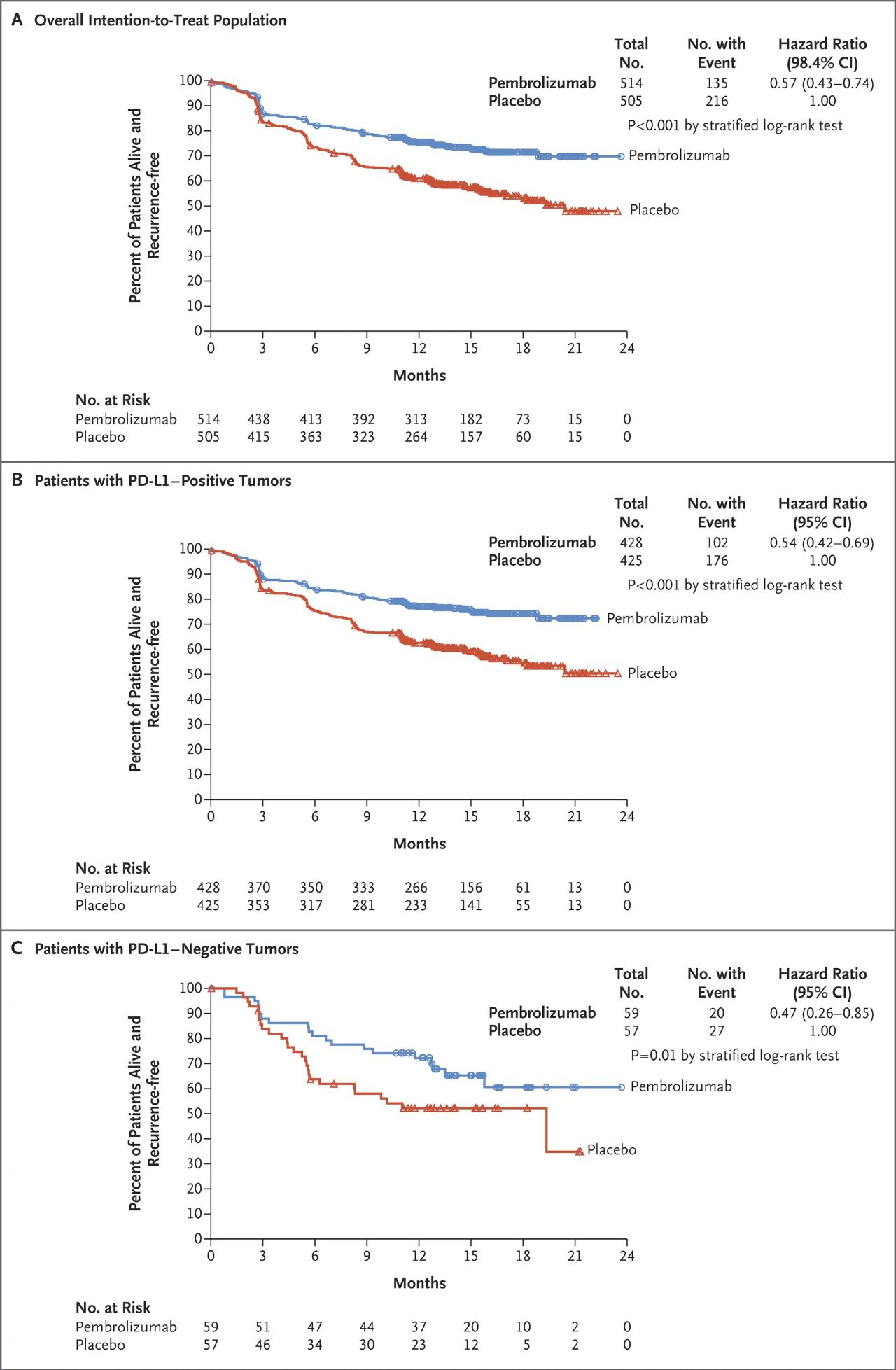
無復發生存率(圖自NEJM)
患者對癌癥免疫治療的態度通常相當積極。患者通常會通過動員自己的免疫系統來對抗癌癥的想法。由于這種對治療策略的頻繁粘連,很可能使患者更加積極地參與其治療,并且至少在治療開始階段可以促進患者與醫生之間的相互作用。
另一個反作用是免疫療法在某種程度上是其成功的犧牲品。這種治療策略在患者和普通公眾中的吸引力,再加上媒體報道的簡化和修飾,已經設定了非常高的期望值,并使ICI治療無法實現其承諾的患者深感失望,他們仍然占大多數。
結語
免疫療法花了很長時間才能滲透到一系列活躍的抗癌藥物中。過去十年來,ICI終于以幾種前所未有的速度開發并授權用于多種癌癥類型。盡管邁出了一大步,ICI仍未解決癌癥治療問題。使用免疫檢查點免疫療法時,已經打開了一扇門,但尚未能結案。研究人員對下一個十年的希望是,將鑒定出用于預測ICI功效和毒性的生物標志物以及可優化ICI方案和新組合的藥效學參數。
參考文獻:
1.Robert, C. A decade of immune-checkpoint inhibitors in cancer therapy. NatCommun 11, 3801 (2020). https://doi.org/10.1038/s41467-020-17670-y
2.Xin, Y. J., Hubbard-Lucey, V. M. & Tang, J. Immuno-oncology drugdevelopment goes global. Nat. Rev. Drug Discov. 18, 899–900 (2019).
3.Ledford, H., Else, H. & Warren, M. Cancer immunologists scoop medicineNobel prize. Nature 562, 20–21 (2018).
4.Eggermont, A. M. M. et al. Adjuvant pembrolizumab versus placebo in resectedstage III melanoma. N. Engl. J. Med. 378, 1789–1801 (2018).











