將納米顆粒遞送到實體瘤中對于其在診斷和治療癌癥中的實用性至關重要。最近發現,只有0.7%(中位數)的納米顆粒被成功遞送到實體瘤中,這一低值導致了納米藥物的臨床轉化之路困難重重。該研究的結果激勵了許多研究人員探索不同的途徑來提高納米顆粒的輸送效率。這些包括改變納米粒子的物理化學性質,例如大小、形狀和表面化學,或使用生物技術,例如消融或飽和庫普弗細胞。盡管有所增加,但挑戰在于,這些方法均未提出提高遞送效率的中心系統性原則。鑒于遞送已經成為納米技術和許多新興技術(例如基因組編輯和免疫療法)中的主要問題,有必要制定提高納米顆粒到靶點的傳遞效率的通用原則。這些原則可以通過重新評估以前的基礎研究或設計策略來發展,以克服阻礙納米顆粒向腫瘤傳遞的障礙。解決這一遞送問題對于納米技術的治療和轉化至關重要。
鑒于此,加拿大多倫多大學Warren C. W. Chan等人發現給藥劑量的閾值是解決遞送效率低的關鍵,想要實現可預測和顯著的釋放,則必須打破這個劑量閾值。相關成果以題為“The dose threshold for nanoparticle tumour delivery”,于8月10日發表在Nature Materials上。

肝清除的劑量閾值
研究人員通過評估納米顆粒劑量與肝臟清除率之間的關系來開始研究。肝臟是最大的網狀內皮系統(RES)器官,并且占所施用納米顆粒的很大一部分。假設一旦劑量超過最大Kupffer細胞攝取率,肝臟對納米顆粒的攝取比例將顯著降低。本研究的目標是找到可以降低肝臟清除率的閾值劑量。
在4T1荷瘤BALB/c小鼠中,通過靜脈注射注入不同數量的50 nm PEG化金納米顆粒,從500億到50萬億納米顆粒,跨越了1000倍。選擇金納米顆粒是因為它們是惰性的,并且可以在很寬的劑量范圍內以高靈敏度檢測到。使用ICP-MS量化了組織中金的生物分布,觀察到,隨著劑量的增加,肝臟積累的注射納米顆粒的比例下降。這對應于納米顆粒血液半衰期從2分鐘到8小時的增加。這表明在高劑量下PEG化納米顆粒的肝臟清除效率受到限制。
研究人員探索了潛在的劑量閾值。他們研究了肝細胞在24h內可能攝取的納米顆粒數量,肝巨噬細胞內在化的納米顆粒數量最多,因此假設這些巨噬細胞被充盈了。首先,在體外,這些細胞在24 h內每個細胞累積約100,000個納米顆粒。在體內,小鼠的庫普弗細胞數量約為1000萬個,因此估計,在24小時內,小鼠肝臟中所有庫普弗細胞的總清除率極限約為1萬億個納米顆粒。并觀察到,隨著劑量增加超過1萬億個納米顆粒的閾值單劑量,庫普弗細胞吸收的納米顆粒數量成比例減少。而且超過之后,肝細胞便會充當肝臟蓄積庫。該研究結果表明,在24h內,單次劑量超過1萬億納米顆粒時,庫普弗細胞的攝取量基本上受到限制。
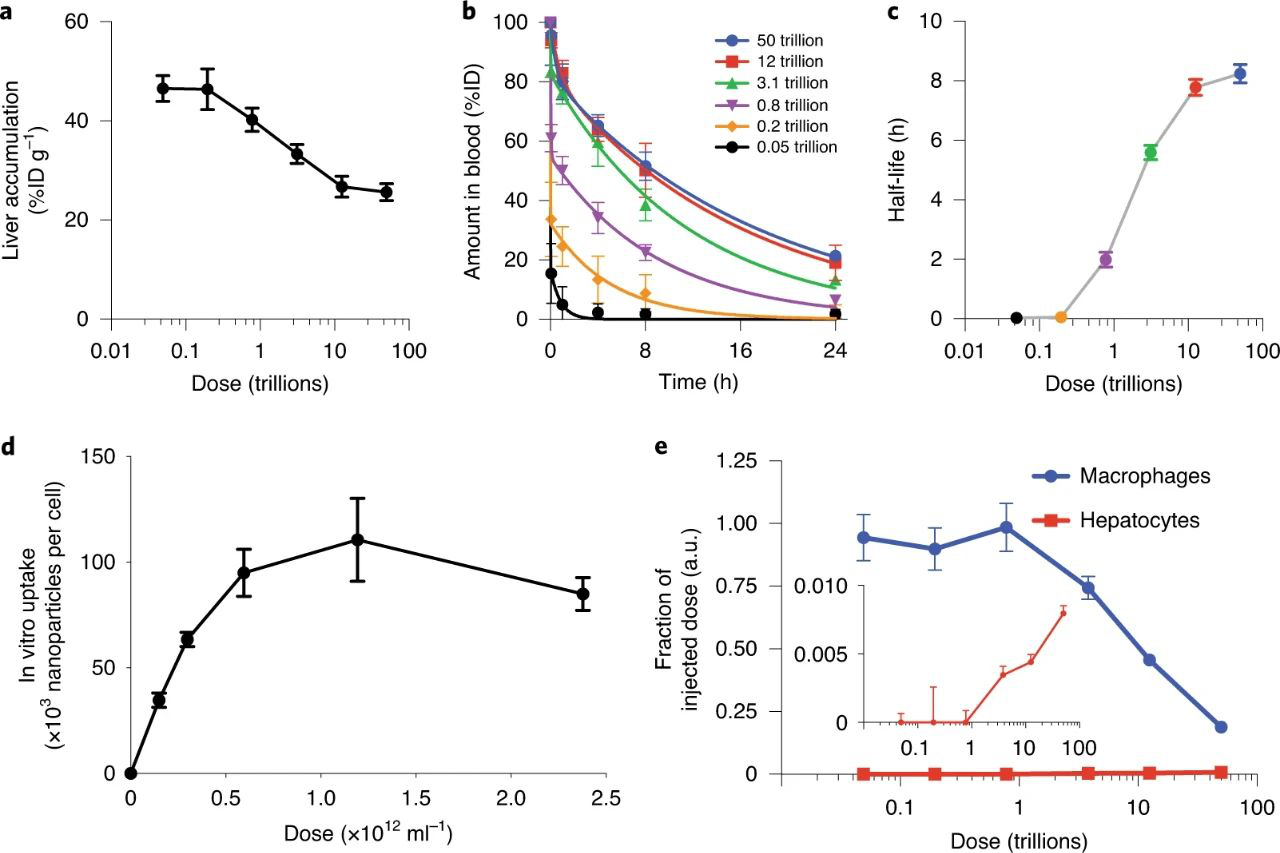
圖1. 肝清除率閾值
庫普弗細胞中劑量閾值的機制
研究人員沒有觀察到庫普弗細胞的總攝取能力達到飽和,所以假設高劑量反而壓倒了攝取率。用活體顯微鏡測量注射后30分鐘內庫普弗細胞的實時納米粒攝取率。當更多的粒子競爭攝取時,高劑量抑制了攝取率,但是實際上巨噬細胞并未達到飽和。這些結果證明,超過閾值的大量納米顆粒通過壓倒了庫普弗細胞的攝取速率而不是攝取能力,從而壓倒了肝臟清除率。
通過研究細胞攝取途徑,表明納米顆粒的劑量閾值與庫普弗細胞上可用受體的數量和結合位點有關。但是具體的受體仍有待確定。超出此可用結合位點閾值的劑量會使庫普弗細胞的吸收速率被壓倒,肝臟清除率降低,血液循環延長。

圖2. 劑量閾值由攝取率決定
單劑量大量給藥才有效
還研究了作為納米顆粒數函數的腫瘤遞送,以評估劑量閾值并表征超過該閾值的遞送。在體內實驗中證實,隨著納米顆粒數量的增加,腫瘤的遞送增加,肝臟的積累相應減少。大約1萬億個納米顆粒標志著這兩個器官非線性劑量依賴性的開始的拐點。
這支持了上面的結果和理論,即最小閾值劑量將開始使肝臟的清除能力壓倒,并增加腫瘤的遞送。還比較了單劑量和分開多次的生物分布,以測試這種作用是否是累積的。情況并非如此,因為盡管兩組中納米粒子的總數相同,但大劑量單劑量顯示出肝臟堆積減少,循環半衰期延長和腫瘤遞送增加。這些結果證實了單次注射超過1萬億個納米顆粒的閾值可以改善腫瘤的遞送。而且還表明,對于各種納米顆粒的大小、組成和腫瘤模型,超過1萬億個納米顆粒的劑量都會顯著增加了腫瘤的遞送。

圖3. 腫瘤遞送的劑量閾值
增強滲透!
研究還研究了增加劑量和遞送對納米粒子與腫瘤細胞相互作用的影響。使用三維CLARITY成像對血管附近的納米粒子進行了成像,并觀察到超過一萬億閾值的更高劑量的納米粒子從血管分布得更深,更深地分布在腫瘤組織中。高劑量分布在整個腫瘤細胞中,大部分分布在細胞內。流式細胞儀定量分析顯示93%的活細胞以高劑量攝取了納米顆粒。這些結果表明,施用數量超過閾值的納米顆粒增強了納米顆粒腫瘤的滲透并改善了向腫瘤細胞群體的遞送。
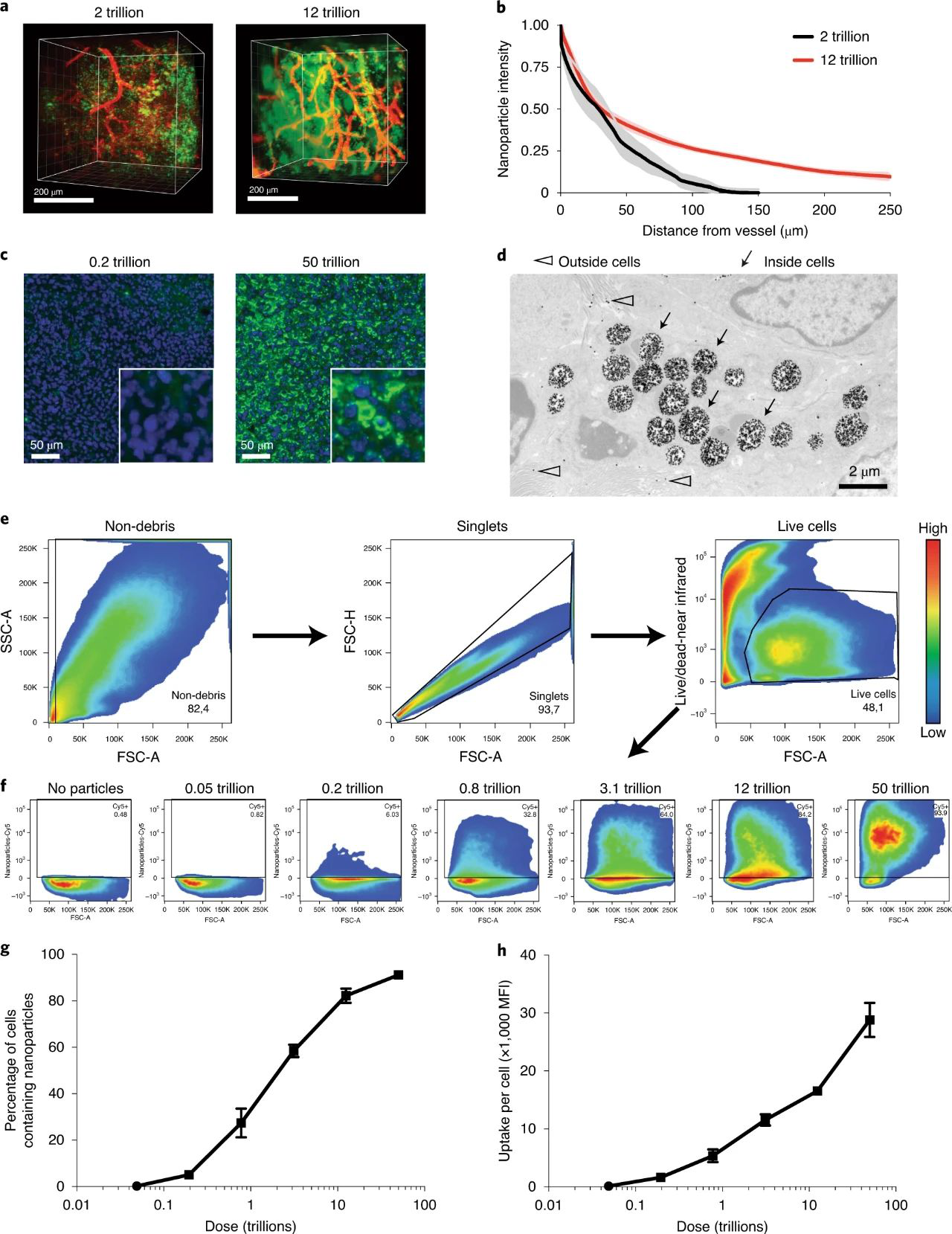
圖4. 超過閾值的腫瘤滲透和細胞遞送
直接改善治療效果
使用細胞毒性納米顆粒Caelyx/Doxil測試了我們納米顆粒劑量理論。為了消除納米顆粒劑量對藥物劑量的影響,選擇使用良性填充劑納米顆粒人為地增加納米顆粒劑量,以增加納米顆粒劑量而不增加細胞毒性藥物,以增加腫瘤的傳遞。通過體內研究并于RES阻斷技術進行比較,結果表明劑量閾值原理比RES阻斷技術更有效。總體而言,實驗結果證明,給予超過閾值的納米顆粒劑量可直接改善治療效果,而與活性藥物劑量無關。

圖5. 高于閾值的Caelyx治療功效
之前文獻中都存在1萬億的閾值
研究人員對2016年的那組薈萃分析論文進行了重新分析,以調查該閾值是否在其他研究中存在。分析表明,納米粒子的數量對腫瘤的傳遞比大小,靶向設計,納米粒子類型或癌癥模型貢獻更大。彈在這些論文中,以納米粒子數量表示劑量的重要性顯然是未知的,因為一半的研究使用的納米粒子劑量高于萬億閾值,而一半的使用低于萬億閾值,這表明劑量是任意選擇的。這些結果強調,納米粒子的劑量數量與腫瘤遞送之間的關系是顯著的,但迄今為止尚未實現。研究人員敦促之后的研究可考慮以高于閾值的劑量施用納米顆粒。
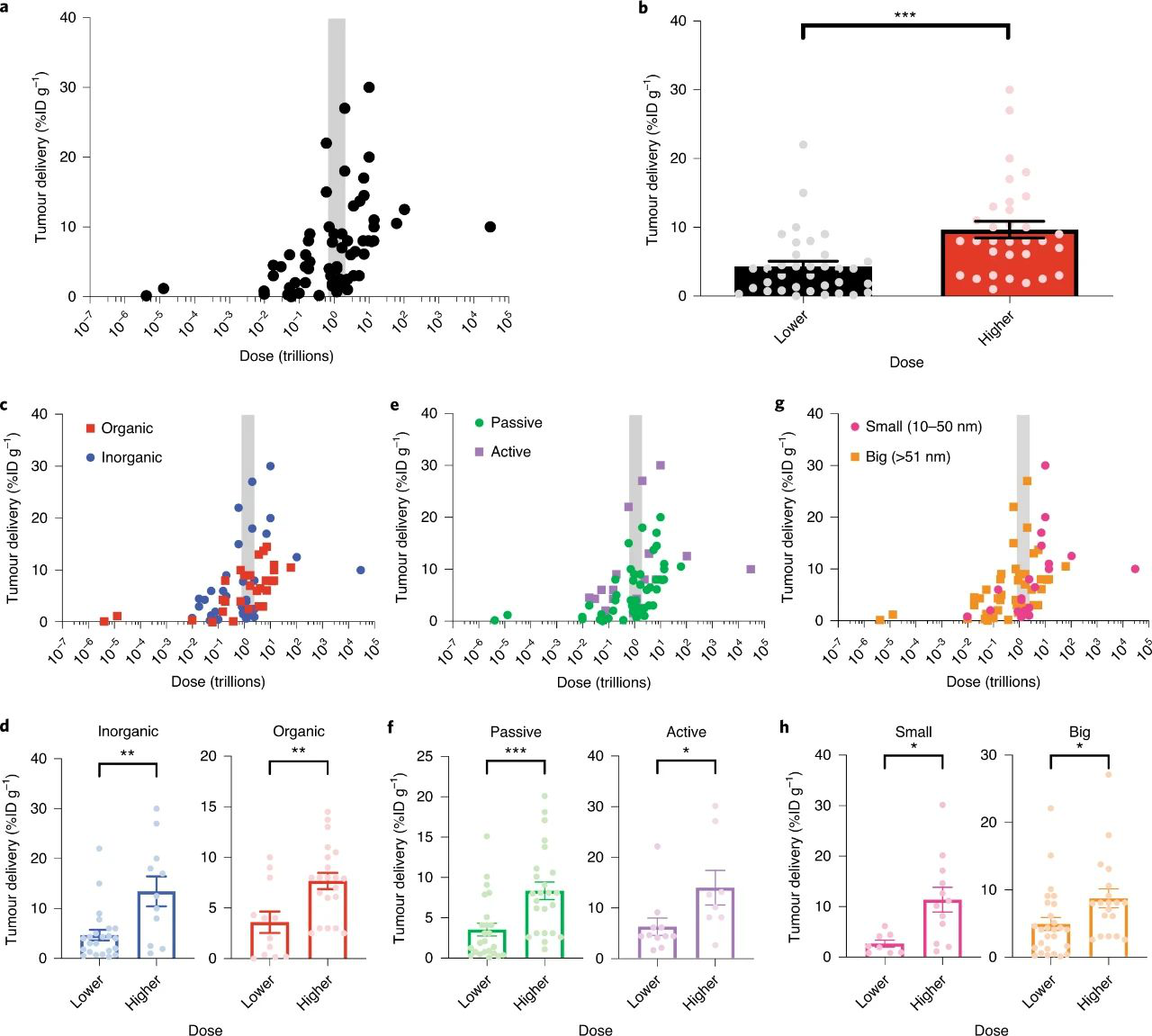
圖6. 確定2005-2015年文獻中的劑量閾值
轉化潛力
通過探索將該閾值概念轉化為人類患者的潛力。分析小鼠和人類之間的給藥轉化,發現在小鼠中發現閾值也可能適用于人類。并估計人納米顆粒制劑的給藥劑量應超過1,500萬億納米顆粒的閾值,以實現有意義的腫瘤遞送。成功的臨床納米顆粒(例如Caelyx,Myocet和Onivyde)的典型劑量分別超過了該閾值,分別為8.6、1.7和1.9萬億納米顆粒。因此,未來的研究應研究使用納米顆粒數作為劑量對臨床納米藥物療效的度量的作用。
小結
發現了可改善納米顆粒遞送和治療的納米顆粒數量閾值劑量。在這里,我們觀察到1萬億個納米顆粒的一般閾值可最大程度地將其遞送至腫瘤,達到小鼠注射劑量的12%。該特定值在納米顆粒設計和體內物種之間可能有所不同,但它為大于10納米的納米顆粒的納米顆粒遞送形成了基本劑量閾值概念。未來的研究應研究不同的納米顆粒設計如何改善該閾值并調節其傳遞范圍,哪些庫普弗細胞受體變得不堪重負,哪些生物腫瘤機制在高劑量下起主導作用以增加腫瘤進入。為了立即進行轉化,當前臨床上批準的抗癌納米顆粒制劑(例如Caelyx /Doxil)可以采用遞送增強劑策略來改善遞送和針對實體瘤的治療功效。設想相對于該閾值對納米粒子劑量進行廣泛而仔細的評估將提供一種強大,通用和簡單的方法來推進新一代成像,診斷和治療的遞送策略。

參考文獻:
1. Ouyang,B., et al. The dose threshold for nanoparticle tumourdelivery. Nat. Mater. (2020).
https://doi.org/10.1038/s41563-020-0755-z











