在化學(xué)領(lǐng)域各子學(xué)科中,催化相關(guān)研究在Science/Nature相關(guān)研究報(bào)道中占有舉足輕重的分量。無(wú)論各種催化“圣杯”還是熱點(diǎn)、難點(diǎn)催化反應(yīng),相關(guān)催化研究一直不斷取得新的突破,其中主要集中于相關(guān)催化新材料、新方法的發(fā)展以及催化反應(yīng)機(jī)理的認(rèn)識(shí)等。近日來(lái),無(wú)論是均相催化還是異相催化,催化相關(guān)研究報(bào)道在Science/Nature中迎來(lái)“大爆發(fā)”,下文對(duì)相關(guān)文章逐一解讀,以饗讀者。
1. Nature:Ni/LaN活化N2合成NH3反應(yīng)
NH3在化肥工業(yè)中是重要原料,同時(shí)是最重要的工業(yè)化學(xué)品,從N2出發(fā)直接合成NH3非常困難,目前的N2活化制備NH3通常經(jīng)過(guò)Haber-Bosch過(guò)程實(shí)現(xiàn)。研究者嘗試各種新方法改變N2活化途徑,希望活化N≡N的過(guò)程更加高效,這些方法包括在傳統(tǒng)的Fe-、Ru-基催化劑上加入堿金屬/堿土金屬氧化物作為促進(jìn)劑(promoter),通過(guò)增強(qiáng)過(guò)渡金屬向N2反鍵軌道中的電子轉(zhuǎn)移。電子晶體基底則體現(xiàn)了更好的效果,因?yàn)槠渚哂休^低的功函、更高的電子密度降低了反應(yīng)能壘。通過(guò)這種催化劑的改性實(shí)現(xiàn)了在溫和條件中的N2活化反應(yīng),但是這種反應(yīng)過(guò)程中仍無(wú)法避免貴金屬Ru的參與。東京工業(yè)大學(xué)Hideo Hosono、Masaaki Kitano等報(bào)道了一種Ni/LaN催化劑,通過(guò)在Ni上活化H2,在LaN中的N缺陷位點(diǎn)上活化N2,實(shí)現(xiàn)了更高的NH3轉(zhuǎn)化性能。1)LaN是NaCl結(jié)構(gòu)的晶體,計(jì)算顯示LaN是半金屬態(tài),價(jià)帶由N 2p組成,導(dǎo)帶由La 5d和6s構(gòu)成。作者認(rèn)為形成N缺陷后,電子會(huì)轉(zhuǎn)移到La上。當(dāng)修飾Ni金屬后,Ni 3d軌道會(huì)貢獻(xiàn)Fermi能級(jí)附近的電子態(tài),因此在形成N缺陷后,電子會(huì)轉(zhuǎn)移到Ni上。作者發(fā)現(xiàn)Ni-N相互作用較強(qiáng),穩(wěn)定了Ni納米粒子免于燒結(jié)。2)催化反應(yīng)。 在400 ℃,0.1 MPa的條件中Ni(12.5 %)/LaN實(shí)現(xiàn)了5543 μmol g-1 h-1的轉(zhuǎn)化效率,表觀活化能為60 kJ mol-1。Ni(5 %)/LaN的催化效率為2400 μmol g-1 h-1,未加入Ni的LaN基本上沒(méi)有催化活性。Ni/LaN納米粒子的反應(yīng)中NH3的濃度達(dá)到0.37 vol %(非常接近0.45 %的熱力學(xué)平衡點(diǎn)),塊體Ni/LaN催化劑中NH3的濃度稍低(0.16 %)。長(zhǎng)時(shí)間連續(xù)催化反應(yīng)結(jié)果顯示,在100 h的連續(xù)催化中保持穩(wěn)定,催化劑在長(zhǎng)時(shí)間催化后結(jié)構(gòu)未改變(界面上的Ni納米粒子未發(fā)生燒結(jié))。在變壓催化反應(yīng)測(cè)試中,作者發(fā)現(xiàn)當(dāng)反應(yīng)壓力提高至0.9 MPa,反應(yīng)速率一直增加,并且催化劑不會(huì)發(fā)生中毒。Tian-Nan Ye, et al. Vacancy-enabled N2 activation for ammonia synthesis on an Ni-loaded catalyst, Nature 2020, 583, 391-395DOI:10.1038/s41586-020-2464-9https://www.nature.com/articles/s41586-020-2464-92. Science:鎢氧簇光催化劑對(duì)烷烴和烯烴的Michael加成反應(yīng)
對(duì)氣態(tài)烷烴分子的直接活化在化學(xué)領(lǐng)域中有較高難度,這是由于這種分子本身具有較大的惰性,同時(shí)C(sp3)-H鍵的斷裂需要苛刻的反應(yīng)條件,阻礙了其在有機(jī)合成化學(xué)領(lǐng)域中的應(yīng)用。荷蘭埃因霍溫科技大學(xué)Timothy No?l等最近通過(guò)廉價(jià)的鎢基光催化劑,通過(guò)較溫和的反應(yīng)條件,實(shí)現(xiàn)了將甲烷、乙烷、丙烷、異丁烷中的C(sp3)-H鍵在室溫中活化,并且對(duì)應(yīng)的碳中心自由基分子能夠通過(guò)Michael加成反應(yīng)接收體進(jìn)行反應(yīng),生成對(duì)應(yīng)的氫烷基化產(chǎn)物,該方法學(xué)有較高的產(chǎn)率和較好的反應(yīng)選擇性。 1)反應(yīng)優(yōu)化和底物拓展。通過(guò)烷烴和烯烴作為反應(yīng)物,在365 nm LED紫外光照條件和TBADT鎢氧簇光催化劑中和CH3CN/H2O溶劑中進(jìn)行流動(dòng)相反應(yīng),實(shí)現(xiàn)了對(duì)烯烴的氫烷基化反應(yīng)。反應(yīng)中的烯烴主要為雙氰基修飾的苯乙烯及其衍生物分子。對(duì)異丁烷(C-H鍵切斷能96.5 kcal/mol)的反應(yīng)顯示對(duì)多種雙氰基修飾的苯乙烯有高于82 %的產(chǎn)率;對(duì)丙烷(C-H鍵切斷能99 kcal/mol)的反應(yīng)顯示對(duì)多種雙氰基修飾的苯乙烯有高于78 %的產(chǎn)率;對(duì)乙烷(C-H鍵切斷能101 kcal/mol)的反應(yīng)顯示對(duì)多種雙氰基修飾的苯乙烯有高于66 %的產(chǎn)率;對(duì)甲烷(C-H鍵切斷能105 kcal/mol)的反應(yīng)顯示對(duì)多種雙氰基修飾的苯乙烯有高于38 %的產(chǎn)率。此外,作者還對(duì)多種丙烯酸酯衍生物分子的反應(yīng)活性進(jìn)行測(cè)試,同樣具有一定的反應(yīng)活性。2)反應(yīng)機(jī)理。[W10O32]4-在紫外光激發(fā)中生成激發(fā)態(tài),隨后將烷烴分子捕獲,通過(guò)氫原子轉(zhuǎn)移反應(yīng)生成對(duì)應(yīng)的烷基自由基,同時(shí)[W10O32]4-光催化劑轉(zhuǎn)化為H+[W10O32]5-,隨后加成到烯烴分子上,生成烯烴烷基化的自由基,并通過(guò)重新將H+[W10O32]5-中的H奪取(hydrogen back-donation),生成加成產(chǎn)物分子。作者發(fā)現(xiàn)該反應(yīng)中在流動(dòng)相中進(jìn)行才能很好的反應(yīng),與之相比在高壓條件中進(jìn)行的非流動(dòng)相反應(yīng)只有痕量產(chǎn)物生成。
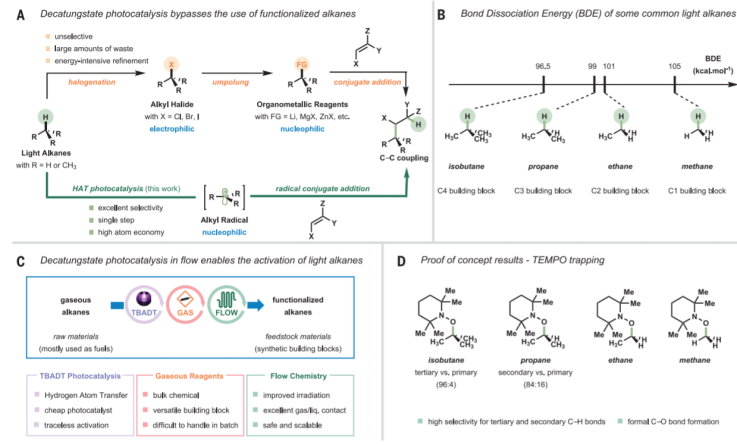
Gabriele Laudadio, et al. C(sp3)–H functionalizations of light hydrocarbons using decatungstate photocatalysis in flow, Science 2020DOI:10.1126/science.abb4688https://science.sciencemag.org/content/369/6499/923. Nature:酶/光協(xié)同烯烴氫烷基化不對(duì)稱反應(yīng)
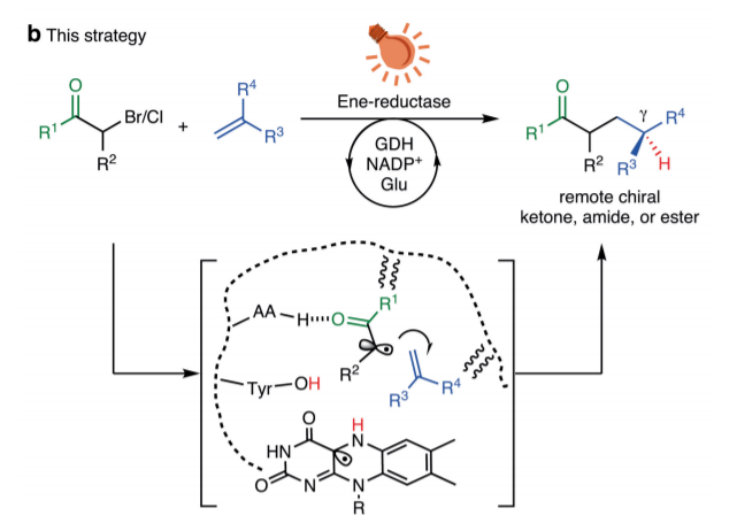
伊利諾伊大學(xué)厄巴納-香檳分校Huimin Zhao等報(bào)道了烯還原酶(ene-reductase)催化作用中的分子間自由基加氫烷基化(hydroalkylation)反應(yīng),該反應(yīng)中通過(guò)端烯分子和α-鹵化羰基分子之間的反應(yīng),這個(gè)反應(yīng)中以達(dá)到99 %的產(chǎn)率和99 % ee值實(shí)現(xiàn)了γ-位點(diǎn)上對(duì)映中心結(jié)構(gòu)的羰基產(chǎn)物分子。并且這個(gè)反應(yīng)是通過(guò)化學(xué)催化方法難以實(shí)現(xiàn)的過(guò)程。反應(yīng)機(jī)理研究結(jié)果顯示,底物通過(guò)和烯還原酶配合,在酶催化活性位點(diǎn)上通過(guò)光催化進(jìn)行對(duì)映選擇性的自由基反應(yīng)。本工作的意義在于擴(kuò)展了光催化和生物酶催化配合進(jìn)行手性催化反應(yīng)。1)反應(yīng)優(yōu)化。將烯還原酶(OYE1中間體)作為酶催化劑,黃素單核苷酸氫醌(flavin mononucleotide hydroquinone, FMN)作為光催化劑,酶通過(guò)His191和Asn194起到和反應(yīng)物分子間形成氫鍵作用,Tyr196作為供氫物。2)反應(yīng)機(jī)理。首先,GDH將NADP+還原為NADPH,同時(shí)將葡萄糖氧化為葡萄糖酸。隨后,NADPH將氫遞送給烯還原酶上的FMN,生成FMNH-。α-鹵代羰基化合物通過(guò)氫鍵作用結(jié)合在酶的位點(diǎn)上,并和FMNH-發(fā)生作用生成電子供體-受體EDA復(fù)合物(electron donor-acceptor)。這種EDA復(fù)合物受光激發(fā),通過(guò)單電子轉(zhuǎn)移過(guò)程進(jìn)行反應(yīng),同時(shí)脫除羰基α-碳上的鹵原子,生成FMNH·和α-羰基自由基,隨后α-羰基自由基和烯烴分子進(jìn)行加成反應(yīng),并在烯還原酶的立體控制作用中對(duì)FMNH·的抓氫反應(yīng),生成FMN和手性產(chǎn)物。Xiaoqiang Huang, et al. Photoenzymatic enantioselective intermolecular radical hydroalkylation, Nature 2020DOI:10.1038/s41586-020-2406-6https://www.nature.com/articles/s41586-020-2406-6
4. Science:銥催化肟不對(duì)稱氫化還原生成手性羥胺
不對(duì)稱氫化反應(yīng)過(guò)程是合成手性分子中最常用的反應(yīng),其中將肟通過(guò)還原生成手性羥胺產(chǎn)物具有較大難度,這是由于較弱的C-N鍵發(fā)生斷裂導(dǎo)致副反應(yīng)的發(fā)生。洛桑聯(lián)邦理工學(xué)院Nicolai Cramer等報(bào)道了一種反應(yīng),通過(guò)應(yīng)用一種環(huán)戊二烯基配位的環(huán)銥金屬配合物,在高酸性反應(yīng)體系的肟還原反應(yīng)中展現(xiàn)了高效反應(yīng)活性,并且在室溫反應(yīng)條件中得到了多種結(jié)構(gòu)的N-烷氧基有機(jī)胺分子,該反應(yīng)抑制了切斷N-O鍵的副反應(yīng),該催化反應(yīng)中的轉(zhuǎn)化數(shù)達(dá)到4000,同時(shí)產(chǎn)物的對(duì)映選擇性達(dá)到98:2,本實(shí)驗(yàn)發(fā)現(xiàn)為發(fā)展金屬催化合成高對(duì)映選擇性的氫化反應(yīng)提供了經(jīng)驗(yàn)。1)反應(yīng)優(yōu)化。反應(yīng)中將芳基取代的叔丁基取代肟分子在1.5倍MsOH分子進(jìn)行質(zhì)子化反應(yīng),得到氫化的肟,隨后在1 mol % Ir催化劑和50 bar H2氣氛中進(jìn)行還原反應(yīng),該反應(yīng)在23 ℃室溫中進(jìn)行。作者對(duì)Ir催化劑的結(jié)構(gòu)和反應(yīng)溶劑進(jìn)行篩選,作者對(duì)Ir催化劑的結(jié)構(gòu)進(jìn)行調(diào)控,分別通過(guò)加入Cpx手性配體、對(duì)芳基亞胺配體的結(jié)構(gòu)進(jìn)行調(diào)控、對(duì)Cpx配體中引入立體位阻芳基取代基,將反應(yīng)中的對(duì)映選擇性優(yōu)化至94:6。2)可能的反應(yīng)機(jī)理(酸輔助對(duì)映選擇氫化反應(yīng))。肟分子在酸催化作用中進(jìn)行反應(yīng),對(duì)肟分子中的N原子氫化,隨后在手性銥催化劑作用中對(duì)C=N鍵進(jìn)行還原。同時(shí)手性銥催化劑在酸輔助作用對(duì)H2進(jìn)行離子型分解,形成Ir-H鍵。通過(guò)在反應(yīng)中加入不同官能團(tuán)小分子,考察了反應(yīng)對(duì)不同官能團(tuán)的兼容性:結(jié)果顯示該反應(yīng)對(duì)芳基上炔基、苯基膦、亞砜基無(wú)法正常進(jìn)行,產(chǎn)率<1 %;對(duì)咪唑芳基、硫醚等底物的產(chǎn)率<20 %。
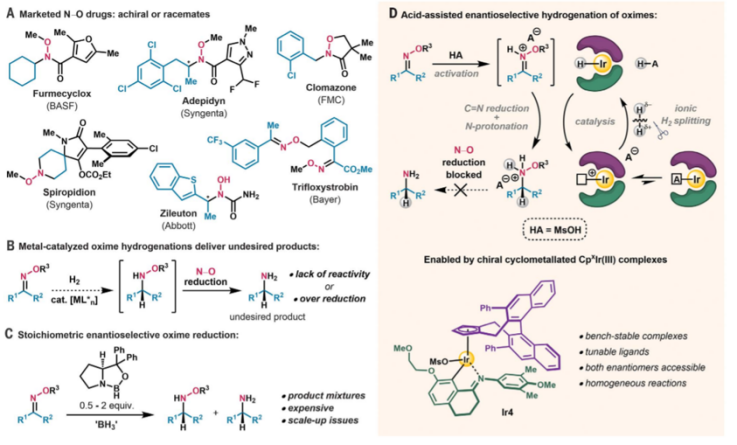
Josep Mas-Roselló, et al. Iridium-catalyzed acid-assisted asymmetric hydrogenation of oximes to hydroxylamines, Science 2020DOI:10.1126/science.abb2559https://science.sciencemag.org/content/368/6495/1098
5. Nature:溫和條件丙二酸酯和二氟分子合成手性單氟分子
含有氟原子的三級(jí)碳立體中心的構(gòu)建在藥物化學(xué)中非常有利用價(jià)值,這是由于其中含有C-H鍵的同時(shí)具有不同的電荷分布、親脂性、構(gòu)象和代謝穩(wěn)定性。含有氟原子的三級(jí)立體碳構(gòu)建目前并未見(jiàn)較好的方法。氟和氫的原子半徑類似,但是電子性質(zhì)有較大區(qū)別,導(dǎo)致C-F鍵非常穩(wěn)定,同時(shí)在雙氟化合物中兩個(gè)C-F鍵之間會(huì)相互增強(qiáng)穩(wěn)定性。因此,通過(guò)對(duì)二氟化合物通過(guò)脫除一個(gè)C-F鍵轉(zhuǎn)化為立體結(jié)構(gòu)的三級(jí)碳中反應(yīng)立體構(gòu)型化學(xué)相關(guān)內(nèi)容仍沒(méi)有相關(guān)研究。加州大學(xué)伯克利分校John F Hartwig等報(bào)道了含有單氟立體碳分子的合成研究。通過(guò)丙二酸酯原料,利用Ir手性亞磷酰胺催化劑,在反應(yīng)中實(shí)現(xiàn)了高反應(yīng)產(chǎn)率和高對(duì)映選擇性。本研究的方法學(xué)同樣適用于Pd催化的芐基取代反應(yīng),說(shuō)明了本方法學(xué)的廣泛適用性。1)反應(yīng)優(yōu)化。反應(yīng)通過(guò)芐基二氟取代的烯烴和2-甲基丙二酸二乙酯作為反應(yīng)物,在4 mol %的Ir手性配體催化劑作用中,加入1.5倍量MOt-Bu(M=Li, Na, K),在室溫中進(jìn)行反應(yīng)。反應(yīng)對(duì)丙二酸中酸性C-H鍵親核取代,得到手性含氟的丙烯基。2)反應(yīng)機(jī)理。Ir手性催化劑和反應(yīng)物中的烯基配合,在LiOtBu作用中,消除分子中的F原子,生成LiF,并轉(zhuǎn)化為烯丙基自由基加成到Ir催化劑上。隨后在丙二酸酯的親核試劑作用中手性加成到單氟碳上,從Ir手性催化劑上脫除,得到手性單氟化產(chǎn)物。
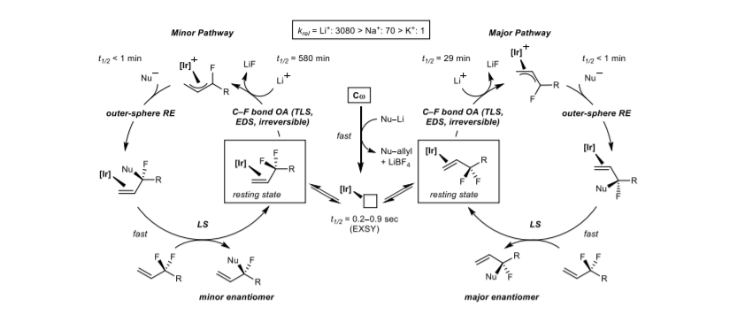
Trevor W. Butcher, et al. Desymmetrization of difluoromethylene groups by C–F bond activation,Nature 2020
DOI:10.1038/s41586-020-2399-1https://www.nature.com/articles/s41586-020-2399-1
6. Nature:苯的連續(xù)還原獲得數(shù)十種不同環(huán)己烷基氘代分子
氫原子的氘(D)、氚(T)同位素目前作為基本的研究方法應(yīng)用于化學(xué)、生物學(xué)、藥學(xué)領(lǐng)域中。除了其在光譜學(xué)、質(zhì)譜、反應(yīng)機(jī)理、藥代動(dòng)力學(xué)中的應(yīng)用,這種同位素方法在藥物分子合成中同樣展現(xiàn)了潛力。氘代的分子在亨廷頓病的治療中顯示有作用。通過(guò)氘代處理,分子的新陳代謝過(guò)程加快、代謝產(chǎn)物得以改善,提高了藥品的安全性和有效性。弗吉尼亞大學(xué)化學(xué)系W. Dean Harman等提出了氘代分子的合成新方法,通過(guò)4步反應(yīng)將苯轉(zhuǎn)化為氘代的環(huán)己烷,該反應(yīng)中通過(guò)鎢配合物的立體選擇催化作用實(shí)現(xiàn)。作者通過(guò)調(diào)節(jié)和鎢配合物結(jié)合的方法(蛋白質(zhì)酸、氫化物),能夠?qū)﹄恢眠M(jìn)行調(diào)節(jié)。通過(guò)這種方法,完成了對(duì)52種不同的環(huán)己烷同位素結(jié)構(gòu)分子。本文的方法可能對(duì)其他取代的環(huán)己烯同位素分子合成,并且對(duì)同位素作用在藥物分子中的作用提供更多的相關(guān)機(jī)理信息。1)反應(yīng)優(yōu)化。通過(guò)去芳化的催化劑WTp(NO)(PMe3)對(duì)苯進(jìn)行活化,并實(shí)現(xiàn)不同位點(diǎn),不同數(shù)目的氘代環(huán)己烷。[WTp(NO)(PMe3)]-C6D6通過(guò)MeOH2+氫化、MeOD2+氘代、BH4-還原氫化、BD4氘代、DOTf氘代、Ph2NH2+氫代、Ph2ND2+氘代反應(yīng)連續(xù)反應(yīng),實(shí)現(xiàn)了不同對(duì)不同位點(diǎn)碳上進(jìn)行高選擇性的氘標(biāo)記。2)此外,作者對(duì)三氟甲基苯進(jìn)行了苯環(huán)上不同位點(diǎn)進(jìn)行氘標(biāo)記。并且在對(duì)苯進(jìn)行氘標(biāo)記過(guò)程中通過(guò)CN-取代、酯基取代、有機(jī)胺取代,得到了不同氘取代的羧酸/酯/胺基取代的環(huán)己烷衍生物。
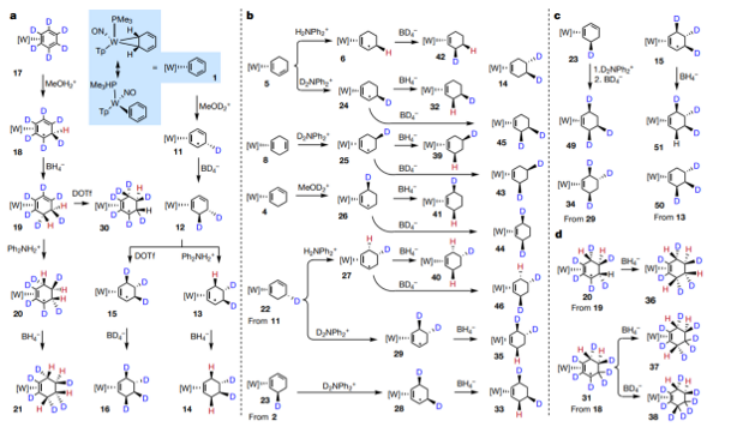
Jacob A. Smith, et al. Preparation of cyclohexene isotopologues and stereoisotopomers from benzene,Nature 2020, 581, 288-293DOI:10.1038/s41586-020-2268-yhttps://www.nature.com/articles/s41586-020-2268-y
7.Science: 強(qiáng)烷基C-H鍵的無(wú)定向硼化作用用于官能化
在合成化學(xué)中,C-H鍵的功能化應(yīng)用的需求主要是在具有不同空間和電子特性的多個(gè)C-H鍵中直接進(jìn)行選擇性的單個(gè)C-H鍵活化,以便合成復(fù)雜分子時(shí)有效減少副產(chǎn)物的生成。在有機(jī)分子的非反應(yīng)性C-H鍵上安裝官能團(tuán)一直是合成化學(xué)的一項(xiàng)重要挑戰(zhàn)。無(wú)論是催化反應(yīng)還是非催化反應(yīng),都發(fā)生在芐基、烯丙基、一級(jí)和二級(jí)C-H鍵上,但是一級(jí)C-H鍵的無(wú)定向官能化作用更強(qiáng),電子含量更低,發(fā)展得更慢。一級(jí)C-H鍵比二級(jí)或三級(jí)C-H鍵均強(qiáng)得多。因此對(duì)能夠?qū)湓踊驓浠锓蛛x出來(lái)的催化劑或酶的活性最低。然而,催化劑可以改變化學(xué)反應(yīng)發(fā)生的部位,特定種類的碳烯的插入可能優(yōu)先發(fā)生在具有空間位阻催化劑的一級(jí)C-H鍵中,而不是二級(jí)C-H鍵中。由于烷基硼酸酯可以形成多種類型的產(chǎn)物,因此具有非常規(guī)的選擇性并具有潛在的合成價(jià)值,但一級(jí)C-H鍵的硼化通常要求底物為溶劑或大量過(guò)量,而且沒(méi)有在潛在反應(yīng)性官能團(tuán)存在的情況下發(fā)生。
有鑒于此,美國(guó)加州大學(xué)伯克利分校John Hartwig教授等人設(shè)計(jì)制備了一種由2-甲基菲羅啉連接的銥催化劑,其活性使得底物為限制試劑進(jìn)行主C-H鍵的無(wú)定向硼化,以及當(dāng)主C-H鍵缺失或受阻時(shí),強(qiáng)的二級(jí)C-H鍵的硼化。
本文要點(diǎn)
要點(diǎn)1. 在生成的碳-硼鍵上的反應(yīng)說(shuō)明,硼化作用導(dǎo)致在有機(jī)分子之前無(wú)法達(dá)到的位置上安裝大量的碳-碳和碳-雜原子鍵。以底物作為限制試劑,在有機(jī)分子中最強(qiáng)的烷基C-H鍵上以無(wú)定向的方式引入一系列官能團(tuán),并在βC-H鍵上引入雜原子。
要點(diǎn)2. 含有2-甲基菲咯啉配體的銥催化劑可以使反應(yīng)加速50-80倍,這種速率的提高使得主要的C–H鍵與作為限制劑的烴選擇性地發(fā)生硼化反應(yīng)。另外,該反應(yīng)對(duì)飽和雜環(huán)中的β-C-H鍵也具有異常的選擇性。在生成的碳-硼鍵上的反應(yīng)表明。
要點(diǎn)3. 當(dāng)主C-H鍵缺失或被空間位阻阻斷時(shí),含有乙醚、硅醚、亞胺、氨基甲酸酯、胺、酮和縮醛功能的底物在主C-H鍵或未激活的次級(jí)C-H鍵處進(jìn)行了硼化。而且,該催化劑還能使大量處于β位置的飽和雜環(huán)以雜環(huán)作為限制試劑進(jìn)行硼化反應(yīng)。
總之,該工作提出了一種使主烷基C-H鍵無(wú)定向硼化的方法,擴(kuò)展了無(wú)定向C-H鍵的硼化作用。
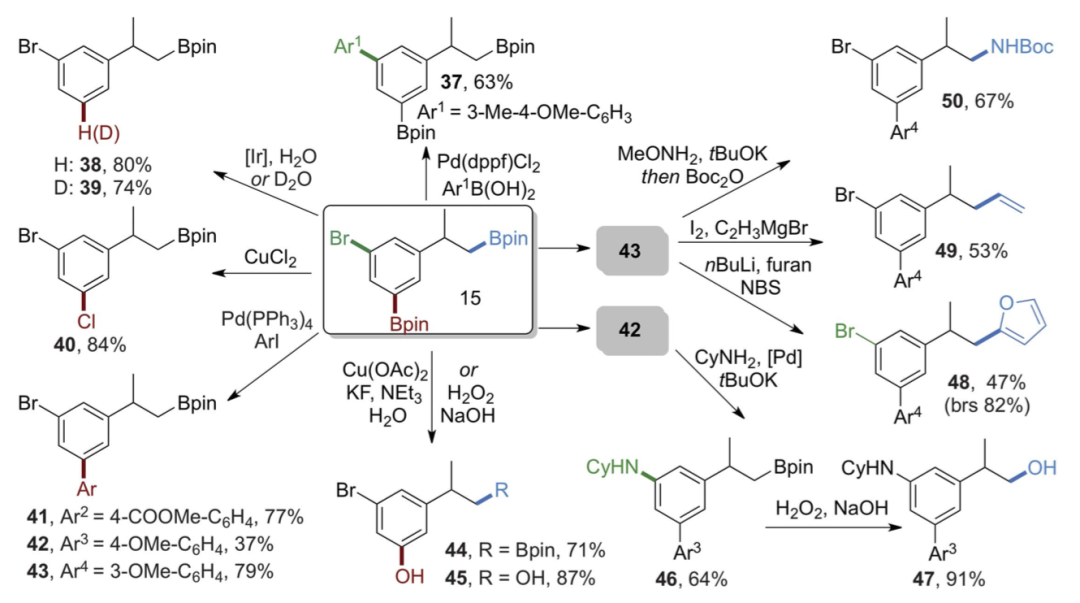
Raphael Oeschger et al. Diverse functionalization of strong alkyl C–H bonds by undirected borylation. Science, 2020.
DOI: 10.1126/science.aba6146http://doi.org/10.1126/science.aba6146
8. Science: 銥催化選擇性芳環(huán)C-H鍵活化反應(yīng)同時(shí)利用手性分子構(gòu)建手性中心
大量的金屬催化劑應(yīng)用了手性配體用于手性催化反應(yīng),實(shí)現(xiàn)了對(duì)映性產(chǎn)物的選擇性生成。手性分子離子對(duì)在非對(duì)映性有機(jī)催化反應(yīng)中也是構(gòu)建手性分子的重要方法,在1980年代,通過(guò)手性陽(yáng)離子催化劑和陰離子中間體反應(yīng)物結(jié)構(gòu)進(jìn)行立體選擇相轉(zhuǎn)移催化開(kāi)始得以應(yīng)用(J. Am. Chem. Soc. 1984 106, 446–447.)。隨后實(shí)現(xiàn)了對(duì)邁克爾加成反應(yīng)、阿德?tīng)柤映煞磻?yīng)、曼尼希反應(yīng)、氟化反應(yīng)、烷基化反應(yīng)等手性對(duì)映體合成反應(yīng)。在最近一段時(shí)間,逆轉(zhuǎn)策略(inverse strategy)被發(fā)現(xiàn)在手性反應(yīng)中非常成功(Angew. Chem. Int. Ed. 2013, 52, 534–561. Nat. Chem. 2012, 4, 603–614.),該方法通過(guò)手性陰離子和陽(yáng)離子中間體配合。特別是當(dāng)利用這種策略同時(shí)與過(guò)渡金屬配合協(xié)同催化,能夠在過(guò)渡金屬催化官能團(tuán)化反應(yīng)的同時(shí),構(gòu)建手性中心,實(shí)現(xiàn)在一步反應(yīng)中同時(shí)進(jìn)行官能團(tuán)化和手性控制。
英國(guó)劍橋大學(xué)的Robert J. Phipps等報(bào)道了新型手性配體的設(shè)計(jì)(磺酸基聯(lián)吡啶陰離子配體和手性陽(yáng)離子手性配體),并將其與銥金屬催化劑協(xié)同作用,實(shí)現(xiàn)芳基硼基化反應(yīng)的同時(shí)構(gòu)建手性苯甲基和手性芳基磷酸中心。
之前的相關(guān)研究:Robert J. Phipps之前還報(bào)道了通過(guò)底物和手性配體分子中的磺酸鹽之間的氫鍵作用實(shí)現(xiàn)構(gòu)建手性結(jié)構(gòu)的同時(shí),實(shí)現(xiàn)硼基化反應(yīng)(Angew. Chem. Int. Ed. 2017, 56, 13351–13355)。最近,余金權(quán)通過(guò)巧妙的接力策略(ingenious relay strategy)策略實(shí)現(xiàn)了對(duì)苯甲基的手性控制,同時(shí)在芳環(huán)上進(jìn)行芳基化反應(yīng)(Nature, 2018, 558, 581-585),但是該反應(yīng)中需要用到~50 % mol量的手性配體分子,反應(yīng)需要在回流溫度條件中發(fā)生。1)該反應(yīng)中能夠?qū)Ψ鞘中缘谋郊谆⒈郊柞;⒘姿狨;鶎?shí)現(xiàn)手性化,且在手性化的同時(shí)對(duì)芳基進(jìn)行硼基化反應(yīng)。該反應(yīng)在室溫條件下發(fā)生,利用[Ir(COD)OMe]2作為硼基化催化劑。隨后,通過(guò)進(jìn)一步反應(yīng),實(shí)現(xiàn)了將硼酸酯官能團(tuán)氧化為-OH,或者轉(zhuǎn)化為氰基。2)反應(yīng)機(jī)理研究。在優(yōu)化的反應(yīng)條件中,反應(yīng)產(chǎn)物一般能得到87~90 %的ee值。對(duì)不同溫度條件下(-10 oC~10 oC),反應(yīng)的收率和手性修飾能力有所區(qū)別,說(shuō)明有機(jī)陰陽(yáng)離子對(duì)和原料底物之間的相互作用在反應(yīng)中的重要影響。對(duì)手性有機(jī)離子對(duì)分子在構(gòu)建手性結(jié)構(gòu)中的作用進(jìn)行了對(duì)照實(shí)驗(yàn)。當(dāng)反應(yīng)中用到的配體為中性的聯(lián)吡啶(非負(fù)電性的磺酸聯(lián)吡啶),反應(yīng)產(chǎn)物不體現(xiàn)手性中心。當(dāng)手性陽(yáng)離子用Br-中和后加入反應(yīng)體系中,反應(yīng)產(chǎn)物的對(duì)映體ee值降低為58 %。
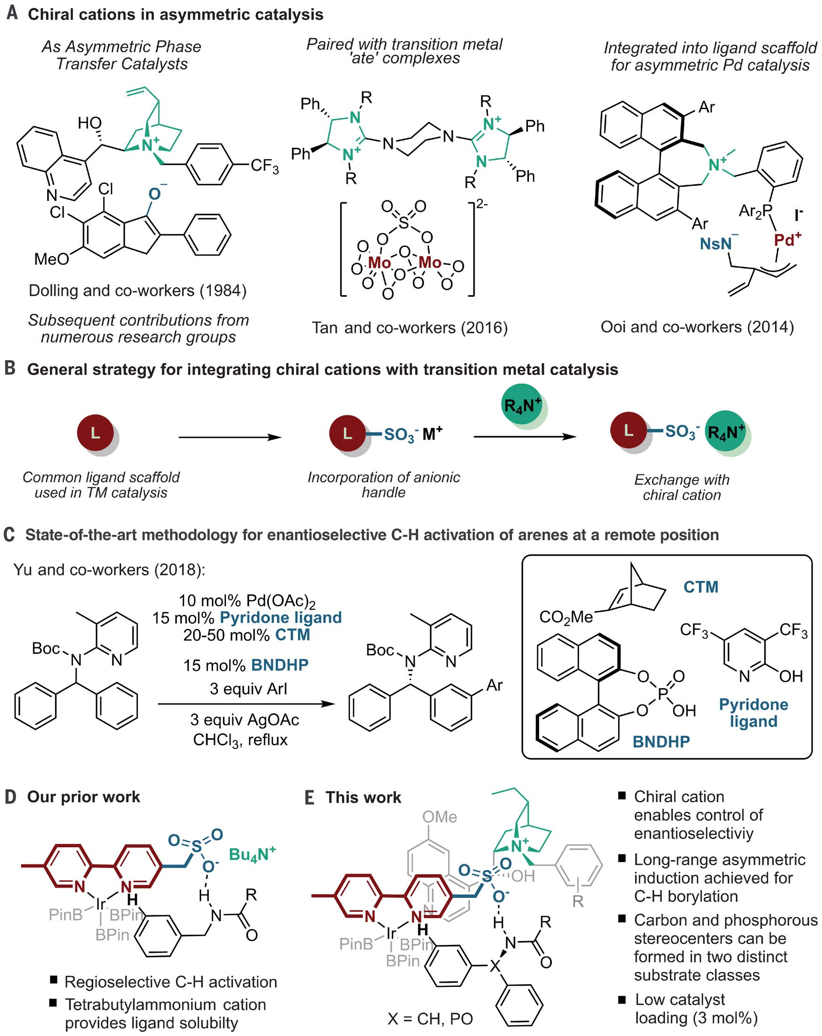
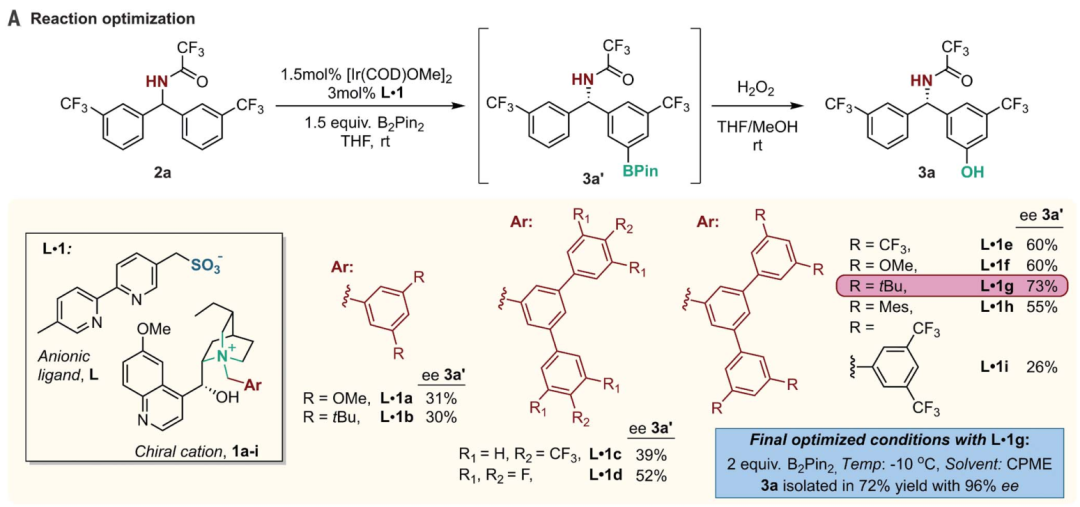
Georgi R. Genov, James L. Douthwaite, Antti S. K. Lahdenper?, David C. Gibson, Robert J. Phipps*. Enantioselective remote C–H activation directed by a chiral cation. Science,2020,367,1246-1251. DOI:10.1126/science.aba1120https://science.sciencemag.org/content/367/6483/1246
9.Nature:機(jī)器學(xué)習(xí)立奇功,CO2制乙烯效率再創(chuàng)新高!
全球能源需求的快速增長(zhǎng)以及用可再生能源替代排放CO2的化石燃料的需求,引起了人們對(duì)間歇性太陽(yáng)能和風(fēng)能化學(xué)存儲(chǔ)的興趣。將CO2電化學(xué)還原為化學(xué)原料極具吸引力,因?yàn)樗梢酝瑫r(shí)使用CO2和可再生能源。當(dāng)將CO2電還原為乙烯時(shí),Cu是這個(gè)反應(yīng)的主要電催化劑,但其工藝亟待進(jìn)一步改進(jìn)。
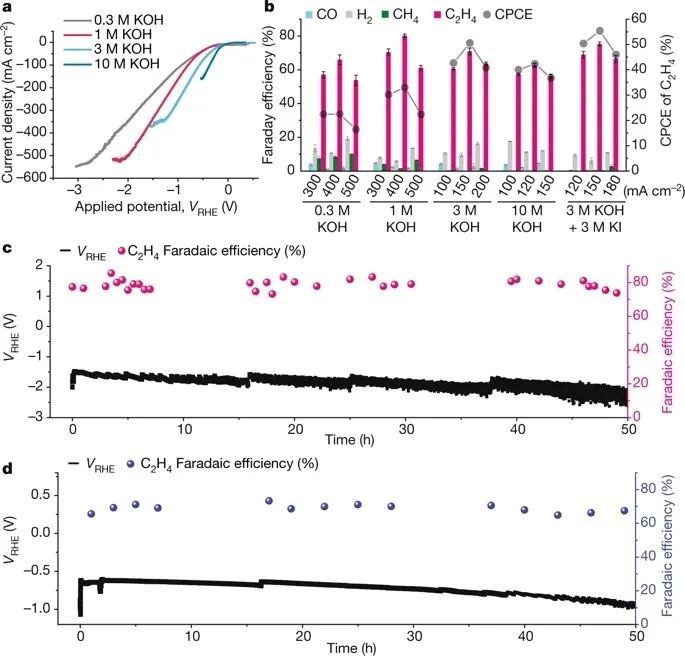
有鑒于此,加拿大多倫多大學(xué)Edward H. Sargent與卡內(nèi)基梅隆大學(xué)Zachary Ulissi通過(guò)密度泛函理論計(jì)算結(jié)合主動(dòng)機(jī)器學(xué)習(xí)確定了一種Cu-Al電催化劑,其能夠有效地將CO2電還原為乙烯,且具有迄今為止報(bào)道的最高法拉第效率。要點(diǎn)1. 結(jié)果表明,Cu-Al吸附位點(diǎn)和位點(diǎn)類型的豐度最高,且其CO吸附能(?ECO)接近最優(yōu)值,這表明Cu-Al合金可能在相對(duì)廣泛的表面成分和位點(diǎn)類型范圍內(nèi)具有活性。Cu-Al模型催化劑實(shí)驗(yàn)驗(yàn)證了這一預(yù)測(cè),在1 M KOH電解質(zhì)中,電流密度為600 mA cm?2時(shí),Cu-Al催化劑的C2H4法拉第效率約為60%(高于純Cu的35%),且Cu-Al催化劑的CO法拉第效率都被抑制到約10%,是純Cu的三分之一。這表明Cu-Al催化劑具有快速的C-C二聚反應(yīng)動(dòng)力學(xué)。
要點(diǎn)2. 通過(guò)對(duì)最佳的機(jī)器學(xué)習(xí)預(yù)測(cè)結(jié)構(gòu)進(jìn)行DFT計(jì)算,以表征CO2還原的主要步驟中反應(yīng)能的變化。受益于Al的引入,C-C鍵合速率決定步驟的反應(yīng)能量從Cu(111)的1.4 eV降至0.6 eV,從Cu(100)的0.6 eV降至0.4 eV。與相應(yīng)的純Cu表面相比,Cu-Al表面的C–C耦合步驟的反應(yīng)能較低。DFT結(jié)果進(jìn)一步表明,生成乙醇中間體HO(CH)CH的反應(yīng)能高于生成C2H4中間體CCH的反應(yīng)能。Al原子附近的水可以幫助將HOCCH還原為CCH,而不是將HOCCH氫化為HO(CH)CH。因而,Cu-Al催化劑抑制了醇的產(chǎn)生,并促進(jìn)了C2H4的生成。
要點(diǎn)3. 在1 M KOH電解質(zhì)中,系統(tǒng)地評(píng)估了碳基氣體擴(kuò)散層(C-GDL,表面含約10%的Al)襯底上脫合金Cu-Al催化劑的CO2電還原性能。在電流密度為600 mA cm?2時(shí),脫合金Cu-Al催化劑實(shí)現(xiàn)了80%的C2H4法拉第效率,與同等條件下純Cu的35%相比,提高了2倍。在全電池CO2+H2O→C2H4+O2反應(yīng)中,半電池CO2→C2H4的功率轉(zhuǎn)換效率(PCE)達(dá)到了34%。此外,當(dāng)使用脫合金Cu-Al催化劑時(shí),整個(gè)C2+(多碳產(chǎn)品)生產(chǎn)的法拉第效率為85–90%,高于使用平面Cu催化劑的55–60%。為了提高器件的穩(wěn)定性,在聚四氟乙烯(PTFE)襯底上制備了脫合金Cu-Al催化劑,PTFE的疏水性在強(qiáng)堿性電解質(zhì)中長(zhǎng)期運(yùn)行中很穩(wěn)定。
在脫合金Cu-Al表面涂覆碳納米顆粒/石墨,形成一種夾芯結(jié)構(gòu),使電流均勻分布在催化劑上,從而在反應(yīng)過(guò)程中穩(wěn)定催化劑表面。在電流密度為400 mA cm?2時(shí),在1 M KOH中實(shí)現(xiàn)了80%以上的C2H4法拉第效率。與之前的最佳結(jié)果相比,在400 mA cm?2的電流密度下,Cu-Al催化劑使陰極PCE獲得了2.8倍的提高。在這種最佳條件下Cu-Al催化劑具有超過(guò)100 h的穩(wěn)定性。Miao Zhong, et al. Accelerated discovery of CO2electrocatalysts using active machine learning. Nature2020, 581 (7807),178-183.DOI: 10.1038/s41586-020-2242-8.https://doi.org/10.1038/s41586-020-2242-8
10. Science:德國(guó)馬克思普朗克研究所報(bào)道鉍催化芳基硼酸酯氟化反應(yīng)
均相過(guò)渡金屬催化反應(yīng)在有機(jī)合成中具有重要應(yīng)用,實(shí)現(xiàn)了多種有機(jī)快速轉(zhuǎn)化反應(yīng)。在這些反應(yīng)中,過(guò)渡金屬的氧化/還原循環(huán)過(guò)程是催化反應(yīng)得以發(fā)生的重要原因。貴金屬在這些催化反應(yīng)中應(yīng)用廣泛,并起到非常好的反應(yīng)活性,為了在實(shí)際生產(chǎn)生活中應(yīng)用,利用分布廣、價(jià)格更合適的過(guò)渡金屬(Fe,Ni,Co,Cu,Mn,Cr等)有巨大意義。此外,一些位于主族金屬卻具有過(guò)渡金屬類似活性的金屬同樣得以發(fā)展(Main-group elements as transition metals,Nature 463, 171–177 (2010).; Frontiers in molecular p-block chemistry: From structure to reactivity, Science 363, 479–484 (2019). )。由于硼、磷具有特殊的酸性(frustrated Lewis pair(FLP)),因此在過(guò)渡金屬催化上體現(xiàn)出不同的催化效果。通過(guò)這些發(fā)現(xiàn),人們發(fā)展了一些和以往不同的催化體系。鉍金屬,作為主族元素催化劑,通過(guò)其Lewis酸性,能夠起到有機(jī)催化反應(yīng)(C-H鍵活化反應(yīng)(Angew. Chem. Int. Ed. 2018, 57, 3825–3829.)、羰基化反應(yīng)(Chem. Sci. 2019, 10, 4169–4176.)、轉(zhuǎn)移氫化反應(yīng)(J. Am. Chem. Soc. 2019, 141, 4235–4240.)、自由基反應(yīng)(Angew. Chem. Int. Ed. 2019, 58, 12924–12929)等)。
馬克思普朗克研究所Josep Cornella報(bào)道了利用鉍的Bi3+/Bi5+循環(huán)用于芳基硼酸酯的氟化反應(yīng)。通過(guò)解析中間體的晶體和其他控制實(shí)驗(yàn)對(duì)催化反應(yīng)的機(jī)理進(jìn)行了研究,給出了反應(yīng)機(jī)理。(1)設(shè)計(jì)了一種Bi(III)復(fù)合物,由一種多芳基束縛骨架配體(tethered backbone ligand)和砜官能團(tuán)構(gòu)成。對(duì)反應(yīng)機(jī)理和重要反應(yīng)中間體進(jìn)行了研究。機(jī)理研究中氟化試劑應(yīng)用XeF2。通過(guò)Bi(III)和XeF2在CDCl3中和0 oC反應(yīng),通過(guò)氧化反應(yīng),不穩(wěn)定的Bi(III)骨架結(jié)構(gòu)被XeF2氧化,生成兩個(gè)Bi-F化學(xué)鍵得到Bi(IV)。解析了Bi(III)復(fù)合物的結(jié)構(gòu)。通過(guò)這個(gè)反應(yīng)對(duì)反應(yīng)動(dòng)力學(xué)進(jìn)行了詳細(xì)研究。(2)在實(shí)驗(yàn)中,利用KF或NaF作為氟化試劑,芳基硼酸酯作為反應(yīng)物,在60或90 oC條件下進(jìn)行反應(yīng),溶劑選擇MeCN或CHCl3。對(duì)芳基底物進(jìn)行了拓展,發(fā)現(xiàn)烯烴、甲氧基、鹵代基都有很好的兼容性和較高的收率(~90 %)。不同的硼酸酯有變化的收率,未酯化的硼酸有最好的收率,BPin酯化的硼酸酯收率有降低。芳環(huán)的立體位阻對(duì)反應(yīng)產(chǎn)率有較大影響,鄰位甲基的產(chǎn)率明顯降低,萘產(chǎn)率也明顯降低。
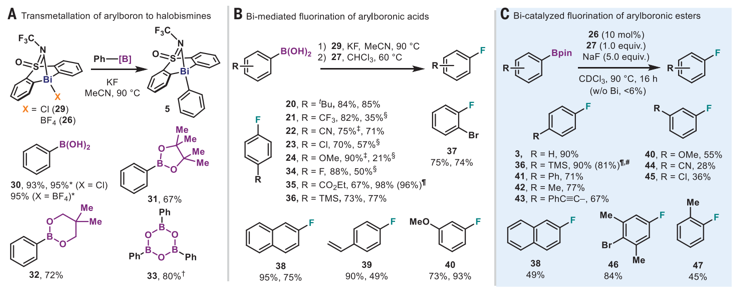
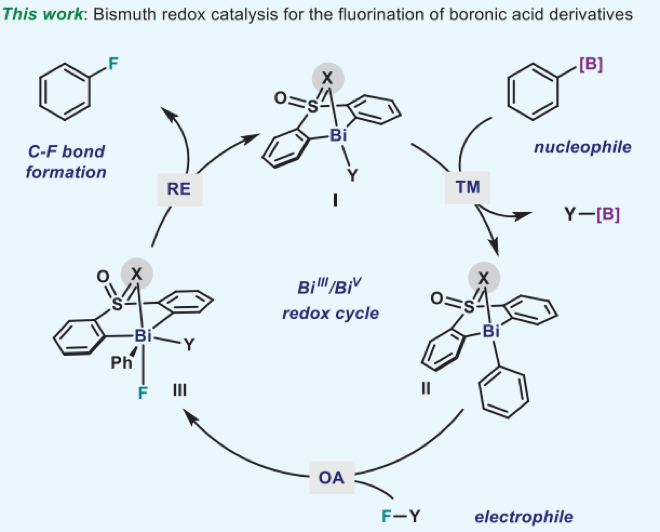
Oriol Planas, Feng Wang, Markus Leutzsch, Josep Cornella*. Fluorination of arylboronic esters enabled by bismuth redox catalysis. Science, 2020, 367, 313–317.
DOI: 10.1126/science.aaz2258https://science.sciencemag.org/content/367/6475/313