胰腺導(dǎo)管腺癌(PDAC)由于KRAS突變的癌細(xì)胞對(duì)化療誘導(dǎo)的細(xì)胞凋亡具有內(nèi)源性抵抗,而腫瘤相關(guān)巨噬細(xì)胞(TAMs)激活間質(zhì)細(xì)胞產(chǎn)生幾乎不可穿透的基質(zhì),因此對(duì)標(biāo)準(zhǔn)療法具有強(qiáng)烈的抵抗性。在此,復(fù)旦大學(xué)陳鈞、上海交通大學(xué)醫(yī)學(xué)院高小玲等人通過合成的4-(膦酰基氧)苯基-2,4-二硝基苯磺酸鹽和Fe3+的自組裝,然后進(jìn)行透明質(zhì)酸修飾,開發(fā)了一種定制的納米復(fù)合物,實(shí)現(xiàn)了對(duì)抗PDAC的化學(xué)動(dòng)力療法(CDT)。
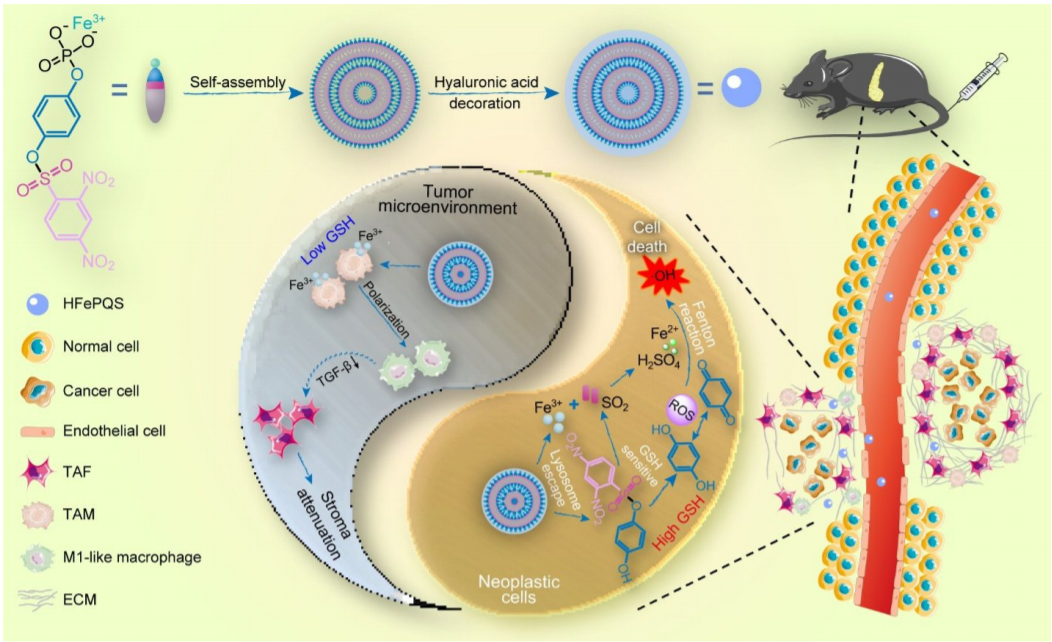
示意圖
本文要點(diǎn):
1)通過在癌細(xì)胞和TAMs獨(dú)特的氧化還原穩(wěn)態(tài)下,以GSH敏感的方式可控地釋放其成分,納米復(fù)合物選擇性地觸發(fā)Fenton反應(yīng)以誘導(dǎo)癌細(xì)胞的氧化損傷,同時(shí)重新極化TAMs,使基質(zhì)細(xì)胞失活,從而削弱基質(zhì)。
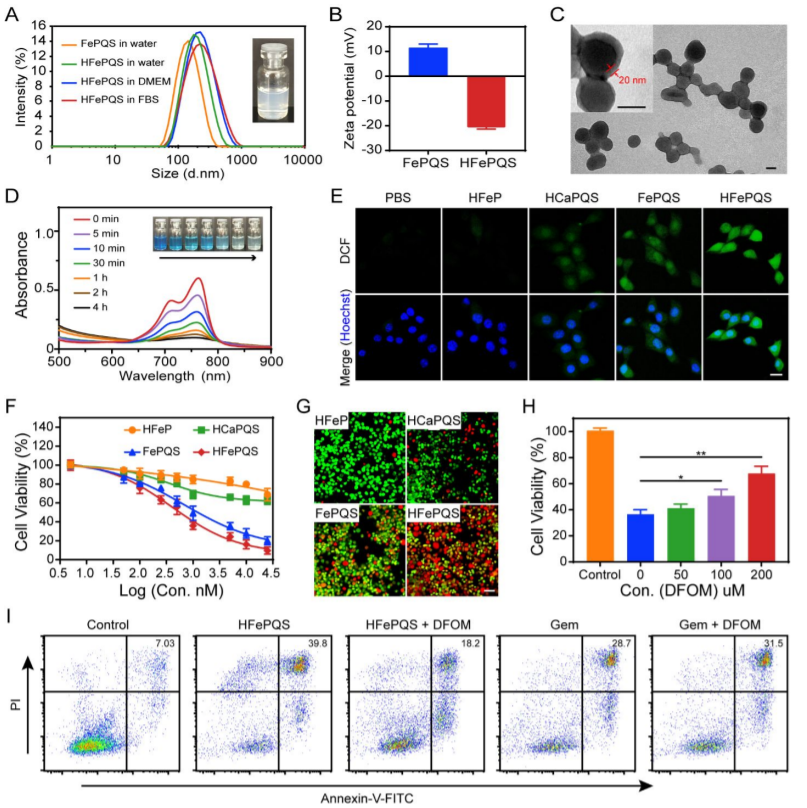
物化表征及細(xì)胞毒性
2)與吉西他濱相比,CDT顯著抑制了原位PDAC模型中腫瘤生長(zhǎng),延長(zhǎng)了動(dòng)物存活時(shí)間,且無明顯副作用。
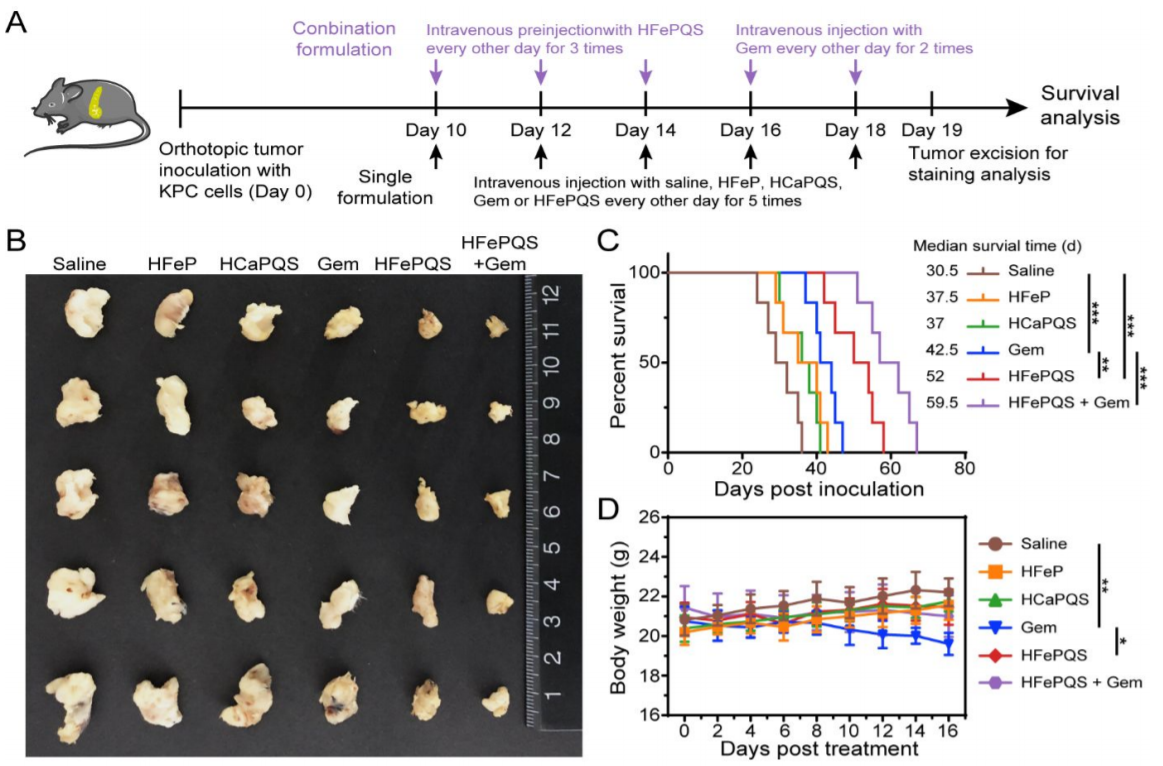
抗腫瘤實(shí)驗(yàn)
綜上所述,此研究通過CDT介導(dǎo)的可控性癌細(xì)胞損傷和基質(zhì)微環(huán)境的重新編程,為改善PDAC的治療提供了一種有前景的策略。
參考文獻(xiàn):
Yu Chen, et al. Tailored Chemodynamic Nanomedicine Improves Pancreatic Cancer Treatment via Controllable Damaging Neoplastic Cells and Reprogramming Tumor Microenvironment. Nano Lett., 2020.
DOI: 10.1021/acs.nanolett.0c02622
https://doi.org/10.1021/acs.nanolett.0c02622











