雖然培養基質的機械性質對細胞行為的影響的跡象早已被觀察到,但直到最近,這一概念才被科學界廣泛接受。在20世紀90年代末,Pelham和Wang發現不同彈性模量的聚丙烯酰胺水凝膠影響著細胞與ECM的粘附、細胞擴散和遷移。自從這項研究以來,許多研究小組已經使用聚丙烯酰胺凝膠和具有可調彈性模量的各種其他材料系統來表明基質硬度影響其他各種過程,包括增殖和凋亡、干細胞分化、乳腺癌進展和對藥物的反應。
從機械上講,目前的觀點認為,當細胞通過基于整合素的粘附或其他細胞-表面連接與底物結合時,細胞利用基于肌動球蛋白的收縮力施加牽引力,目前的共識是ECM硬度在調節發育、體內平衡、再生過程和疾病進展中起著關鍵作用。
活體組織不是純粹的彈性材料,它們表現出隨時間變化的機械響應并耗散使它們變形所需的能量的一部分,根據分子機制,這種特性稱為粘彈性或多孔彈性。越來越多研究表明,組織和ECM的這些更復雜的機械特性有時會以我們以前基于純彈性底物的機械轉導理解所無法預料的方式影響細胞。
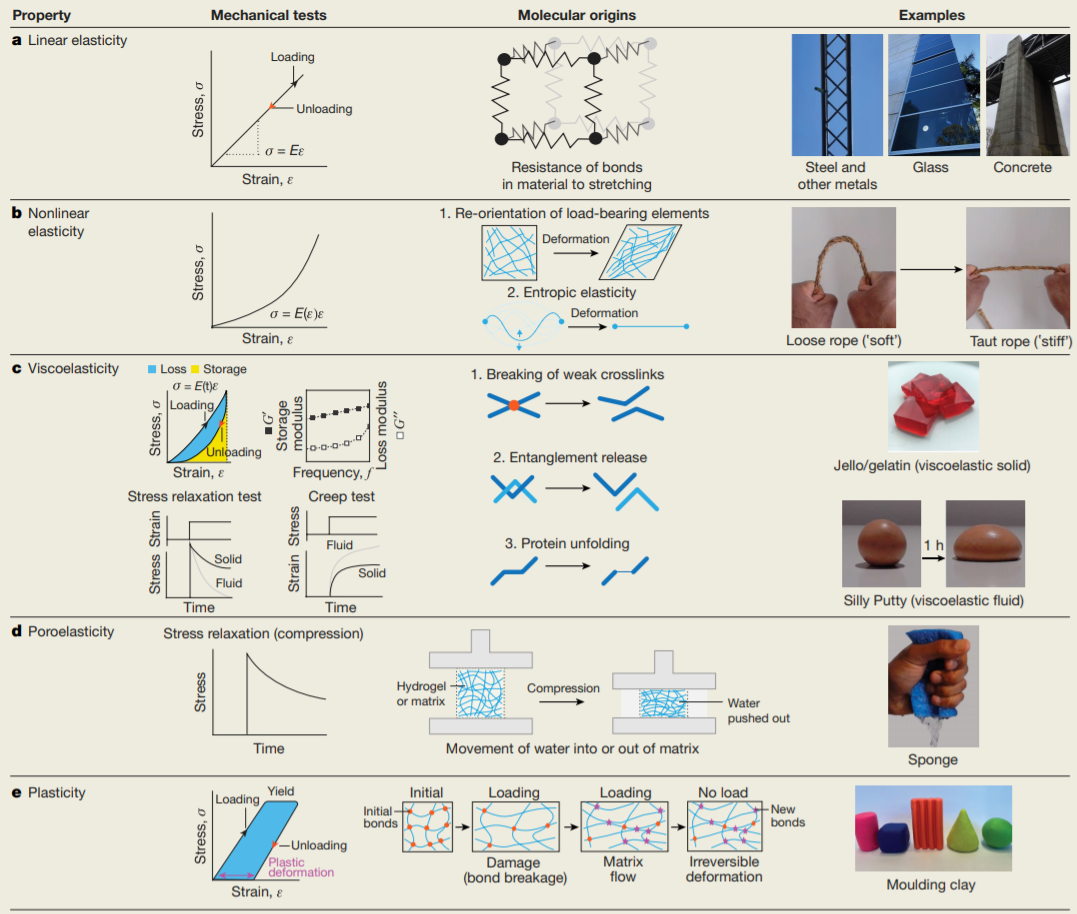
將材料結構與荷載作用下的功能反應聯系起來
鑒于此,賓夕法尼亞大學Vivek B. Shenoy、Paul A. Janmey、哈佛大學David J. Mooney院士、澳大利亞昆士蘭大學JustinCooper-White和斯坦福大學Ovijit Chaudhuri等人近日在Nature上發表綜述,回顧了組織和ECM的復雜機械行為,討論了ECM粘彈性對細胞的影響的最新工作,并描述了在再生醫學中使用粘彈性生物材料的潛力。

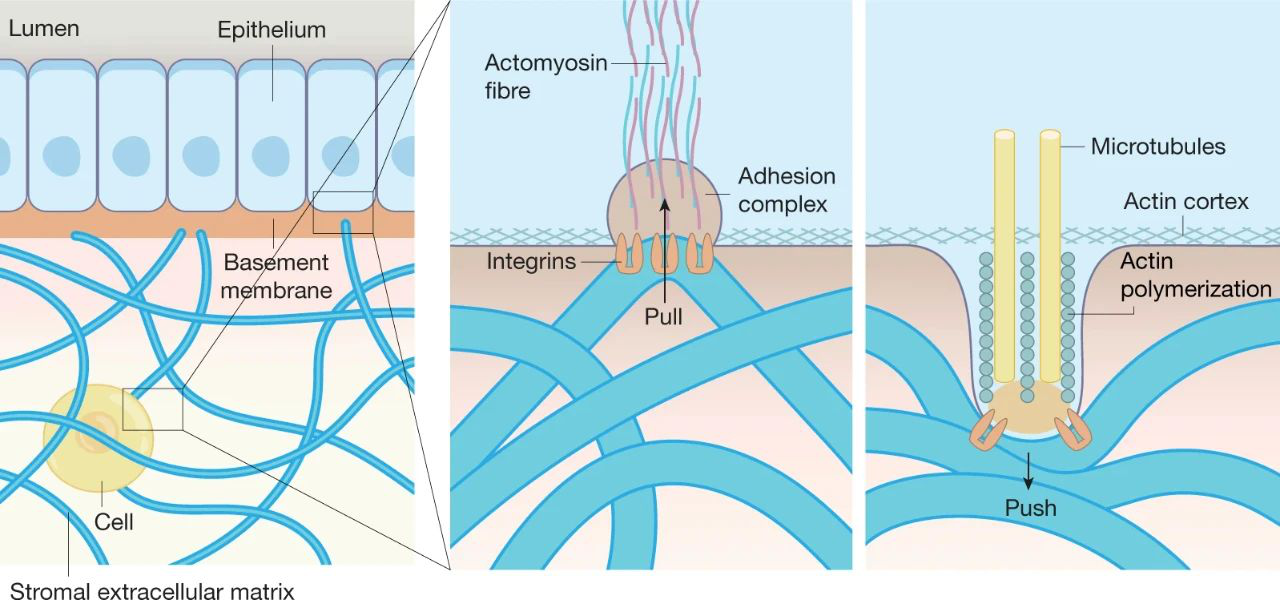
細胞與細胞外基質之間的機械相互作用
組織和ECM機理非常復雜
已經發現粘彈性是活組織和ECM的近乎普遍的特征。哺乳動物中最柔軟,耗散性最強的粘彈性組織之一是大腦。根據時間尺度和變形,腦組織可以在很長的時間尺度上看起來像玻璃或液體一樣流動。此外,耗散(和粘彈性)不僅可以區分灰質和白質,還可以區分大腦的不同區域。其他軟組織也是粘彈性的,圖2的流變學分析表明,軟組織通常在1 Hz時表現出損耗或粘彈性模量,通常約為其存儲模量的10%至20%或彈性模量。應力松弛測試表明,軟組織(包括肝,乳腺,肌肉,皮膚和脂肪組織)在數十秒到幾百秒的時間范圍內都顯著松弛了它們對變形的抵抗力。甚至較硬的骨骼組織(包括骨骼,腱,韌帶和軟骨)也具有粘彈性,損耗模量約為存儲模量的10%。處于不同發育階段的胚胎以及諸如破裂性血腫或血凝塊等再生結構也表現出粘彈性。
重要的是,粘彈性的變化與疾病的進展有關。彈性模量的測定是觸診以識別僵硬腫瘤的基礎,對于鑒別大多數類型的腦腫瘤并不有效,相反,磁共振彈性成像所揭示的,其耗散特性的變化可以在原位識別膠質瘤和其他類型腦瘤的邊緣。此外,粘彈性的變化與其他類型的癌癥或疾病有關,但有關這些數據的缺失很大,這代表了我們知識上的一個重大缺口。
表現出粘塑性的材料代表了粘彈性材料的一個子集,這些材料對低于其屈服應力的載荷或變形具有粘彈性。用于細胞培養的重構ECM材料通常是粘塑性的。組織粘塑性的特征甚至小于組織粘彈性,這代表了知識上的另一個關鍵缺口。
組織和ECM的耗散特性是多種機制的基礎,其中一些機制也導致了粘塑性。許多組織還表現出多孔彈性效應和非線性彈性。
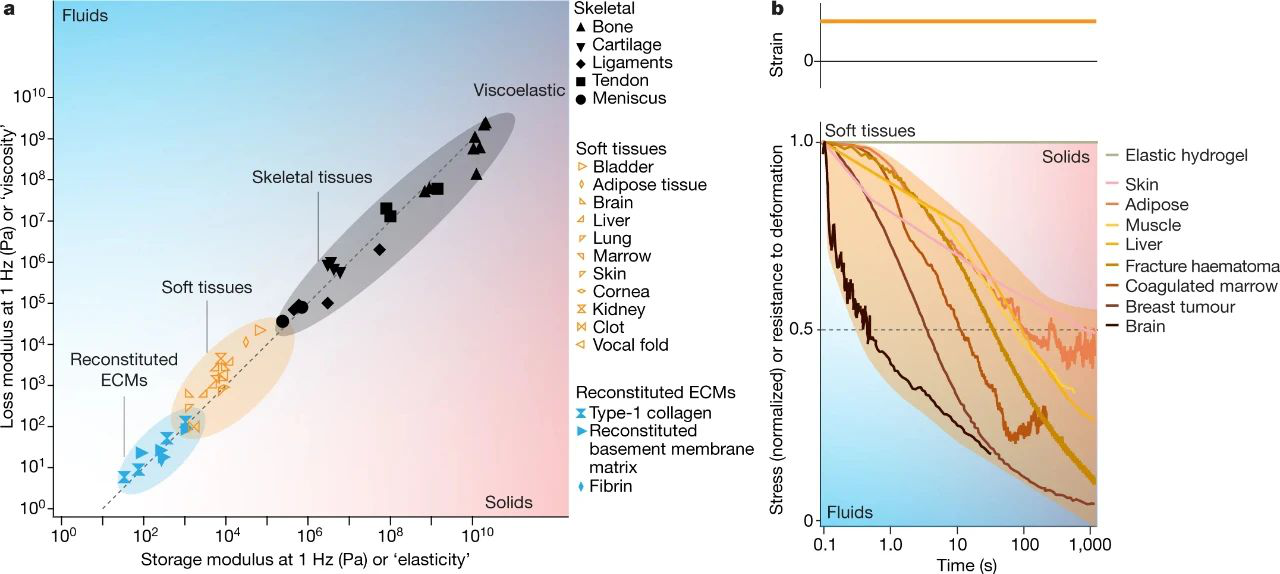
生物組織和細胞外基質是粘彈性的,并響應變形而顯示應力松弛
二維培養基與分子離合器
利用具有獨立可調節粘彈性特性的生物材料研究了二維培養底物粘彈性對細胞的作用。還比較了在共價交聯(或彈性)與離子交聯(或粘彈性和粘塑性)藻酸鹽凝膠上培養成纖維細胞和癌細胞的影響。二維培養中細胞基質剛度的主要傳感裝置被認為是肌球蛋白-肌動蛋白-粘附系統,也稱為馬達離合器模塊(圖3),其動力學已成功地解釋了彈性體上細胞的剛度傳感基材。模型顯示,對于軟質基材,在最佳粘度水平下可實現最大的細胞擴散,對于堅硬的基材,該模型預測粘度不會影響細胞擴散,因為所結合的離合器會因剛度增加而飽和。
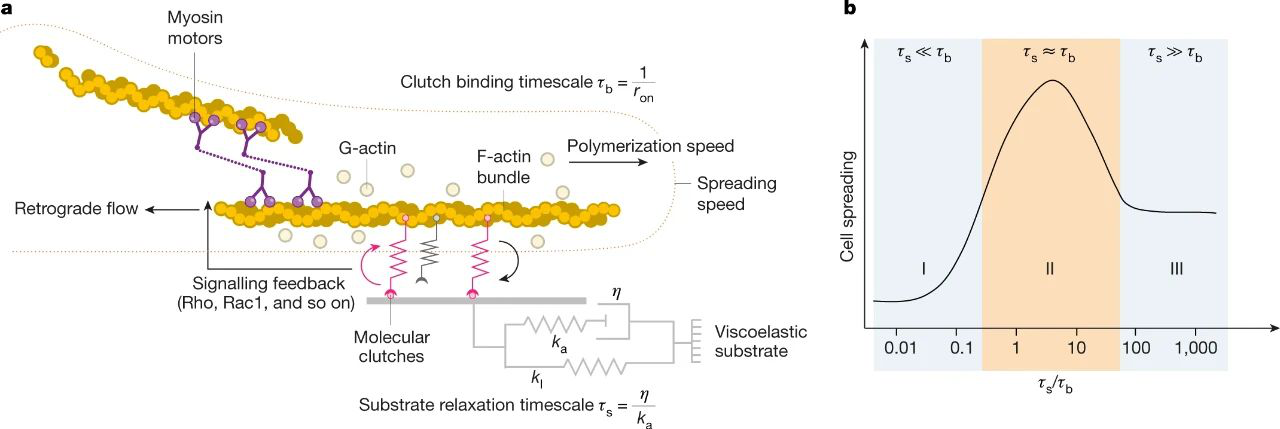
機械轉導的分子離合模型從兩個方面解釋了基質粘彈性對細胞擴散的影響
三維培養與機械約束
還已經在三維培養基中研究了基質粘彈性的作用。已知培養物的尺寸會影響細胞結構、粘附、信號傳導和營養物質的運輸。三維培養支持多種行為,包括上皮形態發生,維持人類胚胎干細胞的多能性以及軟骨細胞的分化狀態。培養基維度也已專門涉及介導機械轉導。
各種研究探索了基質粘彈性對三維培養中細胞的影響。RGD偶聯的聚乙二醇(PEG)凝膠,RGD偶聯的海藻酸鹽凝膠以及透明質酸和膠原蛋白的互穿網絡中增加的應力松弛,增強的蠕變或更高的損耗模量,以及透明質酸和膠原蛋白的互穿網絡,促進了粘附細胞(如成肌細胞,成纖維細胞和MSC)的擴散。具有快速應力松弛的水凝膠還有助于維持神經祖細胞的干性,而在共價交聯的水凝膠中卻受到抑制。此外,軟骨細胞和成骨分化的MSC可以在顯示快速應力松弛的粘彈性水凝膠中分別形成大量相互連接的軟骨樣或骨樣基質。
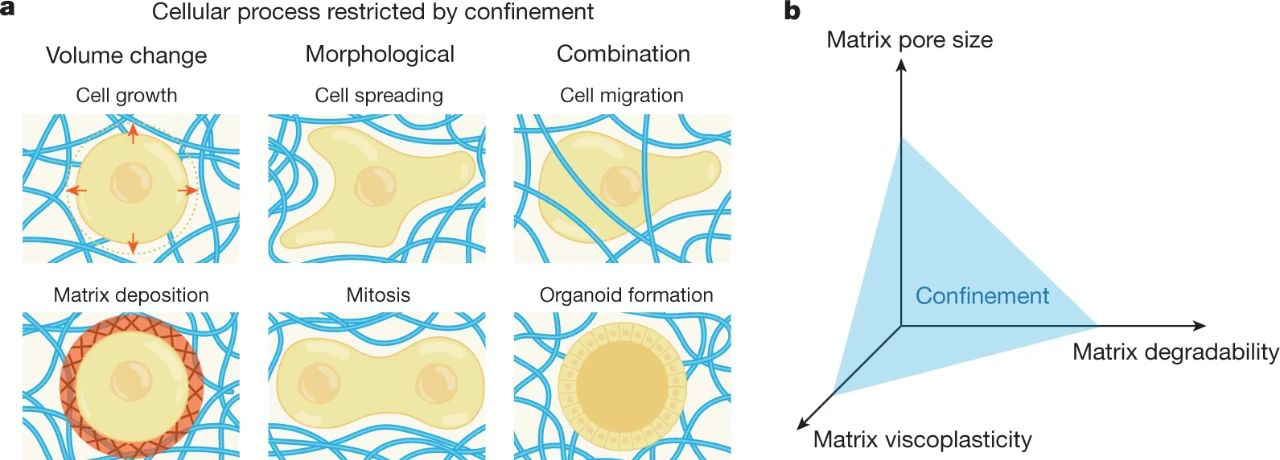
基質粘塑性在三維培養中介導了機械限制
醫用粘彈性生物材料
上面講了那么多的,有一個潛在的應用在于再生醫學生物材料的設計。該領域的起源是為了使那些因疾病或外傷而受損或丟失的組織和器官或工程替代品再生。基質粘彈性對細胞增殖,基因表達,命運和遷移的明顯影響突出了其作為基于生物材料的應用的設計參數的重要性。確實,FDA批準的組織工程產品(例如,Apligraft工程皮膚)通常基于粘彈性基質。材料處理技術(例如3D打印)的進步(通常使用粘彈性材料)使組織和器官的結構和特性得以更真實地概括。
既有直接的證據,又有大量的相關數據表明,粘彈性是用于再生醫學的生物材料的重要設計參數。基質剛度調節再生的第一個證明是使用干細胞在粘彈性水凝膠中的移植。令人驚訝的是,剛度對這些凝膠中干細胞命運的影響與細胞牽引力使包含水凝膠的聚合物重塑的能力有關,這表明,實際上,凝膠的粘彈性是影響凝膠對細胞命運影響的關鍵。隨后的研究通過將細胞移植到初始彈性模量匹配的水凝膠中直接研究了粘彈性的影響,但應力松弛率不同。具有更快應力釋放的水凝膠可促進骨骼再生。最佳松弛率對應于從患者身上分離出的人類骨折血腫,其包括自然發生骨再生的環境。還發現類似的傳遞誘導蛋白的粘彈性水凝膠可促進廣泛的骨再生,這可能是由于宿主細胞容易侵入凝膠的能力所致。水凝膠在各種應用中的有益作用(包括軟骨再生,聲帶再生和心肌梗塞后心肌病理重塑的改善)也可能與其粘彈性有關。
一個關鍵問題是,粘彈性是否已成為一個隱藏變量,以更廣泛地解釋生物材料領域過去的許多工作。再生醫學中一些最廣泛使用和成功的生物材料,包括膠原蛋白凝膠,透明質酸和超分子組裝物,都是物理交聯的水凝膠。重組后的基底膜基質是用于體外腸類器官形成的最廣泛使用的生物材料,也是一種物理交聯的粘彈性水凝膠,其他用于促進骨骼肌,肝臟和神經類器官的形成的材料也是如此。已經進行了許多旨在描述基質降解對組織再生的影響的研究,并且具有啟發性的可能性是這種影響可能至少部分與這些生物材料的粘彈性行為有關。幾項早期研究得出的結論是,降解速度更快的水凝膠比降解速度較慢的凝膠導致更多的組織再生。但是,這些研究利用聚合物分子量的變化來調節凝膠的溶解,這些變化也將改變粘彈性。還有,導致這些材料降解的細胞活性可能會將局部基質轉變為更粘彈性的狀態。此外,細胞可能與它們自己沉積的基質分子相互作用,這可能提供粘彈性底物。類似地,最近為開發用于類器官形成的天然衍生的物理水凝膠的合成類似物的努力表明,凝膠的降解性對于設計合成替代品至關重要。盡管對粘彈性在先天和適應性免疫系統細胞的命運和功能狀態中的作用了解甚少,但最近的一項研究涉及純彈性共價交聯的合成基質,而不是用天然衍生的物理交聯的粘彈性ECM制造的那些,導致炎癥。顯然,將需要更多的研究來描述粘彈性,其他物理特性和化學組成在細胞和組織對介導組織修復和形成的各種生物材料反應中的特定作用。
展望
生物材料設計歷來沒有考慮到粘彈性的重要性,但是展望未來,粘彈性很可能成為許多應用中的關鍵技術規范。成功可能需要模仿發育中組織的機械特性,因為模仿發育環境通常是促進再生的有效策略。粘彈性在調節可能包括多能干細胞、組織駐留干細胞和分化細胞以及免疫細胞在內的各種細胞類型生物學調節中的作用,以便合理設計能夠促進組織再生的材料。生物材料的設計也可能需要將細胞感知的局部粘彈性特性與實現再生或工程組織機械穩定性所需的更大的組織尺度特性相分離。因此,具有可控粘彈性的生物材料的出現可能會改變生物材料在再生醫學中的應用。
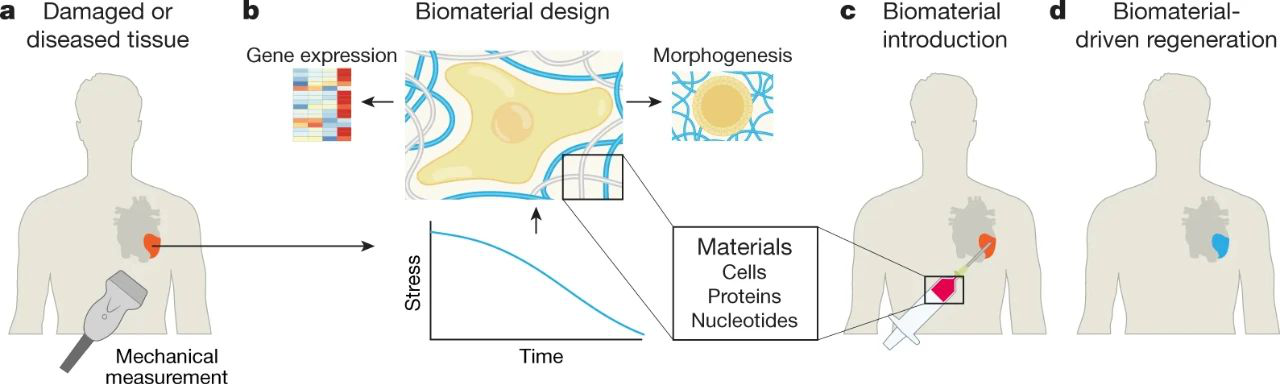
設計用于再生醫學的粘彈性生物材料
參考文獻:
Chaudhuri, O., et al. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature 584, 535–546 (2020).
https://doi.org/10.1038/s41586-020-2612-2











