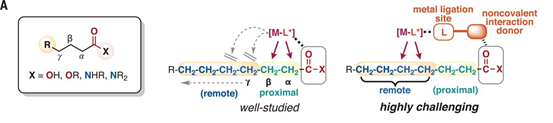
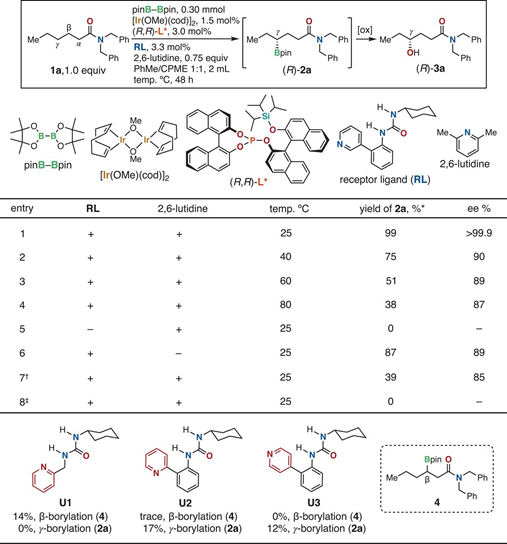
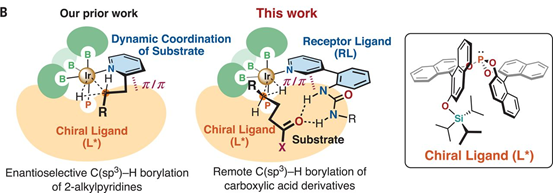
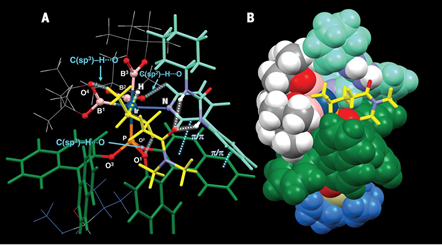
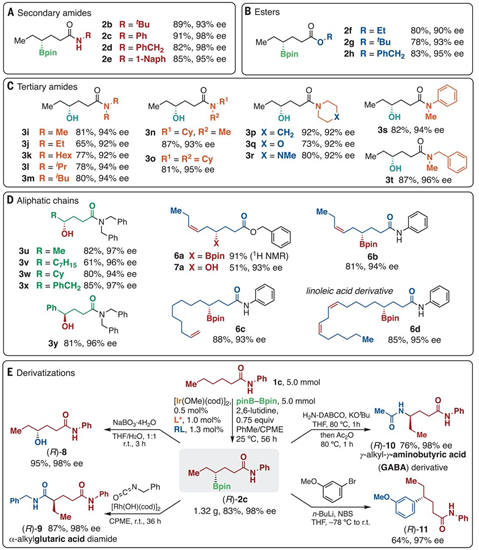
1.設計類酶工作原理C-H鍵活化催化劑,具體為Ir金屬和手性膦配體、手性脲-吡啶配體組成。2.對羰基官能團物種γ-位點上的C-H鍵選擇性構建手性C-B鍵。脂肪酸是自然界中基礎和廣泛存在的化合物和化學品,通過金屬催化劑對飽和C(sp3)-H化學鍵能夠直接獲得大量高附加值的產品。目前通過金屬螯合策略能夠通過形成5元/6元金屬環中間體對β-C(sp3)-H、γ-C(sp3)-H化學鍵進行活化。但是,現有的γ-C(sp3)-H活化反應中通常只能對端基CH3活化,對非端基位點-CH2-型γ-C(sp3)-H化學鍵仍沒有合適的反應方法。探索對羰基化合物中γ位點C-H鍵活化的普適、高效方法。在C-H化學鍵功能團化反應中,位點選擇性、立體結構控制仍具有較大挑戰,特別是在合成鏈狀脂肪飽和碳氫化合物分子中。有鑒于此,北海道大學Masaya Sawamura等報道了對二級/三級脂肪基酰胺、酯分子的羰基γ-位C-H鍵進行選擇性活化反應,該合成策略中通過一種手性Ir催化劑進行,該催化劑與單個亞磷酸配體、手性脲-吡啶受體配體配位,并且和頻那醇硼烷配位,人工構成類酶結構催化反應中心,控制反應位點和手性選擇性。量子化學計算結果顯示,該催化劑具有一種類酶空腔結構,能夠通過多重非共價相互作用與底物結合。該合成策略能夠實現合成大量對映結構γ-硼基羧酸衍分子。反應優化。如圖2所示,將N,N-雙芐基己酰胺(1a)、等比例量的B2Pin2作為反應物,加入0.75倍量的2,6-二甲基吡啶作為添加劑。加入1.5 mol % [Ir(OMe(cod)2]2、3 mol %配體(R, R)手性結構的單亞磷酸配體L*、3.3 mol %手性脲-吡啶受體配體(RL)組成催化體系。在甲苯/環戊基甲基醚(1:1)混合溶劑和25 ℃中進行反應,在48 h中實現了將原料以達到99 %的產率和>99.9 %e.e.選擇性得到γ-位點修飾BPin的產物(2a)。隨后將γ-位點修飾BPin的手性產物進一步通過NaBO3·4H2O在THF/H2O(1:1)混合溶劑中于室溫條件氧化反應3 h,得到γ-位點修飾OH的產物(3a)。如圖3所示,結合在Ir(BPin)3上的脲-吡啶受體配體RL中的N-H和羰基底物分子中的羰基形成C–H···O氫鍵,同時RL配體中的吡啶通過π-π相互作用識別配體單亞磷酸配體中的萘環,通過這種復雜配位,組成了一種類酶結構的空腔位點。作者在之前的工作中通過計算化學預測發現,該類催化劑的配位環境能夠有效的在γ位點進行C-H鍵活化。控制反應結果顯示,當反應中不加入RL配體時無法進行C-B構建;當反應中不加入2,6-二甲基吡啶,產率和對映選擇性無法保持。并且RL的量需要控制,當RL的量增加到6 mol %,對映選擇性無法保持。作者通過N,N-二甲基戊酰胺作為底物,通過量子化學計算方法模擬反應中的過渡態,優化后的結果如圖4所示,脲中的氫鍵形成在Ir邊緣凹槽底部,并且單亞磷酸配體L*中的一個萘環同RL中的吡啶基團產生π-π相互作用,同時RL鄰亞苯基同樣和L*產生π-π相互作用。通過以上氫鍵、非共價作用的π-π鍵作用,構建了類酶結構的Ir中心催化位點。底物拓展。對脂肪酸衍生二級酰胺物種(叔丁基、苯基、芐基、萘基)、酯(乙基、叔丁基、芐基)、三級酰胺物種都有一定的兼容性,能夠實現較高的收率,同時對映選擇性>90 % ee。得到的γ-BPin修飾的羰基產物分別能夠氧化為OH、還原為C-H、乙基、苯基等,同時手性得以很好的保持。澤村正也(Masaya Sawamura), 日本有機化學家,現為北海道大學化學院教授,主要從事金屬有機化學研究。1989年于京都大學獲得博士學位,同年入職京都大學。1995年于東京工業大學升為副教授,2001年于北海道大學升為教授。研究領域包括:基底修飾型催化反應、納米尺度催化劑設計、Cu催化、烯丙基化催化等。https://wwwchem.sci.hokudai.ac.jp/~orgmet/index.php?id=25Ronald L. Reyes, Miyu Sato, TomohiroIwai, Kimichi Suzuki, Satoshi Maeda, Masaya Sawamura*. Asymmetric remote C–H borylation ofaliphatic amides and esters with a modular iridium catalyst, Science 2020, 369,970-974.DOI: 10.1126/science.abc8320https://science.sciencemag.org/content/369/6506/970