理想的抗癌免疫療法是通過控制免疫系統來有效地消滅惡性細胞。然而,癌癥疫苗的抗腫瘤效果仍然不高,部分原因是抗原和佐劑沒有足夠的運輸到免疫反應在時空上協調的地方。另一個主要障礙是,在所需的作用部位進行可控地釋放這些功能元件。盡管在這一領域已經取得了一些進展,但有效地提供精確劑量和按需釋放的疫苗是非常具有挑戰性的。
基于可編程分子系統的結構明確的遞送平臺的開發,為癌癥疫苗接種提供了巨大的潛力。一種最新發展的方法是合理設計和生產DNA納米結構,使其具有可控的尺寸、形狀和刺激響應的機械重構,作為精確分子傳遞的平臺。
成果簡介
鑒于此,國家納米科學中心丁寶全等人描述了一種利用基于DNA的納米技術來引發針對癌癥治療的強大的腫瘤特異性免疫應答的策略。即設計了一種DNA機器納米結構,既可以保護抗原/佐劑有效載荷免受細胞外核糖核酸酶的干擾,又可以介導其有效轉運至引流淋巴結(dLNs)。成果以題為“A DNA nanodevice-based vaccine for cancer immunotherapy”發表于Nature Materials上。

雜交載入貨物和pH響應鎖
研究人員制備了一個矩形的DNA折紙結構,然后在預定位置延伸三種不同的捕獲鏈,以進行載不同的貨物。
1)對抗原進行DNA修飾,然后與綠色的捕獲鏈進行DNA雜交組裝到矩形折紙上。
2)選擇了長度和分子量確定的dsRNA序列(TLR3激動劑)作為佐劑1,可識別DNA矩形上的捕獲鏈(藍色)并與之雜交。
3)還設計了一個包含三個CpG基序(TLR9激動劑)作為佐劑2的環結構,可與DNA矩形上的延伸捕獲鏈(橙色)雜交。
最后為了屏蔽抗原和佐劑,然后在矩形邊上加了一個DNA鎖鏈,根據特定的pH范圍執行鎖定和解鎖功能。
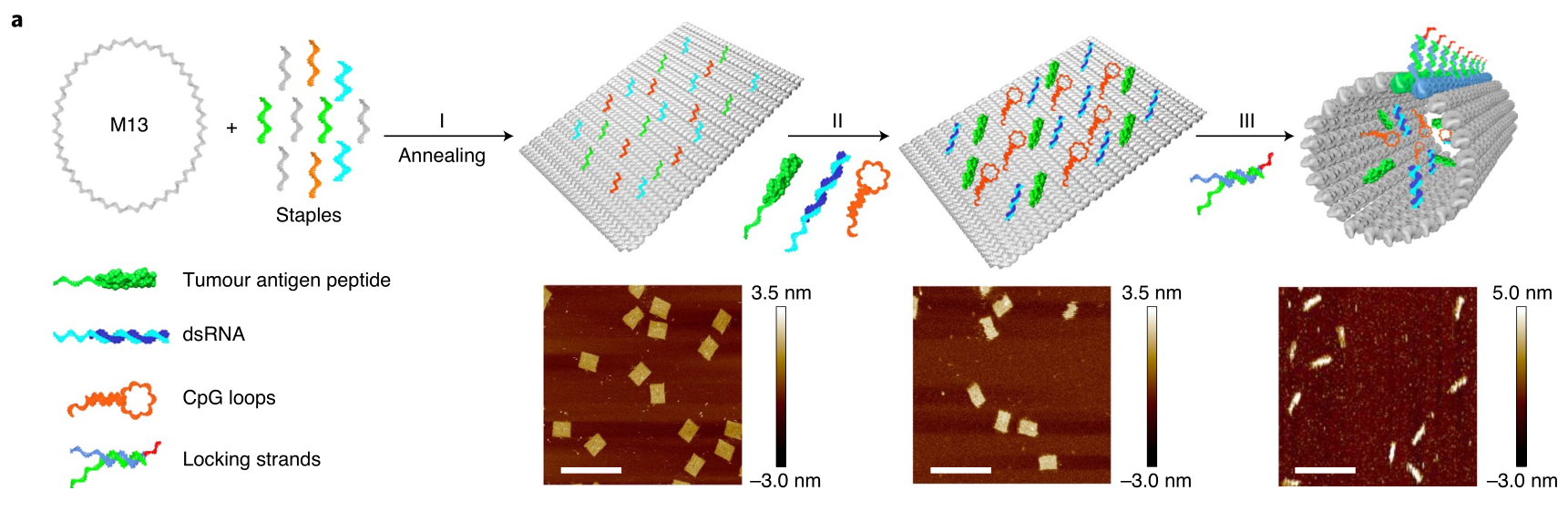
圖|抗原/佐劑功能化的DNA納米器件疫苗的設計和表征
所以,抗原(肽)和toll樣受體(TLR)激動劑(雙鏈RNA(dsRNA)和CpG-DNA)以精確控制的成分排列在DNA納米器件上。當定位在dLN抗原呈遞細胞(APCs)內時,由于共組裝pH響應性DNA鎖,納米器件在其亞細胞功能部位被觸發以機械地暴露抗原和佐劑,從而導致TLR通路激活和抗原肽呈遞。
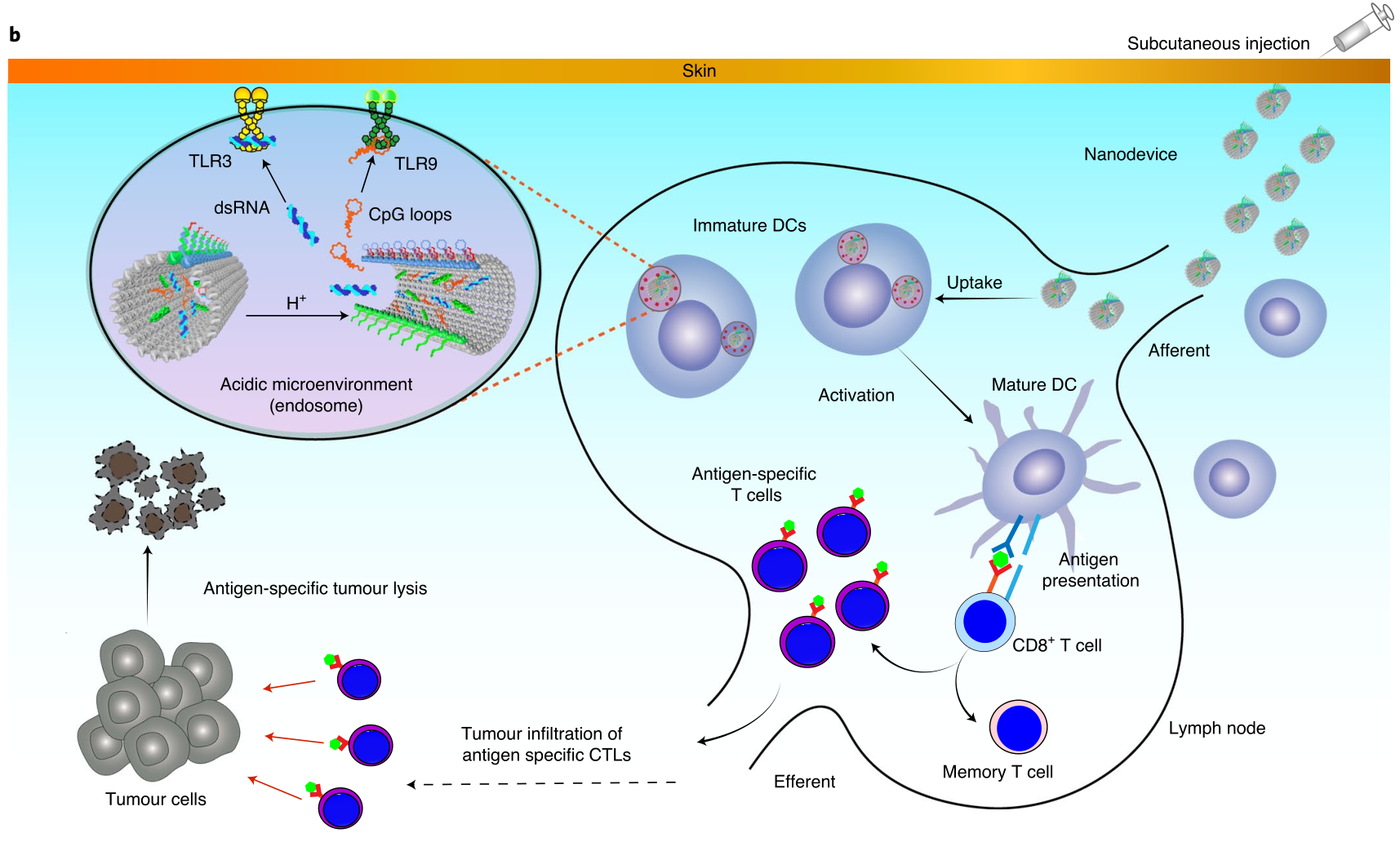
圖| DNA納米器件用于有效的癌癥免疫治療的示意圖
觸發納米器件的打開并增強APC激活
熒光標記和AFM測試結果表明納米器件可響應pH而打開。接下來,研究了打開的納米器件和納米管裝配方在體外對APC激活、DC激活以及抗原呈遞的影響。實驗數據表明,納米器件促進了抗原/兩種佐劑的胞內傳遞,機械地暴露內體中的有效負載以促進體外APC成熟和抗原呈遞。
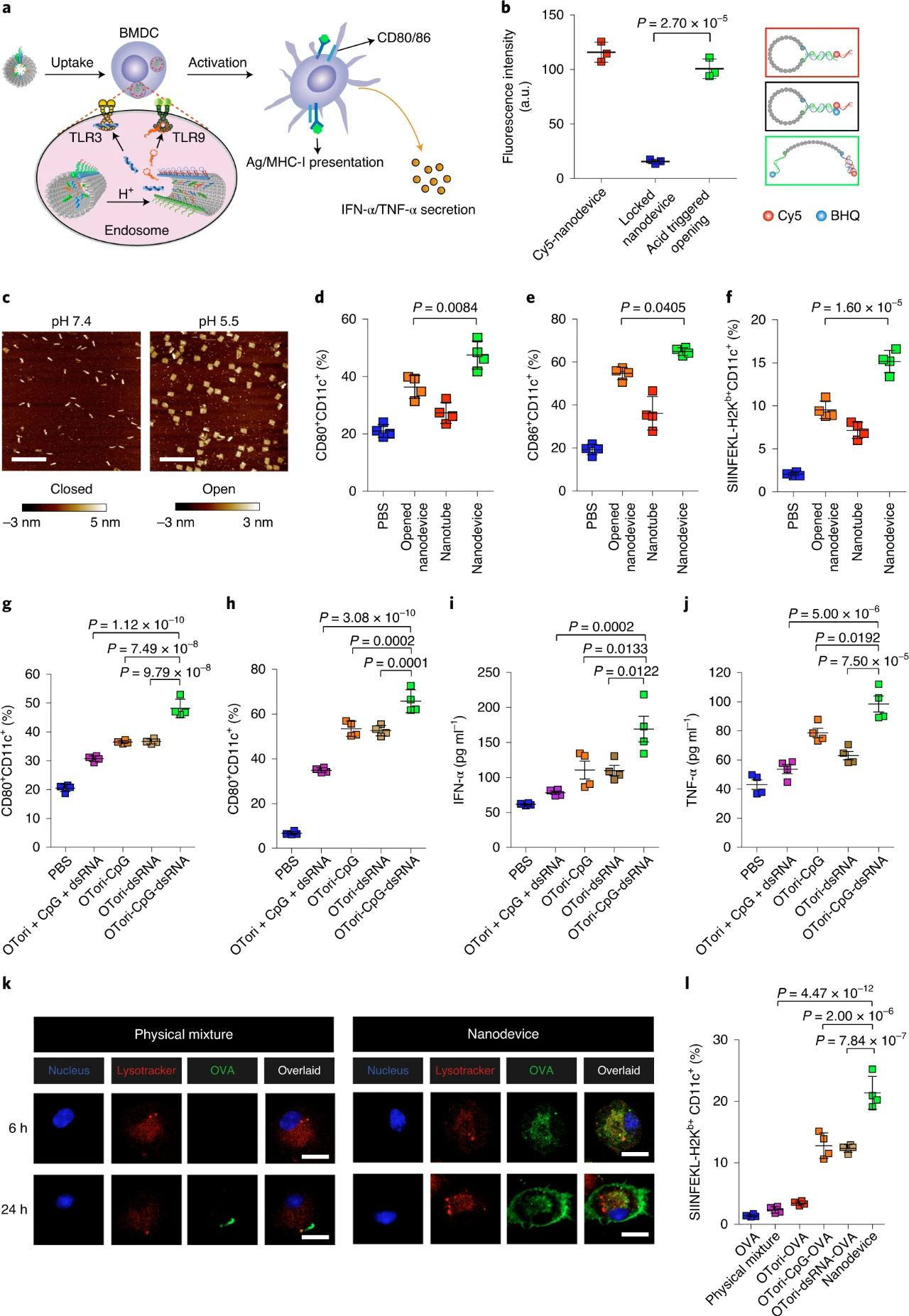
圖|納米器件疫苗向APCs的傳遞及觸發激活
體內dLN靶向和抗原特異性CTL反應
在評估體內淋巴遞送效果實驗中,體內淋巴結成像表明,在注射后24 h內,納米器件在dLNs中積累的效率是游離CpG鏈的約5倍,表明該納米器件促進了疫苗向dLNs的體內遞送。且與物理混合物組相比,用納米器件處理的小鼠的dLNs中CD80和CD86陽性DC的數量增加,OVA肽(SIINFEKL)呈遞DC的百分比也相對高。此外,兩次劑量的納米裝置疫苗接種引起的抗原特異性CD8+ T細胞富集度比物理混合組高45倍,可誘導了最高的OVA特異性脾細胞殺傷率(約75%),比物理混合物組引起的CTL反應高約30倍。這些結果表明,DNA納米器件有效地靶向淋巴組織,以誘導強大的腫瘤抗原特異性CTL反應。
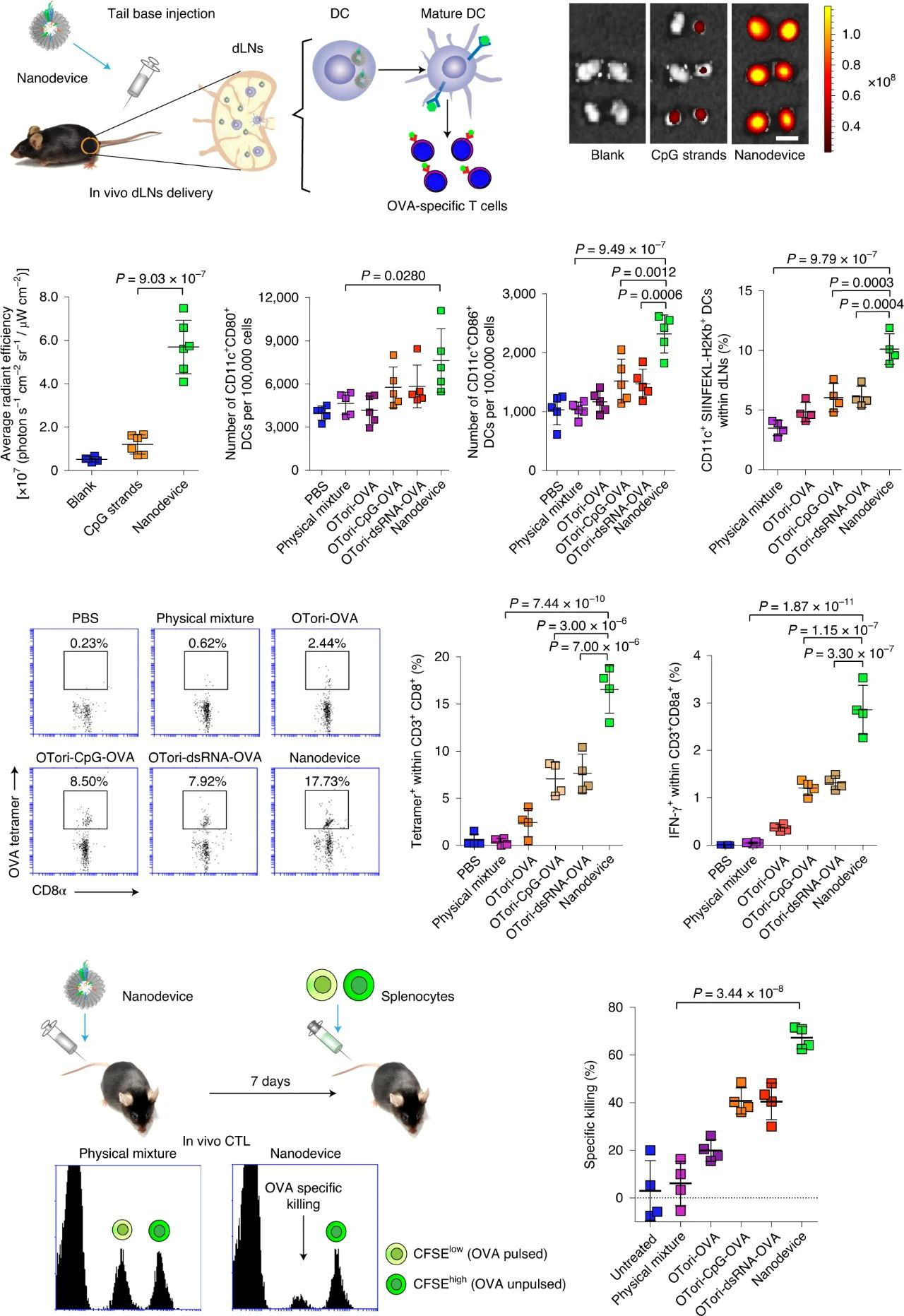
圖|納米器件的淋巴結靶向性及體內CTL反應的激發
抑制腫瘤生長和轉移
體內抑制腫瘤生長實驗中,納米器件疫苗接種產生了最大的治療效果,并導致小鼠體內不同程度的腫瘤消退,其中60%的動物存活超過40天。在肺部腫瘤轉移實驗中,用納米器件進行兩次免疫后,肺組織中沒有可觀察到的轉移灶。
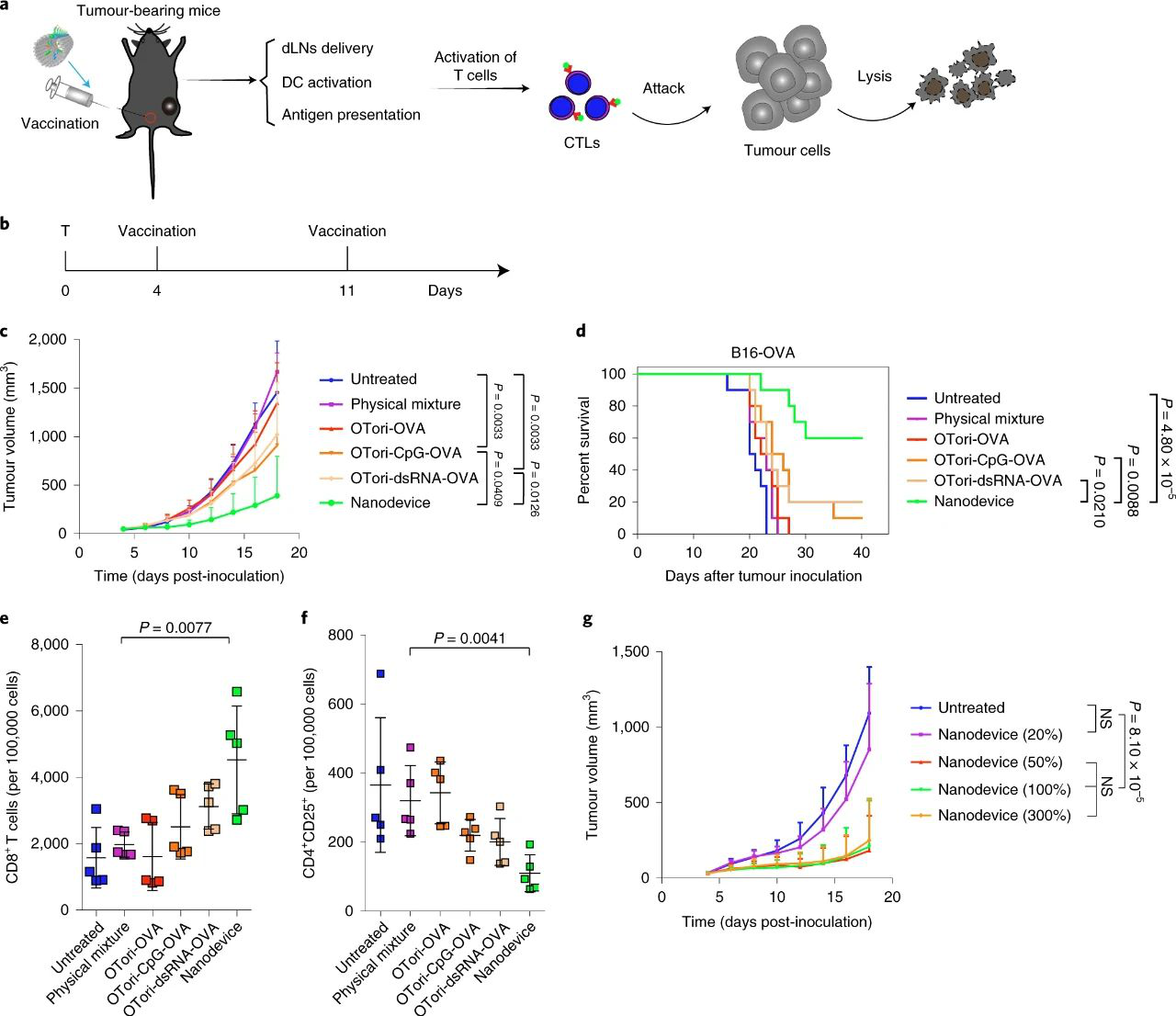
圖|納米器件疫苗抑制腫瘤生長,提高荷瘤小鼠的存活率
110天后還能繼續特異性保護!
另外,在已經消除了B16-OVA腫瘤的小鼠體內重新植入B16-OVA和B16F10腫瘤細胞,這時已經距離第一次接種癌細胞有110天了,觀察到這些小鼠中有100%拒絕了重新接種的B16-OVA細胞,而B16F10腫瘤會隨著時間逐漸形成,這表明納米器件提供的保護是OVA特異性免疫應答,而且可以產生針對特定腫瘤抗原的持久免疫記憶。
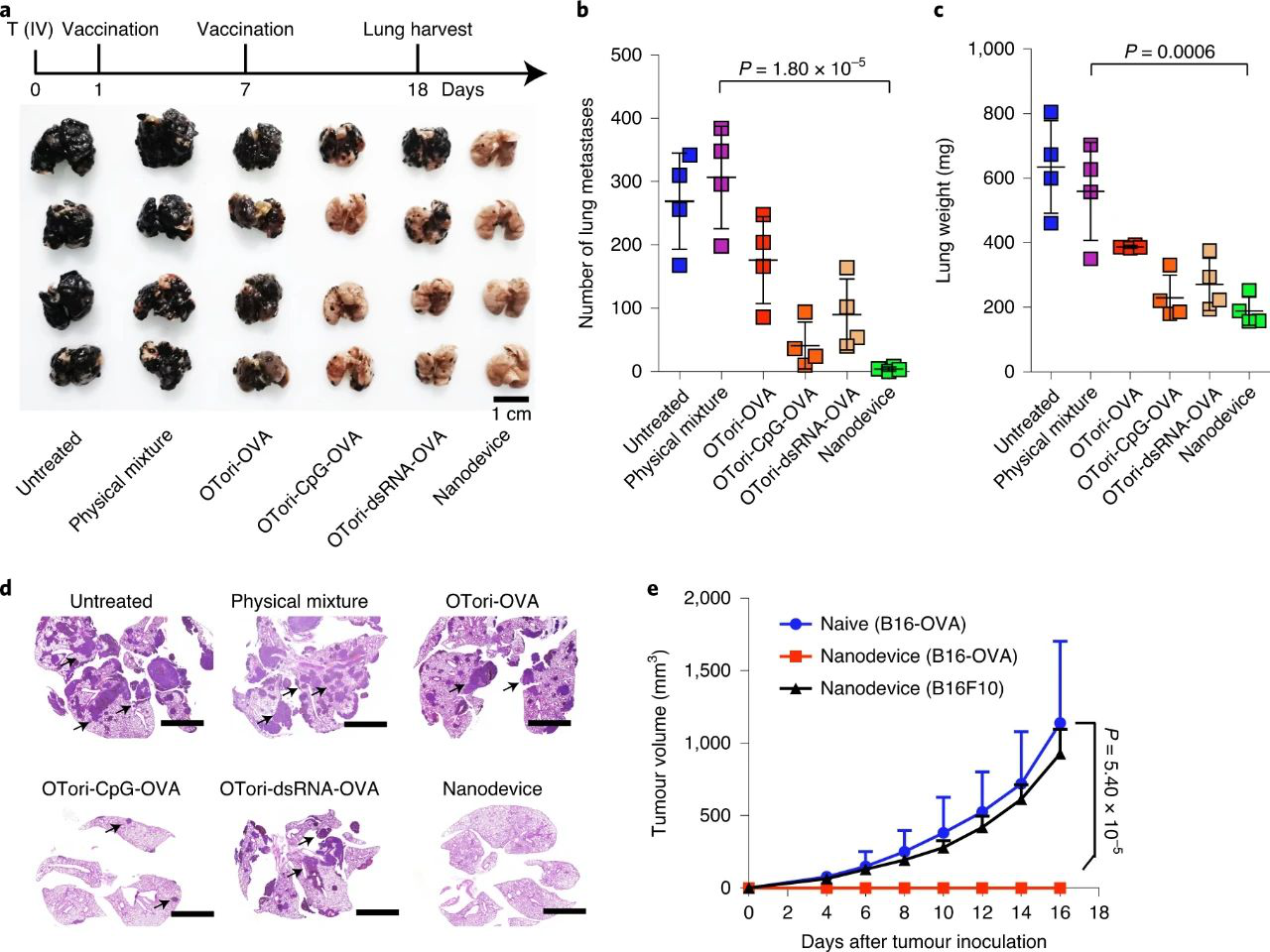
圖|納米器件疫苗抑制腫瘤轉移和復發
小結
綜上所述,該課題組開發了一種基于DNA納米器件的癌癥免疫治療疫苗,以有效抗擊腫瘤生長、轉移和復發。該DNA納米器件疫苗以驚人的但可控制的免疫原性精確組裝抗原和佐劑,減少了由于非特異性遞送TLR激動劑而引起的不良反應。
可以通過大量生產DNA折紙結構來大大降低折疊式DNA納米器件的成本,從而可以進行未來的臨床研究。該DNA納米器件可能會激發更多納米平臺的設計,以有效地共同遞送和控制釋放多種治療性貨物,從而實現安全有效的聯合治療。刺激響應性納米器件系統也可以為生產個性化的癌癥疫苗開辟一條道路。
參考文獻:
Liu, S., et al. A DNA nanodevice-based vaccine for cancer immunotherapy. Nat. Mater. (2020).
https://doi.org/10.1038/s41563-020-0793-6
簡介:
丁寶全,2000年畢業于吉林大學化學系獲學士學位。2006年9月在美國紐約大學化學系獲博士學位,導師Nadrian C. Seeman 教授。其后在美國勞倫斯伯克利國家試驗室進行博士后研究,合作者為 Jeffrey Bokor 教授。2009年10月到2010年10月在亞利桑那州立大學作研究助理教授,合作者Hao Yan教授。2010年11月進入國家納米科學中心,被評為博士生導師。
研究工作包括:
1)核酸及多肽等生物大分子自組裝體系,包括DNA自組裝結構的合理設計及其與多種納米材料復合結構的可控制備與性能研究。
2)可控組裝復合生物納米材料的功能探索,包括藥物遞送、生物催化及納米光子電子學等領域的應用。











