具有中空多殼結構(HoMSs)的新興功能材料可提供充足的質量負載能力,并有利于質量傳輸,從而在太陽能電池、鋰離子電池、光催化等領域獲得廣泛應用。更重要的是,HoMSs有一個獨特的結構,有多個空腔和多級多孔殼,這很好地優化了質量傳輸和暴露的有效面。
最近研究表明,在物質通過殼層擴散的過程中,HoMSs具有嚴格遵循時間和空間順序的獨特質量傳輸特性。
理想的抗菌系統需要滿足以下要求:
1)以抑菌處理或殺菌所需的濃度將抗生素快速釋放到環境中;
2)長時間保持該濃度以防止細菌再生;
3)外來病原體的自動檢測和保留抗生素的自反應釋放。
在這種情況下,可以預測,使用HoMSs作為抗菌劑的藥物載體將顯示出一些意想不到的優勢。
成果簡介
有鑒于此,中國科學院過程工程研究所張鎖江院士、王丹研究員等人受活細胞中不同傳輸形式的啟發,詳細研究了HoMS中的物質傳輸過程,設計并制備了TiO2中空多殼結構,實現了三階段的藥物有序釋放。

第一作者:Decai Zhao
通訊作者:張鎖江院士,王丹研究員
通訊單位:中國科學院過程工程研究所
研究亮點:
1)設計并制備了TiO2中空多殼結構;
2)將MIT負載進中空多殼結構中,研究其藥物釋放過程;
3)提出了三階段的藥物有序釋放原理。
研究人員在將抗菌劑甲基異噻唑啉酮(MIT)作為模型分子引入HoMS后,發現在一個系統中有三個順序釋放階段,即突發釋放、持續釋放和刺激響應釋放。同時,HoMS系統提供了一個智能響應釋放機制,可以由環境變化觸發。上述發現為智能納米材料的設計提供了一條新途徑。
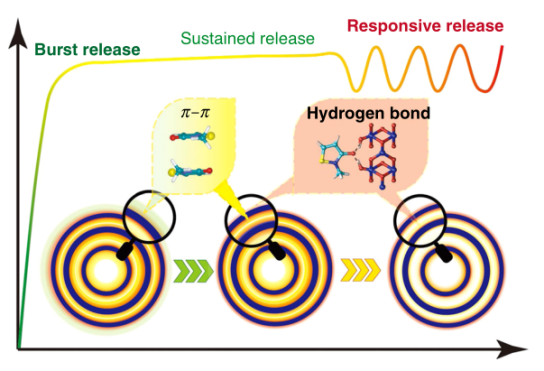
圖1. HoMS空間調控藥物釋放示意圖。
01. 合成MIT–TiO2–HoMS
通過調節金屬離子的吸附條件,通過順序模板法制備了不同殼數的TiO2–HoMS,然后通過典型的載藥過程加載MIT。透射電子顯微鏡(TEM)圖像(圖2a)顯示制備了具有不同殼數的各種樣品。
基于對每個樣品的100多個TiO2–HoMS樣品顆粒的統計分析,TiO2空心球和雙殼(2s-)和三殼(3s-)TiO2–HoMS樣品的平均尺寸估計分別為726±47nm、642±30nm和583±35nm,具有尺寸分布較窄。MIT-3s-TiO2–HoMS的TEM-EDX圖譜顯示,硫均勻分布在TiO2–HoMS的外殼上,表明藥物負載均勻(圖2c,d)。
02. HoMS中的MIT分析吸附
在不同的MIT加載時間后,收集傅里葉變換紅外光譜(FTIR)(圖2e),以研究MIT和TiO2–HoMS之間的相互作用。MIT-3s-TiO2–HoMS在714、1418、1618和1640cm-1處的FTIR譜峰可分別歸因于MIT中的C-S(拉伸)、CH3(彎曲)、C=C和C=O(拉伸)(圖2e)。有趣的是,隨著載藥期的延長,觀察到C=O拉伸帶紅移,表明在MIT加載期間有不同的吸附模式(圖2f)。
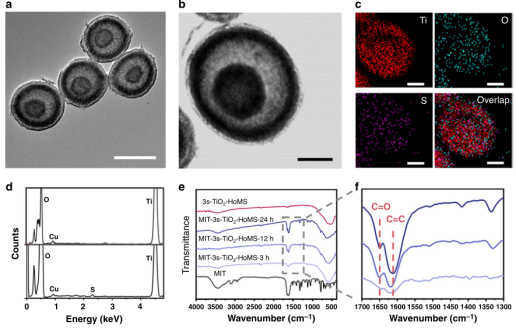
圖2. 負載MIT后TiO2–HoMS的表征。
如熱重分析和差熱分析結果(圖3a-e)所示,通過二氧化鈦空心球和2s-和3s-TiO2–HoMS的MIT的熱釋放發生在三個階段。
1)第一階段發生在約50℃,重量損失約5%,并伴隨著吸熱過程,這對應于水在該MIT-TiO2系統中的蒸發。
2)第二階段在70–150℃范圍內,這對應于負載在HoMS外殼外部的MIT和外殼之間空腔中的MIT的解吸。
3)第三個階段發生在150℃之后,與通過氫鍵與TiO2–HoMS殼層牢固結合的少量MIT的解析有關。
值得注意的是,純MIT的差熱分析曲線的第二個峰在150℃,而在MIT分別被加載到TiO2空心球和2s-和3s-TiO2–HoMS之后,峰溫度分別下降到126、127和130℃(圖3f)。
此外,根據Speil理論,吸熱的相對值可以通過對差熱分析曲線積分,然后歸一化為MIT的質量來計算(圖3g)。對于MIT、MIT-TiO2空心球和MIT-2s-TiO2-HoMS和MIT-3s-TiO2-HoMS,相對值分別為65.28、43.01、43.38和43.57 kJ·mg-1。可以注意到,在將MIT加載到HoMS之后,分子釋放需要較小的驅動力。對于TiO2空心球和2s-和3s-TiO2-HoMS,MIT的負載能力分別為0.2274、0.3000和0.3292(以二氧化鈦的重量為標準)。
這一結果表明,在單個空心顆粒中增大表面積有助于藥物吸附。在這種情況下,殼層數量的增加提高了負載藥物的能力,證明HoMS是大量負載的一個很好的候選者。
值得注意的是,當使用SBA-15作為載體時,在標準化為SiO2的重量之后,比使用TiO2作為載體獲得的值高(圖3h). 然而,由于3s-TiO2-HoMS的有效表面積大得多,3s-TiO2-HoMS的比表面積負載能力(圖3i)出人意料地比SBA-15高46.5倍。因此,基于Freundlich模型,MIT在TiO2-HoMS上的吸附可視為多分子層吸附。

圖3. MIT分子在HoMS中的吸附、解吸和擴散。
03. 有序藥物釋放
以抗菌MIT的釋放為模型,通過紫外-可見分光光度計(UV-Vis)跟蹤物質釋放表現。MIT的釋放過程大致分為三個階段(圖4a)。在MIT-載體復合物進入溶液后,在第一階段(約4h)觀察到藥物濃度快速增加,這被稱為突發釋放。隨后,質量釋放速度減慢,在第二階段,MIT濃度保持穩定,這就是所謂的持續釋放。2s和3s-TiO2–HoMS和SBA-15都有能力在第二階段保持濃度(圖4a)。值得注意的是,當攜帶相同的藥物量時,當我們不斷地將細菌引入系統時,發現3s-TiO2-HOMs在抑制大腸桿菌生長方面是最有效的,甚至在432 h后也能抑制細菌生長(圖4b)。所呈現的熒光圖像顯示,在第10天,對于MIT、MIT負載的TiO2空心球、MIT-2s-TiO2-HOMS、MIT-3s-TiO2-HOMS和MIT-SBA-15,細菌存活率分別為66%、58%、33%、0%和11%(圖4c)。
有趣的是,這種刺激反應釋放,即順序釋放的第三階段,是HoMS系統的一個獨特特征。在MIT的濃度穩定在約60 ppm(略高于最小抑制濃度(MIC))且各種樣品的總藥物量相同后,向溶液中加入細菌以研究響應釋放性能。2s-和3s-TiO2-HoMS和SBA-15均表現出響應釋放性能,即在MIT濃度快速下降后,平衡逐漸恢復。3s-TiO2–HoMS在所有樣品中表現出最佳的恢復性能,并在添加細菌14輪后保持了超過最低抑菌濃度的濃度。
令人印象深刻的是,不同樣品的恢復過程是不同的。在加入相同數量的細菌的情況下,3s-HoMS顯示出比2s-HoMS(17.3%)更小的下降(9.8%)(圖4f),表明在刺激條件下,保留在3s-HoMS中的MIT分子更容易釋放。相比之下,負載了MIT的TiO2空心球和MIT不顯示響應釋放的能力(圖4e)。負載MIT的SBA-15具有良好的緩釋性能,然而,其響應釋放不如3s-TiO2-HoMS。SBA-15在添加細菌后顯示出18.1%的最大下降(圖4f),并且它在恢復階段甚至在20h后也不能達到初始濃度。
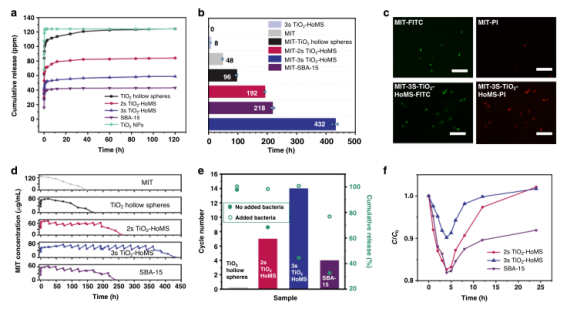
圖4. MIT釋放和抗菌性能。
小結
總之,成功合成了TiO2–HoMS樣品,并將其用作智能藥物載體。通過使用抗菌劑MIT作為模型分子,獲得了極好的持續釋放表現。在相同條件下,MIT-3s-HoMS系統的相應抗菌持續時間,比不含HoMS的純MIT系統長近8倍。HoMS中相對隔離的空腔和分級孔,導致空間中不同的化學和物理環境,引起各種形式的藥物負載和暫時有序的藥物釋放。同時,系統存在一種智能且有效的刺激反應釋放。在HoMS體系中,由三個釋放階段組成的順序釋放,為未來智能納米材料的設計提供了一條途徑。
參考文獻:
Decai Zhao, et al. Sequential drug release via chemical diffusion and physical barriers enabled by hollow multishelled structures, Nature Communications, 2020.
DOI: 10.1038/s41467-020-18177-2
https://www.nature.com/articles/s41467-020-18177-2











