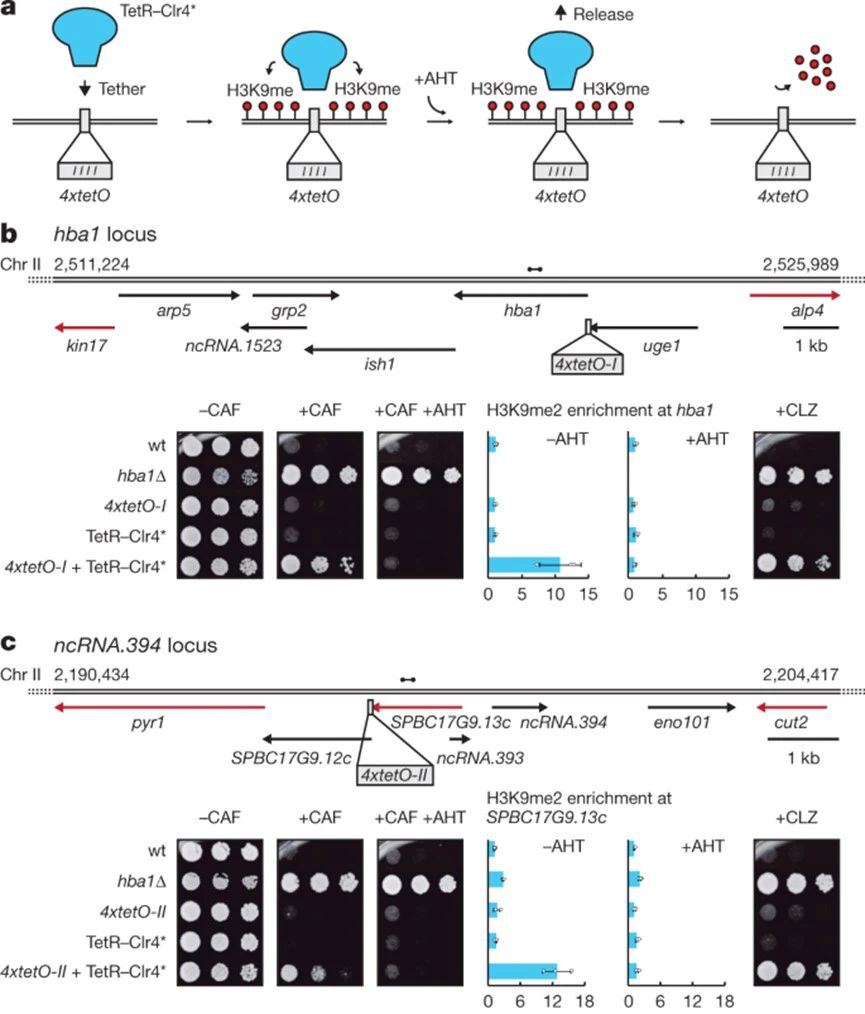
1953年,沃森和克里克發現了DNA雙螺旋的結構,從那以后開啟了分子生物學時代,使遺傳學的研究深入到分子層次,幫助科學家們解開了一個又一個生命的奧秘。1982年,Nadrian Seeman首次提出DNA納米技術的概念。自此以后,全球科學家致力于利用DNA的結構特性來進行構建和涉及復雜的納米結構材料。當今世界,DNA納米技術在生物醫學、傳感、分析等領域帶來了許多新的突破,近日,國家納米科學中心、上海交通大學、亞利桑那州立大學以及澳大利亞莫納什大學等研究團隊連續報道了DNA納米技術相關進展。除此之外,英國愛丁堡大學也在Nature發表了關于DNA與耐藥性的研究成果。現摘錄如下,請相關領域的科研人員交流學習。依賴組蛋白H3第9位賴氨酸甲基化(H3K9me)的異染色質能夠使基因轉錄沉默。在裂殖酵母中,H3K9me異染色質可以通過細胞分裂進行傳播,前提是不存在抵消性去甲基酶Epe1。異染色質的遺傳力可能使得野生型細胞在一定條件下獲得表觀突變,即通過不穩定的基因沉默而不是DNA改變來影響表型。有鑒于此,英國愛丁堡大學的Robin C. Allshire等研究人員發現異染色質介導的表觀基因沉默可導致真菌耐藥。在咖啡因閾值水平下生長的裂殖酵母產生了對咖啡因具有抗性的異染色質依賴性表觀突變體。具有不穩定抗性的分離菌具有明顯的異染色質島,其嵌入基因的表達降低,包括一些突變賦予咖啡因抗性。在相關位點強制形成異染色質證實了耐藥性是由異染色質介導的沉默引起的。這些分析表明,表觀遺傳過程促進表型可塑性,使野生型細胞適應不利的環境而無需遺傳改變。在某些分離菌中,隨后或同時發生的基因擴增事件會增加抗藥性。咖啡因影響兩個抗沉默因子,Epe1被下調,減少其染色質結合,并且表達了Mst2組蛋白乙酰轉移酶縮短的同工型。因此,異染色質依賴性表觀突變提供了一種對沖策略,使細胞能夠暫時適應損傷,同時保持遺傳野生型。咖啡因耐藥性不穩定的分離株對抗真菌劑表現出交叉耐藥性,進而表明相關的異染色質依賴性過程可能有助于植物和人類真菌病原體對此類試劑的耐藥性。Sito Torres-Garcia, et al. Epigenetic gene silencing by heterochromatin primes fungal resistance. Nature, 2020.DOI:10.1038/s41586-020-2706-xhttps://www.nature.com/articles/s41586-020-2706-x

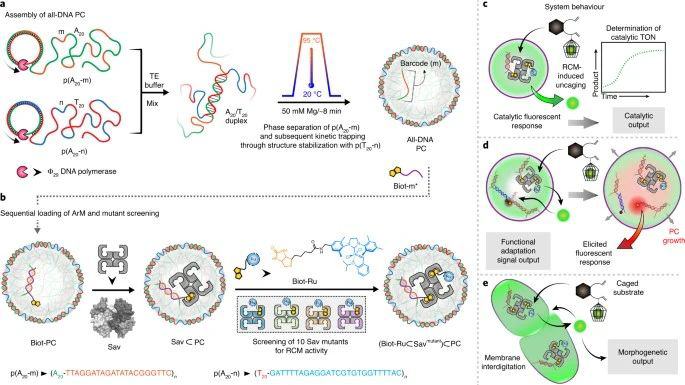
對于生命的出現,催化反應在原生細胞環境中的限制被認為是在空間中調節化學活性的一個決定性方面。今天,細胞和生物體通過反應網絡來處理信號,最終提供下游功能反應和結構形態形成。在新設計的原始細胞中重現這樣的信號處理是一個深刻的挑戰,但對于理解具有生命特征的自適應系統的設計非常重要。有鑒于此,德國弗萊堡大學的Andreas Walther和瑞士巴塞爾大學的Thomas R. Ward等研究人員,報道了含有人工金屬酶的工程全DNA原細胞,其烯烴化生活性導致下游形態發生原細胞反應具有不同程度的復雜性。
人工金屬酶催化前熒光信號分子的分泌,產生一種自我報告的熒光代謝物,旨在削弱DNA雙鏈相互作用。這導致了顯著的生長,在熒光DNA機械傳感器或粒子間原細胞融合存在的關節內功能適應。這種過程模擬了細胞適應和細胞間黏附的化學傳導過程。
本文的概念展示了通過合成原始細胞中的非生物生物正交化學和機械轉化來研究逼真的行為的新機會。此外,它揭示了一種在適應性和溝通性的軟物質微系統中誘導復雜行為的策略,并闡明了如何在微隔室化介質中上調和維持動態特性。

參考文獻:
Avik Samanta, et al. Functional and morphological adaptation in DNA protocells via signal processing prompted by artificial metalloenzymes. Nature Nanotechnology, 2020.
DOI:10.1038/s41565-020-0761-y
https://www.nature.com/articles/s41565-020-0761-y
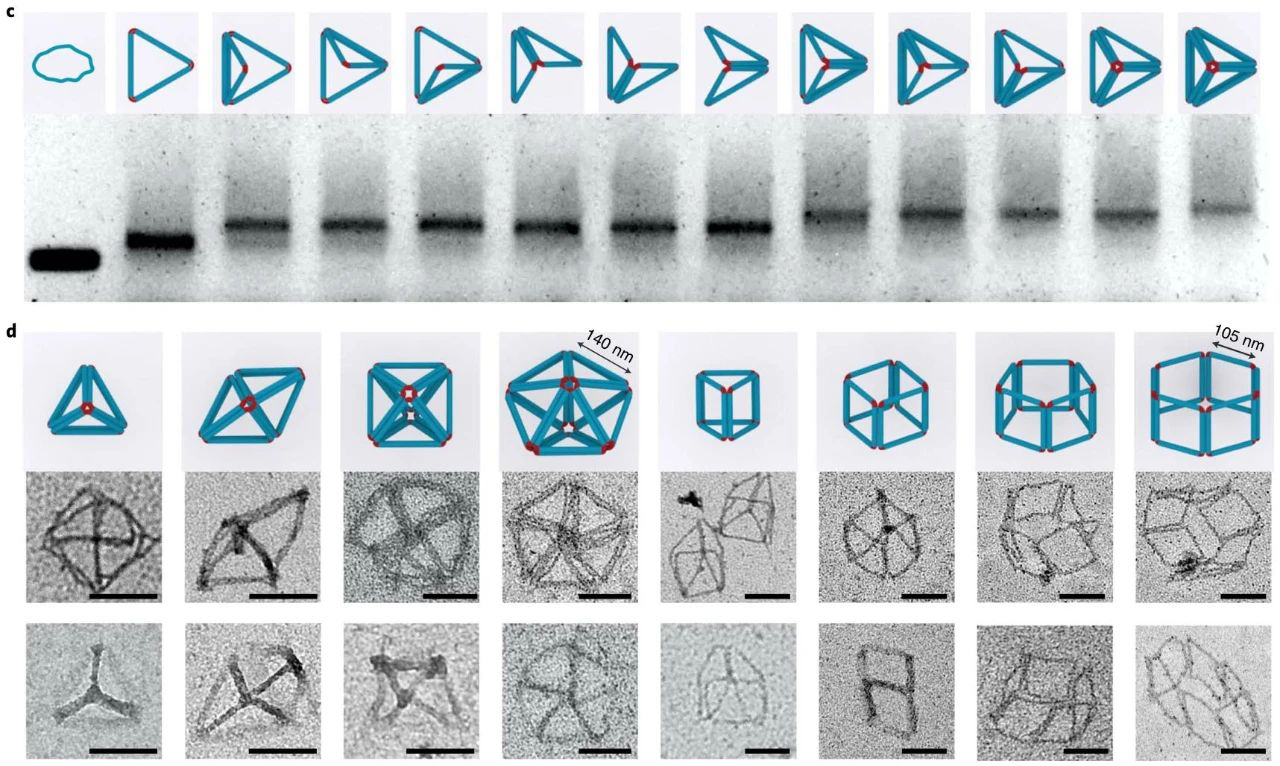
1. Nature Chemistry:新型DNA折紙,改變DNA納米技術世界!據報道,有兩種策略可以構建微米級的DNA結構。一種方法是以支架為原始材料繼續增大成更大的DNA折紙。另一種方法是使用粘性末端內聚或平末端堆疊將單個折紙結構連接在一起。每一個微米級的DNA結構通常需要一個或幾個不同大小、形狀和規定的匹配規則的獨特DNA折紙。但是,目前想要組裝具有可編程特性的更大尺寸(微米到毫米級別)的DNA結構仍然具有挑戰性。這限制了DNA折紙在光電子學(例如,超材料)和合成生物學(例如,人工細胞)中的應用。那能否先構建一個多功能的亞微米的3D構建塊,從而進一步構建出微米尺度的DNA物件呢?有鑒于此,美國亞利桑那州立大學顏灝教授、上海交通大學樊春海院士等人開發了一種通用的“元DNA”(M-DNA)策略,該策略允許各種亞微米到微米大小的DNA結構以類似于在納米級水平上簡單的短DNA鏈自組裝的方式進行自組裝。研究人員僅使用一種類型的DNA單元即可構建各種各樣的靜態和動態亞微米和微米尺度的DNA結構,這將打開光電子學(包括信息存儲和加密)以及合成生物學領域。據悉,2018年,顏灝教授和樊春海教授曾于合作了關于以DNA折紙為模板制備復雜二氧化硅復合納米材料,發表在Nature期刊上。圖|自折疊、自連接的M-DNA結構和自組裝的3D多面體Yao, G., et al. Meta-DNA structures. Nat. Chem. (2020). https://doi.org/10.1038/s41557-020-0539-82. Nature Materials:基于DNA器件的納米疫苗,為癌癥免疫治療提供新思路!
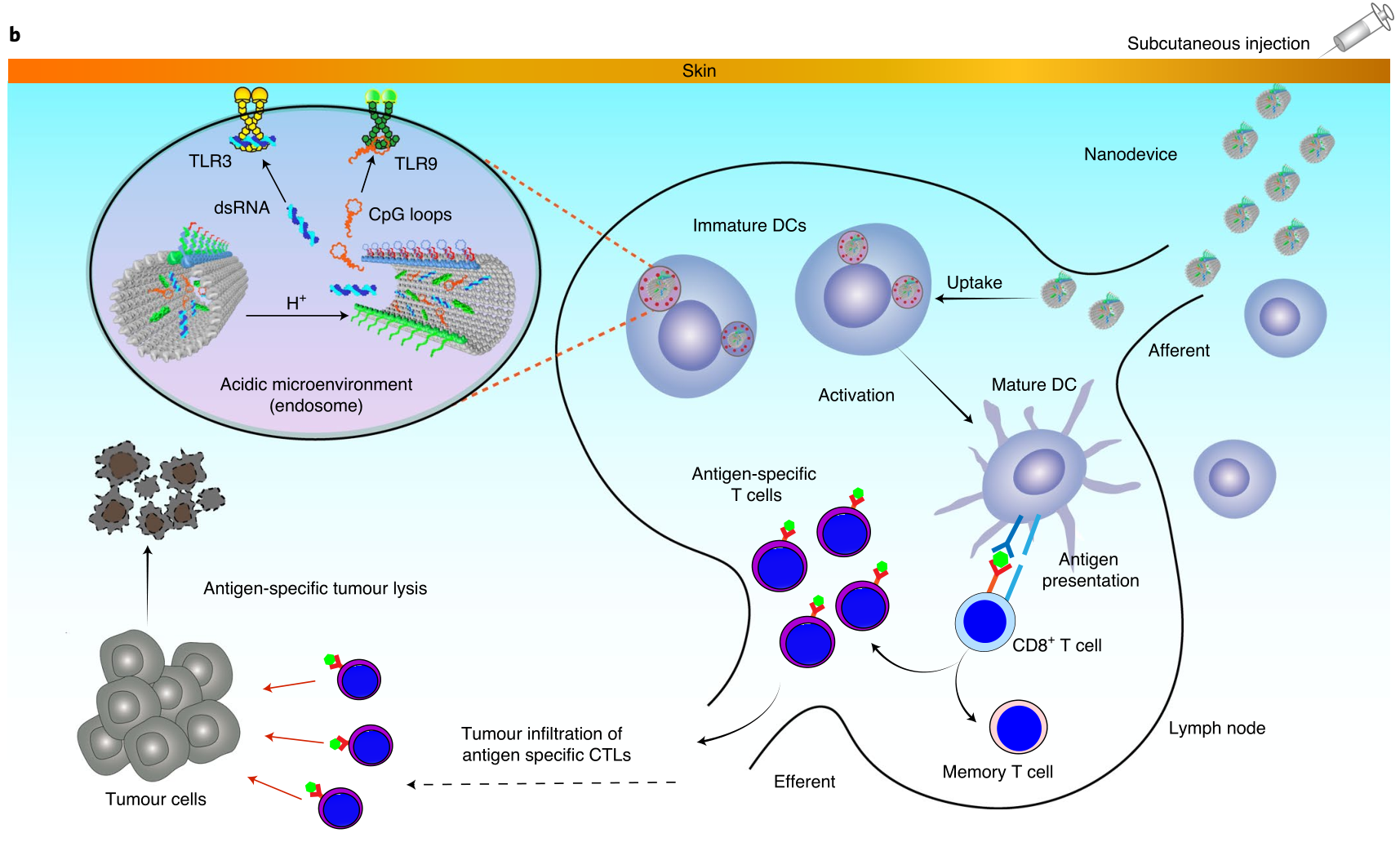
基于可編程分子系統的結構明確的遞送平臺的開發,為癌癥疫苗接種提供了巨大的潛力。一種最新發展的方法是合理設計和生產DNA納米結構,使其具有可控的尺寸、形狀和刺激響應的機械重構,作為精確分子傳遞的平臺。鑒于此,國家納米科學中心丁寶全等人描述了一種利用基于DNA的納米技術來引發針對癌癥治療的強大的腫瘤特異性免疫應答的策略。即設計了一種DNA機器納米結構,既可以保護抗原/佐劑有效載荷免受細胞外核糖核酸酶的干擾,又可以介導其有效轉運至引流淋巴結(dLNs)。圖| DNA納米器件用于有效的癌癥免疫治療的示意圖Liu, S., et al. A DNA nanodevice-based vaccine for cancer immunotherapy. Nat. Mater. (2020). https://doi.org/10.1038/s41563-020-0793-6

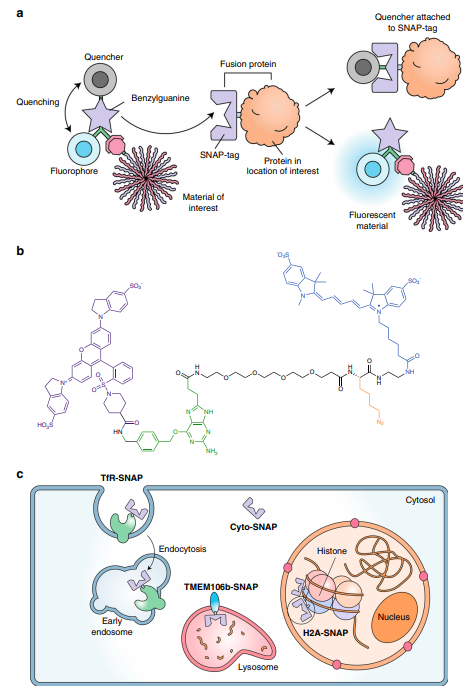
3. Nature Commun.:可定量蛋白質、DNA和納米粒子在細胞中定位的分子傳感器細胞內轉運控制著受體信號傳導、發病機制、免疫反應和納米藥物的命運,這些過程通常是通過使用共聚焦顯微鏡觀察熒光標記物的共定位來跟蹤的。然而,這種方法吞吐量低,受顯微鏡分辨率的限制,可能會錯過短暫的相互作用。為了解決這一問題,澳大利亞莫納什大學Angus P. R. Johnston等人開發了一種由淬滅的SNAP-tag底物(SNAPSwitch)組成的定位傳感器,其可通過點擊化學反應與生物分子結合。通過SNAPSwitch可以使用流式細胞儀對活細胞內目標位置的運輸進行定量檢測。利用SNAPSwitch,跟蹤了DNA復合物從內體進入胞漿和細胞核的運輸過程。研究發現,抗轉鐵蛋白或透明質酸受體的抗體在內吞作用后最初被分成不同的隔室。此外,通過此方法還可以分辨細胞膜材料位于哪一側。Laura I. FitzGerald, et al. A molecular sensor to quantify the localization of proteins, DNA and nanoparticles in cells. Nat. Commun., 2020.DOI: 10.1038/s41467-020-18082-8https://doi.org/10.1038/s41467-020-18082-8