

第一作者:Michael M. Yamano, Andrew V. Kelleghan, Qianzhen Shao(共同一作)
通訊作者:K. N. Houk, Neil K. Garg
通訊單位:加州大學洛杉磯分校
研究亮點:
1.對高能量環狀結構聯烯中間體的反應控制。
2.Ni基非貴金屬手性催化。
3.擴展了聯烯中間體的反應類型。
研究背景
在有機化學反應中,反應位點、產物立體構型都需要設計和控制。特別是在反應中間體物種的能量較高時,反應產物立體構型的控制就更有挑戰性。芳烴,環狀炔烴和環狀烯等高應力環狀有機分子受到化學家的廣泛關注,這種環結構中具有高應力(30~50 kcal/mol),因此此類瞬態中間體物種在包括環加成、親核捕獲等多種反應中展現出非常高的反應活性,并且能得到結構復雜產物。
近日,有機合成大師Houk等在Nature上報道了通過環狀鄰位SiEt3修飾的烯烴作為反應物,在Ni催化體系中實現了對烯烴的高張力環狀聯烯中間體在鄰位進行環化。進一步的,通過調控手性配體環境、反應速率等實現了手性合成。
擬解決或者擬探索的關鍵問題
探索高能量聯烯中間體物種的手性成環反應。
成果簡介
雖然目前在此類反應中,控制反應的絕對立體結構能夠通過化學計量比的手性試劑進行控制,但是催化量不對稱合成仍未見相關報道。有鑒于此,加州大學洛杉磯分校K. N. Houk、Neil K. Garg等報道了通過瞬態環狀聯烯中間體實現了對手性反應產物中手性絕對構型的控制。
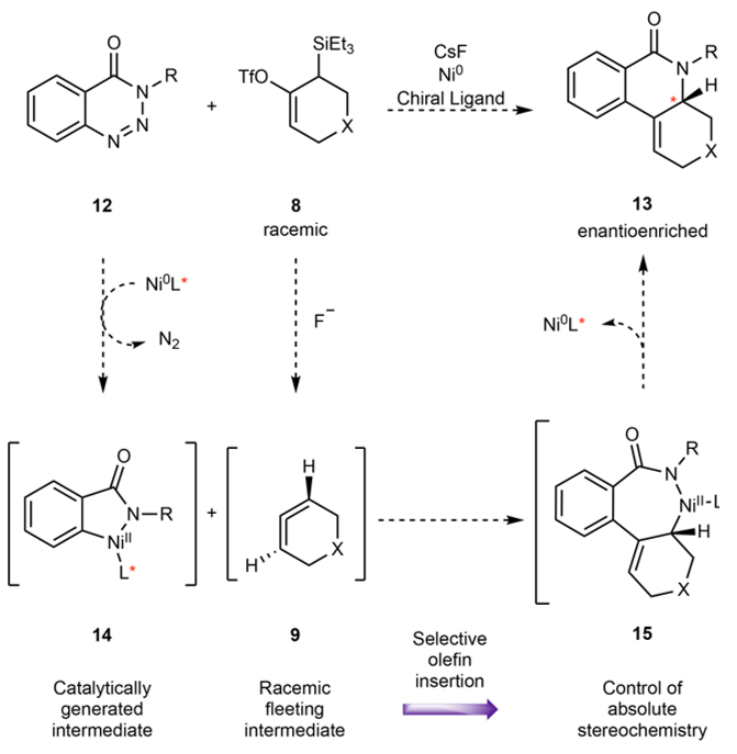
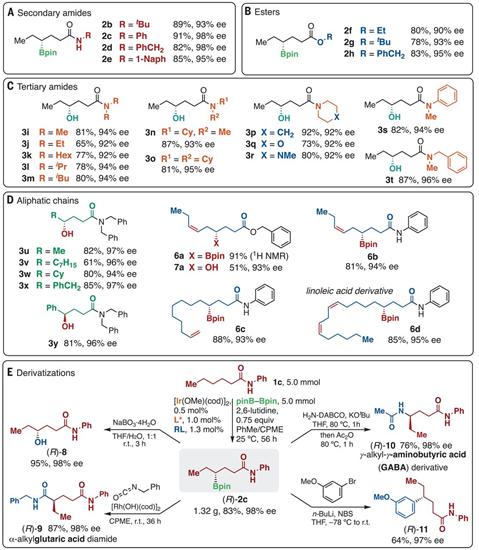
圖1. 前期背景:化學計量比Ni催化聯烯的手性反應。
要點1:反應優化
通過1倍量苯并三嗪酮(16)、1倍量三乙基硅烷/OTf基烯烴作為聯烯前分子(17),在5 mol % Ni(cod)2/10 mol % dppf 作為Ni催化體系,加入2.5倍量CsF誘導原位生成聯烯,在35 ℃ MeCN中進行反應。通過該過程,實現了消除OTf、SiEt3生成聯烯中間體和苯并三嗪酮進行非手性進行成環反應。該反應中的苯并三嗪酮的N上兼容甲苯基(tolyl),對氟苯基(fluorophenyl),甲基等官能團、并且兼容可消除的芐基位點。苯環結構上對缺電子羰基修飾、富電子甲氧基修飾同樣具有兼容性,嗎啉、噻吩等雜環芳烴同樣對該物種兼容。該方法能實現合成具有抗癌作用的石蒜科生物堿菲啶酮類分子。
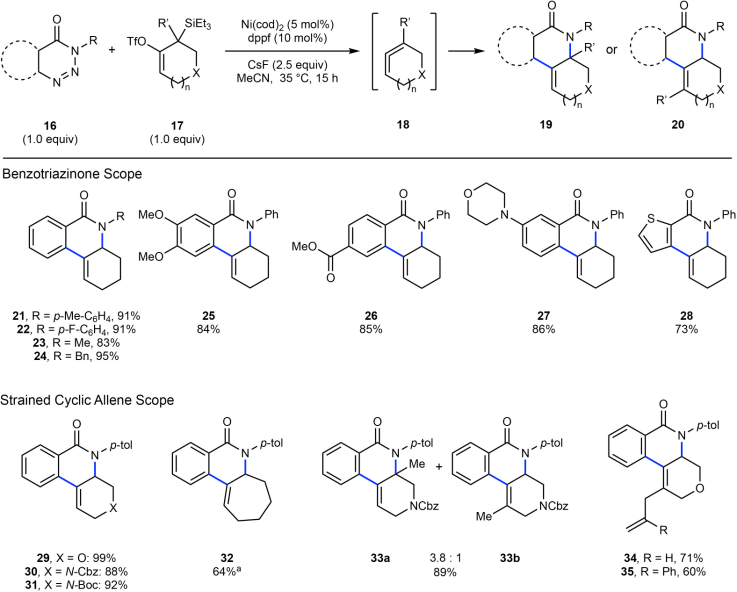
圖2. 反應和底物拓展。
要點2:手性反應
作者發現三氟甲硅烷基修飾的前聯烯分子在暴露氟化物(F-)后,會轉化為兩種不同手性結構的聯烯混合物,并且這兩種手性結構的聯烯會發生快速轉變。但是,通過動力學拆分(DKR),能夠得到對映體富集的手性產物。
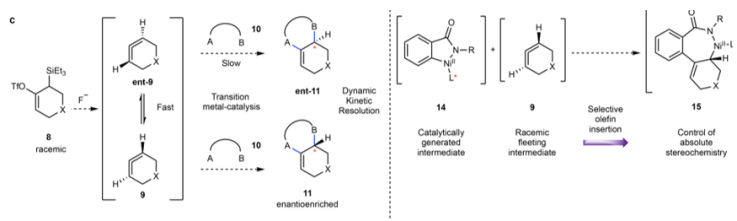
圖3. 手性反應設計Scheme。
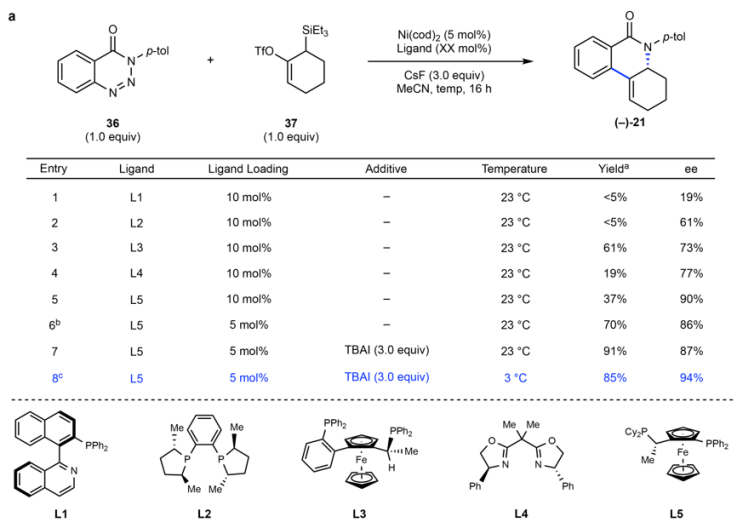
圖4. Ni催化手性聯烯成環反應。
作者在反應中加入手性配體分子,考察36和8的手性成環反應。在加入Quinap(L1)后(以往常用于聯烯的手性轉化),反應的手性選擇性非常低(Entry 1);在加入DuPhos(L2)后,手性選擇性達到61 % ee(Entry 2);Josiphos(L5)展現了高達90 % ee的手性選擇性,但是產物的產率僅為37 %(Entry 5),但是當將配體的量降低至5 mol %,產率增加為70 %。作者認為配體導致產物的分解導致;當在反應中加入3倍量四丁基碘化銨(TBAI)提高氟化物的溶解性,進而促進聯烯的合成速率,并降低反應溫度至3 ℃并通過在24 h反應,實現了以85 %的產率和94 % ee進行反應(Entry 8)。
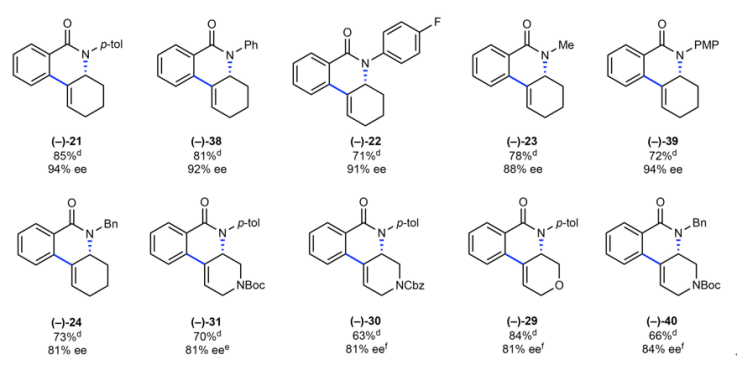
圖5. 聯烯成環反應底物拓展。
要點3:反應機理

圖6. 反應機理。
通過DFT計算模擬對反應機理過程研究,作者認為該手性構建過程經過3個步驟:
1. 在立體選擇烯烴插入過程中進行對環狀聯烯對映體的動力學拆分
2. 形成外消旋的η3-烯丙基鎳中間體物種
3. 經由外球過程對C1位點立體選擇性反應。
并由此提出了可能性較高的Ni催化反應機理。Ni0Ln對苯并三嗪酮進行氧化加成,得到NiII金屬7元環中間體物種,隨后通過消除1分子N2,得到NiII金屬5元環狀內酰胺中間體。通過對環狀聯烯中間體進行插入得到NiII金屬7元環內酰胺中間體。進一步的通過中間體開環,異構化形成η3-烯丙基鎳、隨后在外球親核進攻作用中得到烯烴鄰位手性化產物。
參考文獻
Michael M. Yamano, et al. Intercepting fleeting cyclic allenes with asymmetric nickel catalysis, Nature 2020
DOI: 10.1038/s41586-020-2701-2
https://www.nature.com/articles/s41586-020-2701-2











