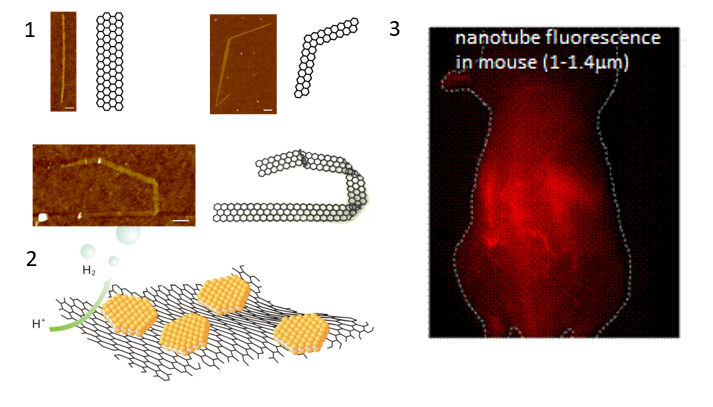
2020諾獎預測!戴宏杰獲引文桂冠獎!
9 月 23 日,全球領先的專業信息服務提供商科睿唯安宣布了 2020 年“引文桂冠獎”得主,該旗下的研究所分析表明,這些科學家的研究被普遍認為“諾貝爾獎級別”。對今年或來年的諾貝爾獎極具參考價值。
自2002年以來,科睿唯安每年都會根據Web of Science上的論文和引文數據,遴選諾貝爾獎獎項所涉及的生理學或醫學、物理學、化學及經濟學領域中全球最具影響力的頂尖研究人員。“引文桂冠獎”得主是從那些被引頻次達2000次或以上的論文作者中選出,據悉,全球只有0.01%的論文被引用次數超過2000。這說明獲得該獎的得主對于科學發展具有極大的推動作用和影響今年共有 24 位科學家入選,分別來自六個國家,有19位來自美國的領先學術機構,其他則來自加拿大、德國、日本、韓國和英國。其中包括華人學者戴宏杰教授。下面,奇物論總結了美國科學院院士,美國醫學院院士,美國科學與藝術學院院士,斯坦福大學戴宏杰教授課題組2019年的研究成果,供大家學習和交流。戴宏杰教授長期從事碳納米材料的生長合成,物理性質研究,納米電子器件研發,以及納米生物醫學等方面的研究,在上述領域都取得了卓越的成就,并獲得了廣泛的影響,是國際納米材料研究領域的領軍人物之一。

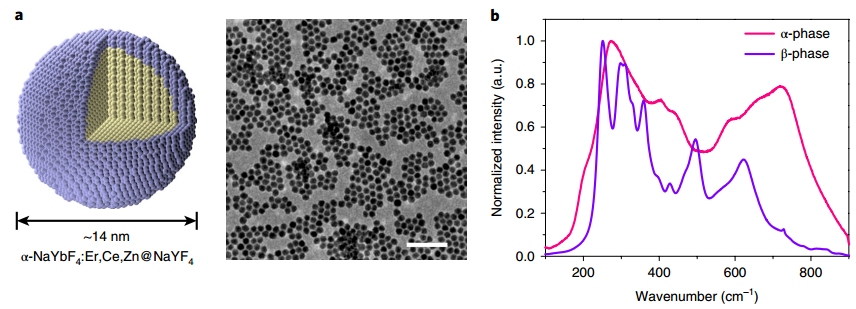
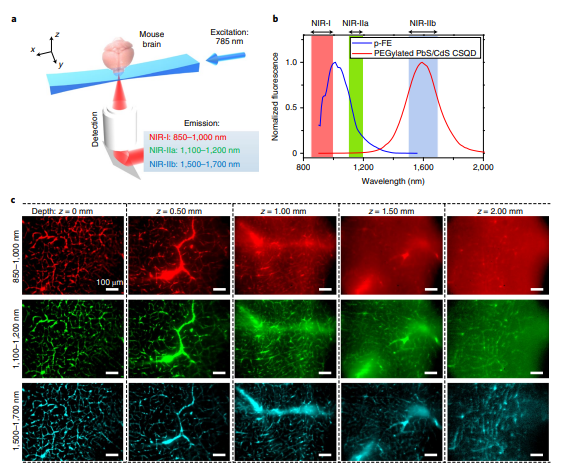
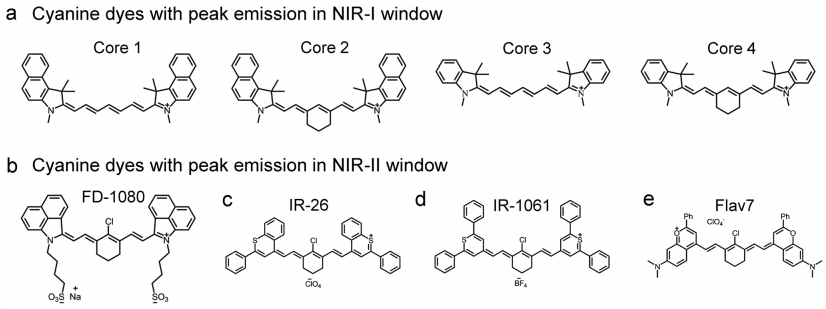
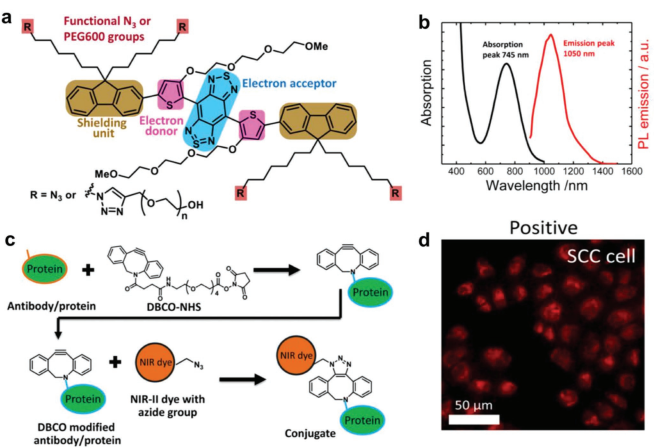
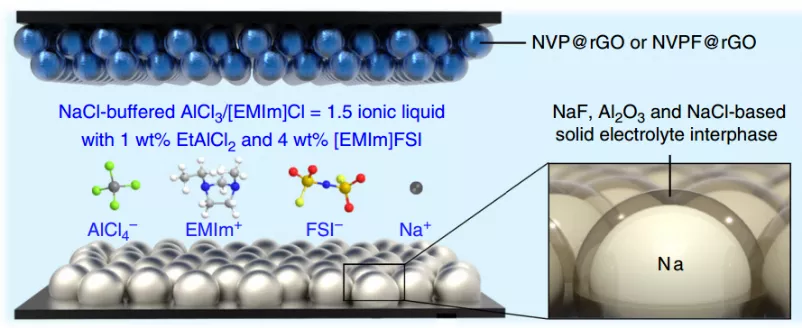
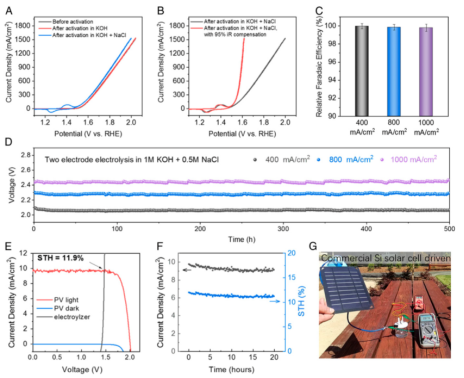
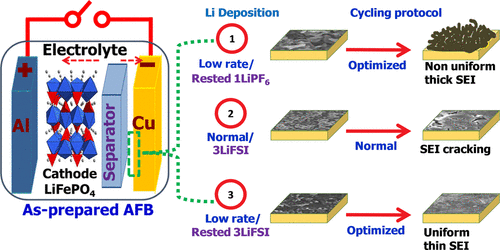
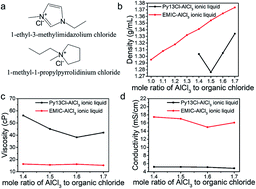
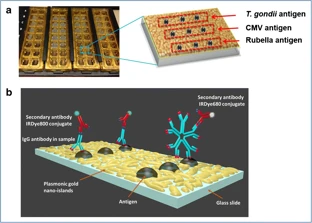
課題組網站:https://web.stanford.edu/group/dailab/1. Nature Biotech.:NIR IIb區稀土納米顆粒用于體內分子成像和免疫治療NIRIIb區 (NIR-IIb) (1500-1700 nm)激光對于實現哺乳動物的深組織光學成像來說是理想的選擇,但目前還缺乏高效和生物相容性較好的探針。斯坦福大學戴宏杰教授團隊開發了一種具有良好生物相容性的立方相(α-phase) 鉺基稀土納米顆粒(ErNPs),它具有高效的下轉換發光性能,可用于對癌癥免疫治療的小鼠進行動態成像。實驗使用連有抗PD-L1抗體交聯親水聚合物層功能化的ErNPs對結腸癌小鼠的PD-L1進行分子成像,發現腫瘤與正常組織的信號比約為40。對PD-L1和CD8的體內NIR-IIb分子成像實驗表明,經免疫治療后的腫瘤微環境會存在細胞毒性T淋巴細胞,并且免疫激活后的腫瘤和脾臟中的CD8信號也會發生改變。YetengZhong, HongjieDai. et al. In vivo molecular imaging for immunotherapy usingultra-brightnear-infrared-IIb rare-earth nanoparticles. Nature Biotechnology. 2019https://www.nature.com/articles/s41587-019-0262-42. Nature Methods:近紅外II窗口中的光片顯微鏡由于光散射的存在,具有高時空分辨率的活哺乳動物的非侵入式深層三維光學成像技術具有挑戰性。斯坦福大學戴宏杰教授等人開發了近紅外II(1000-1700 nm)光片顯微鏡,其激發和發射分別高達約1320 nm和1700 nm,可用于無需進行侵入式手術的穿透活組織的深度約為750μm的光學切片,以及用于在甘油清除的腦組織中約2 mm的深度光學切片。正常和傾斜配置的近紅外II光片顯微鏡可以通過完整組織對活小鼠進行體內成像,揭示腫瘤微循環中的異常血流和T細胞運動,并以細胞分辨率繪制腫瘤中的程序性死亡配體1和程序性細胞死亡蛋白1圖譜。通過完整的小鼠頭部三維成像,可以分辨頭顱和大腦皮層之間的血管通道,并可以監測巨噬細胞和小膠質細胞向創傷性腦損傷部位的募集。Wang, F., Wan, H., Ma,Z. et al. Light-sheet microscopy in the near-infrared II window. Nat Methods16, 545–552 (2019)https://doi.org/10.1038/s41592-019-0398-73. AM:近紅外II區分子染料用于癌癥成像和手術治療生物熒光成像為研究人員和外科醫生提供了一個重要的輔助工具。美國國立衛生研究院陳小元和斯坦福大學戴宏杰教授等人綜述了在近紅外II區這一生物光學透明窗口產生發光的有機染料,它可以使得發射光與周圍組織的相互作用降到最低,使光子可以幾乎不受干擾地在全身傳播。因此,近紅外II區分子熒光成像可以克服可見光成像的穿透度和對比度的瓶頸,為早期診斷癌癥和高敏感性腫瘤手術導航提供幫助。由于其可以與多肽或抗體進行生物偶聯,近紅外II區分子染料也是一種理想的,可靶向腫瘤的成像候選造影劑,有效解決了深部組織分子成像的自熒光和散射問題。作者也對近紅外II區分子染料的合成和化學結構及光學性質進行了總結;對生物偶聯的近紅外II區分子染料的生物行為及用于癌癥檢測和手術等領域的應用做了介紹;最后也對近紅外II區分子染料的應用前景進行了展望。Shoujun Zhu, XiaoyuanChen, Hongjie Dai, etal. Near-Infrared-II Molecular Dyes for Cancer Imaging andSurgery. AdvancedMaterials, 2019.https://doi.org/10.1002/adma.201900321近紅外II區熒光成像在近十年來取得了顯著的研究進展,這也是由于近紅外II區熒光成像具有良好的組織穿透深度和高時空分辨率。與此同時,分子影像也已成為在分子和細胞水平上理解生物行為的有效工具。因此,將分子影像擴展到近紅外II區將進一步提高其成像性能,并提供更詳細和準確的生物系統信息。斯坦福大學戴宏杰團隊總結目前近紅外II區分子成像領域所取得的一些成果,對基于近紅外II區分子成像探針的合理設計策略進行了闡述,并著重介紹了它們的應用,旨在為進一步開發高性能的近紅外II區分子成像探針提供指導和參考。Hao Wan, Hongjie Dai. etal. Molecular Imaging in the Second Near-Infrared Window. AdvancedFunctional Materials. 2019https://doi.org/10.1002/adfm.2019005665. Nano Research:在近紅外II區窗口的治療劑用于癌癥治療和成像納米粒是一種用于治療藥物同時診斷和影像引導給藥的集成系統,在臨床上具有廣泛的應用前景。于此,斯坦福大學戴宏杰教授等人開發了一種基于聚合物膠束的p-FE-PTX-FA納米微粒(動態光散射約24nm大小),該膠束包裹了在1000-1700nm秒近紅外(NIR-II)窗口中熒光的有機染料(FE)和抗癌藥物紫杉醇。將葉酸(FA)與納米顆粒結合,使其與小鼠乳腺癌4T1細胞葉酸受體特異性結合。在體內,納米顆粒通過被動和主動靶向作用在4T1腫瘤中積累。在808nm激光激發下,1300nm以上的熒光檢測產生了較大的Stokes位移,使高信噪比的靶向分子成像腫瘤達到高腫瘤正常組織信號比(T/NT)(20.0±2.3)。此外,小鼠4T1腫瘤在第一次注射后20天內被p-FE-PTA-FA釋放的紫杉醇完全根除。藥代動力學和組織學研究表明,P-FE-PTX-FA對大器官無明顯毒副作用。這代表了第一個NIR-II治療劑的開發。Ma, Z., Wan, H., Wang,W. et al. A theranostic agent for cancer therapy and imaging in the secondnear-infrared window. Nano Res. 12, 273–279 (2019)https://doi.org/10.1007/s12274-018-2210-x6. Nature Commun.:基于離子液體電解質的安全且不易燃的鈉金屬電池具有高能量密度的可充電鈉金屬電池的實現具有重要意義,但追求更高的能量密度也應具有高的安全性,而有機溶劑電解質很難達到該要求。斯坦福大學戴宏杰團隊提出了一種基于NaCl緩沖AlCl3/1-甲基-3-乙基咪唑氯化物的離子液體電解質,用于安全和高能Na電池。兩種1至4 wt.%的電解質添加劑,乙基二氯化鋁(EtAlCl2)和1-乙基-3-甲基咪唑雙(氟磺酰基)酰亞胺([EMIm] FSI)是穩定鈉負極上的SEI實現可逆鈉電鍍/剝離的關鍵。這是用于可充電鈉金屬電池的第一種基于氯鋁酸鹽的離子液體電解質。固體電解質界面(SEI)分析顯示SEI成分包括NaCl,Al2O3和NaF,其衍生自Na與IL電解質中陰離子之間的反應。在含有該IL電解質的Na/Pt電池中,在約為100次可逆Na電鍍/剝離循環中,在0.5 mA cm-2下達到約為95%的庫倫效率(CE)。使用優化的IL電解質,將Na負極與磷酸釩鈉(NVP)和磷酸釩氟化鈉(NVPF)基正極配對,可提供高達~4 V的高放電電壓,高達99.9%的CE和最大能量功率密度分別為420Wh kg-1和1766 W kg-1。700次循環后,電池容量保持率為90%以上。Hao Sun, Guanzhou Zhu,Xintong Xu, Meng Liao, et al, A safe and non-flammable sodium metal batterybased on an ionic liquid electrolyte, Nature Communications, 2019.https://doi.org/10.1038/s41467-019-11102-27. PNAS: 太陽能驅動,持續穩定的海水分解制氫電解水生產氫燃料是一項頗具吸引力的可再生能源儲存技術。然而,大規模的淡水電解將給水資源帶來沉重的壓力。開發廉價的電催化劑和電極,在不受氯腐蝕的情況下實現海水的分解,可以解決水資源短缺的問題。有鑒于此, 北京化工大學孫曉明教授和斯坦福大學戴宏杰教授等人將鎳鐵氫氧化物電催化劑均勻生長在硫化鎳(NiSx)層上,并將硫化鎳生長在鎳導體上形成多層結構(鎳鐵/ NiSx-Ni),該催化劑具有優越的催化活性和耐腐蝕性能,在工業所需電流密度(0.4-1 A cm-2)下,太陽能驅動堿性條件下進行持續穩定海水電解超過1000 h。持續的高析氧反應活性的NiFe電催化劑層將陽極電流引向水氧化,在陽極上形成原位生長硫酸鹽和富含碳酸鹽的鈍化層,使海水分解過程中陽極可以排斥氯離子并具有優異的耐腐蝕性。Yun Kuang, Michael J.Kenney, Yongtao Meng, et al. Solar-driven, highly sustained splitting ofseawater into hydrogen and oxygen fuels. Proc. Natl. Acad. Sci. USA. 2019https://doi.org/10.1073/pnas.19005561168. ACS AMI: 濃鹽和靜置法對固體電解質界面形成的影響,以提高無陽極鋰電池的循環穩定性Tamene Tadesse Beyene,Bikila Alemu Jote, Zewdu Tadesse Wondimkun, Bizualem Wakuma Olbassa, et al.Effects of Concentrated Salt and Resting Protocol on Solid ElectrolyteInterface Formation for Improved Cycle Stability of Anode-Free Lithium MetalBatteries.ACS Applied Materials & Interfaces 2019 11 (35), 31962-31971https://doi.org/10.1021/acsami.9b095519. RCS Adv.: 可充電鋁電池:離子液體電解質中陽離子的影響Zhu G, Angell M, PanC-J, Lin M-C, Chen H, Huang C-J, et al. Rechargeable aluminum batteries:effects of cations in ionic liquid electrolytes. RSC Advances.2019;9(20):11322-30.https://pubs.rsc.org/en/content/articlelanding/2019/RA/c9ra00765b#!divAbstract10. Eur J ClinMicrobiol Infect Dis:用唾液檢測的plasmonic金芯片通過侵入性手術如靜脈切開取血是最常用的診斷方法。然而,靜脈切開術有幾個缺點,包括疼痛、血管迷走反應和焦慮。因此,應開發替代方法,以盡量減少患者的不適。唾液是一個合理的選擇,當獲得時,病人幾乎沒有產生焦慮。斯坦福大學戴宏杰教授和Jose G. Montoya等人建立了一種用新型plasmonic金(pGOLD)芯片檢測血清、全血和唾液中弓形蟲IgG和IgM、風疹IgG和CMV IgG的多血清學方法。血清、全血、唾液pGOLD檢測結果與商品試劑盒檢測結果進行比較。檢測了來自法國的120份血清/唾液樣本(Lyon)和28份血清/全血/唾液樣本(Nice)。在血清和全血中,pGOLD中多重弓形蟲、CMV和風疹IgG的敏感性和特異性均為100%。唾液中弓形蟲和風疹IgG的敏感性和特異性分別為100%,CMV-IgG的敏感性和特異性分別為92.9%和100%。與血清檢測結果相比,研究人員還能夠檢測唾液中的弓形蟲IgM,敏感性和特異性分別為100%和95.4%。通過多重pGOLD測定法對唾液中的弓形蟲,風疹和CMV進行血清學檢測是可靠的,并且對于系統性篩查孕婦,新生兒和免疫功能低下的患者而言,可能更容易接受。Li, X., Pomares, C.,Peyron, F. et al. Plasmonic gold chips for the diagnosis of Toxoplasma gondii,CMV, and rubella infections using saliva with serum detection precision. Eur JClin Microbiol Infect Dis 38, 883–890 (2019)https://doi.org/10.1007/s10096-019-03487-1除此之外,更多往年研究成果可訪問課題組官網進行學習:課題組網址:https://web.stanford.edu/group/dailab/戴宏杰教授本科畢業于清華大學,獲哈佛大學博士學位。1997年起加入斯坦福大學化學系,現任J.G. Jackson & C.J.Wood 終身榮譽教授。戴宏杰教授2002年獲得美國化學會純粹化學獎;2006年獲得美國物理學會James McGroddy(新材料)獎;2009年獲得哥倫比亞大學Ramabrahmam和Balamani Guthikonda獎;2009年當選“美國科學與藝術學院院士”;2010年當選“美國科學促進會會士”;2016年當選“美國科學院院士”;2019年當選美國醫學院院士。戴宏杰教授在物理、化學、材料和生物醫學類的國際著名期刊發表論文300余篇,其論文的總引用次數超過12萬次,H-index: 150。戴教授在多個國際學術刊物上擔任編輯和編委工作,是《Nano Research》的發起人和主編。
加載更多

2810

版權聲明:
1) 本文僅代表原作者觀點,不代表本平臺立場,請批判性閱讀!
2) 本文內容若存在版權問題,請聯系我們及時處理。
3) 除特別說明,本文版權歸納米人工作室所有,翻版必究!