自2007年首次報(bào)道Fe3O4模擬HRP酶活性的納米酶以來(lái),納米酶引起廣泛的關(guān)注,因?yàn)槠浼染哂刑烊幻傅母叽呋钚蕴攸c(diǎn),又有模擬酶的穩(wěn)定和經(jīng)濟(jì)的優(yōu)勢(shì),它在醫(yī)學(xué)、化工、食品、農(nóng)業(yè)和環(huán)境等領(lǐng)域得到廣泛應(yīng)用。納米酶的問(wèn)世,改變了以往人們認(rèn)為無(wú)機(jī)納米材料是一種生物惰性物質(zhì)的傳統(tǒng)觀念,揭示了納米材料內(nèi)在的生物效應(yīng)及新特性,豐富了模擬酶的研究,使其從有機(jī)復(fù)合物拓展到無(wú)機(jī)納米材料,打破了傳統(tǒng)意義上的“無(wú)機(jī)”與“有機(jī)”的界限,拓展了納米材料的應(yīng)用范圍。鑒于此,奇物論編輯部整理了近期關(guān)于納米酶的醫(yī)療應(yīng)用方向的研究,供大家學(xué)習(xí)和交流!
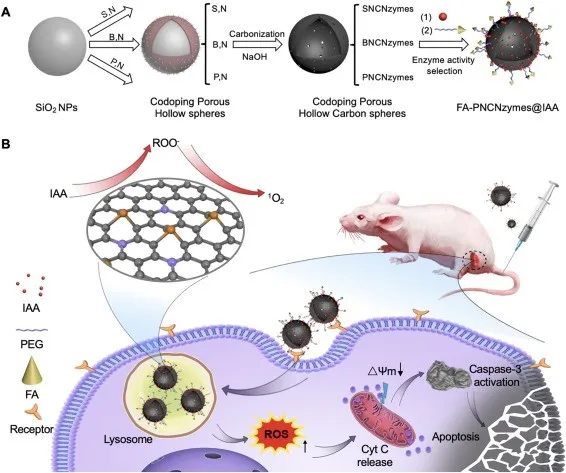
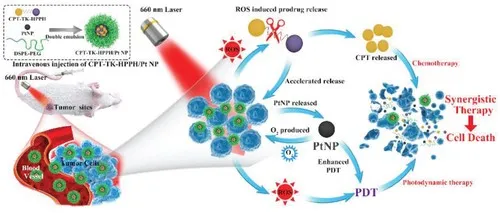
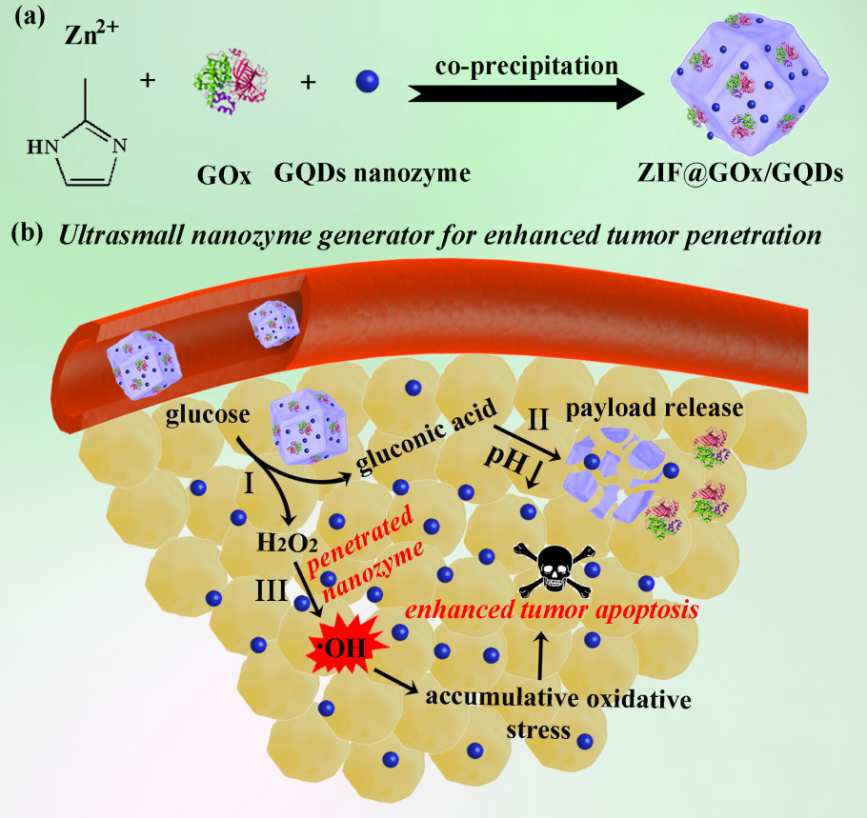
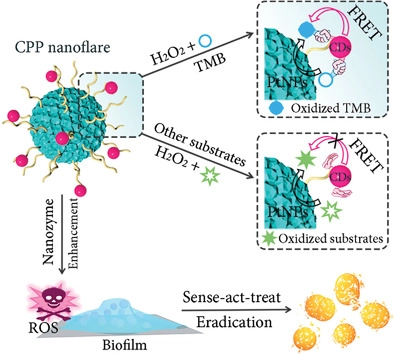
1. Nano. Today:無(wú)金屬納米酶激活的前藥用于靶向腫瘤的催化治療酶介導(dǎo)的腫瘤細(xì)胞前藥激活是腫瘤靶向治療的一種有吸引力的策略。值得注意的是,天然過(guò)氧化物酶和吲哚-3-乙酸(IAA)已被證明是一種很有前途的酶-前藥組合。然而,內(nèi)源性過(guò)氧化物酶活性不足,外源性過(guò)氧化物酶在腫瘤細(xì)胞中難以選擇性表達(dá),嚴(yán)重限制了其抗腫瘤效果。具有類似過(guò)氧化物酶活性的納米材料(納米酶)的發(fā)現(xiàn),特別是具有高度穩(wěn)定性和良好生物相容性的無(wú)金屬納米酶的發(fā)現(xiàn),為克服這些挑戰(zhàn)帶來(lái)了新的機(jī)遇。有鑒于此,中國(guó)科學(xué)院生物物理研究所的范克龍、高利增和閻錫蘊(yùn)院士等研究人員,在理論計(jì)算的指導(dǎo)下,開(kāi)發(fā)了一種無(wú)金屬磷氮雙摻雜的多孔空心碳球納米酶(PNCNzyme),在酸性環(huán)境下具有較強(qiáng)的類過(guò)氧化物酶活性。1)基于這種不含金屬的納米酶,研究人員開(kāi)發(fā)了一種納米酶-IAA激活策略,激活I(lǐng)AA產(chǎn)生豐富的ROS并觸發(fā)腫瘤細(xì)胞凋亡。2)研究人員還將葉酸(FA)引入到納米酶中,以增強(qiáng)其腫瘤靶向性和腫瘤細(xì)胞的吞噬效能。3)給藥后,F(xiàn)A-PNCNzymes@IAA有效地積聚在宮頸癌細(xì)胞來(lái)源的移植瘤中,催化ROS的產(chǎn)生,并誘導(dǎo)細(xì)胞凋亡。綜上所述,這些數(shù)據(jù)表明,納米酶-IAA組合是一種有效的腫瘤靶向催化治療的酶-前體藥物激活策略。Qian Liang, et al. A metal-free nanozyme-activated prodrug strategy for targeted tumor catalytic therapy. Nano Today, 2020.DOI:10.1016/j.nantod.2020.100935https://www.sciencedirect.com/science/article/pii/S17480132203010432. Nano Today:氧化鈰納米酶對(duì)藥物性肝損傷的雙重解毒和炎癥調(diào)節(jié)作用藥物性肝損傷(DILI)是許多國(guó)家急性肝功能衰竭的主要原因,它與活性氧(ROS)和炎癥密切相關(guān)。雖然N-乙酰半胱氨酸(NAC)是目前治療DILI的首選解毒劑,但由于其治療時(shí)間窗窄,往往無(wú)法使晚期患者受益。在此,浙江大學(xué)凌代舜、翁勤潔等人報(bào)道了氧化鈰納米酶(CeNZs),它可以同時(shí)清除活性氧并產(chǎn)生氧氣,用于治療對(duì)乙酰氨基酚誘導(dǎo)的肝損傷(DILI的典型形式),與NAC相比,能夠延長(zhǎng)治療時(shí)間窗口。1)結(jié)果表明,CeNZs能有效清除受損肝細(xì)胞中的ROS,達(dá)到解毒的目的。2)更重要的是,CeNZs可以基于其類過(guò)氧化氫酶(CAT)活性產(chǎn)生豐富的氧氣,從而進(jìn)一步緩解缺氧,并特異性地抑制促炎巨噬細(xì)胞,以減輕炎癥,從而促進(jìn)DILI的肝細(xì)胞再生,這對(duì)于治療已經(jīng)出現(xiàn)大量肝細(xì)胞壞死的晚期DILI至關(guān)重要。綜上所述,與NAC相比,CeNZs對(duì)DILI治療具有較長(zhǎng)的治療時(shí)間窗,具有雙重解毒和炎癥調(diào)節(jié)作用,同時(shí)文中進(jìn)一步揭示了其作用機(jī)制,表明CeNZs在治療DILI,特別是晚期DILI方面具有廣闊的臨床應(yīng)用前景。Fangyuan Li, et al. Dual detoxification and inflammatory regulation by ceria nanozymes for drug-induced liver injury therapy. Nano Today, 2020.https://doi.org/10.1016/j.nantod.2020.1009253. Adv. Mater:消耗GSH、可被熱增強(qiáng)的雙酶活性納米酶用于腫瘤催化治療納米催化治療是一種新型的用于治療各種惡性腫瘤的策略。然而,納米酶在腫瘤微環(huán)境(TME)中的催化活性往往相對(duì)不佳,這也限制了其在生物醫(yī)學(xué)領(lǐng)域中的應(yīng)用。哈爾濱工程大學(xué)楊飄萍教授和賀飛副教授、中科院長(zhǎng)春應(yīng)化所林君研究員用樹(shù)枝狀介孔二氧化硅(Bi2S3@DMSN)包覆均勻的Bi2S3納米棒(NRs),然后將超小的二氧化鈰納米酶修飾到Bi2S3@DMSN的孔中,從而開(kāi)發(fā)出一種多功能、類細(xì)菌的PEG/Ce-Bi@DMSN納米酶。(1)在酸性條件下,該納米酶具有雙重酶催化活性(過(guò)氧化物酶和過(guò)氧化氫酶),可以調(diào)節(jié)TME以同時(shí)提高氧化應(yīng)激和緩解乏氧。此外,該納米酶可以通過(guò)氧化還原反應(yīng)有效地消耗過(guò)表達(dá)的谷胱甘肽(GSH)。同時(shí),實(shí)驗(yàn)也引入了光熱治療(PTT)以協(xié)同改善該納米酶的催化活性。(2)PEG/Ce-Bi@DMSN納米酶在近紅外II區(qū)(NIR-II)窗口具有很好的吸光度,光熱也可以顯著增強(qiáng)由活性氧(ROS)介導(dǎo)的腫瘤治療效果。因此,這一研究也為實(shí)現(xiàn)熱增強(qiáng)酶活性以用于腫瘤治療提供了新的思路。Shuming Dong. et al. GSH-Depleted Nanozymes with Hyperthermia-Enhanced Dual Enzyme-Mimic Activities for Tumor Nanocatalytic Therapy. Advanced Materials. 2020DOI: 10.1002/adma.202002439https://onlinelibrary.wiley.com/doi/full/10.1002/adma.2020024394. AM:免疫調(diào)節(jié)增強(qiáng)的基于納米酶的腫瘤催化治療近年來(lái),基于納米酶的腫瘤催化療法引起了廣泛的關(guān)注。但是,其治療效果由于腫瘤微環(huán)境(TME)中的許多因素而減弱,例如內(nèi)源性過(guò)氧化氫(H2O2)濃度不足、缺氧和免疫抑制性微環(huán)境。有鑒于此,北京化工大學(xué)劉惠玉、中國(guó)科學(xué)院過(guò)程工程研究所魏煒等人首先提出了一種基于免疫調(diào)節(jié)的納米酶增強(qiáng)型腫瘤催化療法,以實(shí)現(xiàn)納米酶與TME調(diào)控之間的協(xié)同作用。1)構(gòu)造了TGF-β抑制劑(TI)的聚乙二醇化硅酸錳鐵納米顆粒(IMSN)(稱為IMSN-PEG-TI)以觸發(fā)治療方式。2)結(jié)果表明,IMSN納米酶在酸性TME下既具有內(nèi)在過(guò)氧化物酶樣和過(guò)氧化氫酶樣活性,又可以將H2O2分解為羥基(?OH)和氧(O2)。3)此外,還證明IMSN和TI均可調(diào)節(jié)腫瘤免疫微環(huán)境,導(dǎo)致巨噬細(xì)胞從M2極化到M1,從而誘導(dǎo)H2O2再生,從而促進(jìn)IMSN納米酶的催化活性。4)體外多細(xì)胞腫瘤球體(MCTS)和體內(nèi)CT26荷瘤小鼠模型證明了IMSN-PEG-TI的有效抗腫瘤作用。基于免疫調(diào)節(jié)增強(qiáng)的納米酶腫瘤治療策略被認(rèn)為是一種很有前途的殺滅腫瘤細(xì)胞的工具。Bolong Xu, et al. Immunomodulation‐Enhanced Nanozyme‐Based Tumor Catalytic Therapy. Advanced Materials, 2020.DOI:10.1002/adma.202003563https://onlinelibrary.wiley.com/doi/full/10.1002/adma.2020035635. Angew:Fe3+驅(qū)動(dòng)的過(guò)類氧化氫酶超分子光敏納米酶的組裝用于缺氧腫瘤治療光動(dòng)力療法(PDT)已成為一系列淺表性和局限性癌癥的常用治療方式。然而,為了促進(jìn)其臨床轉(zhuǎn)化,仍有一些障礙需要解決。在此,香港城市大學(xué)Pui-Chi Lo等人開(kāi)發(fā)了一種簡(jiǎn)便的組裝具有自供氧能力的類過(guò)氧化氫酶光敏性納米酶的方法。1)此過(guò)程涉及Fe3+驅(qū)動(dòng)的芴甲氧羰基(Fmoc)保護(hù)氨基酸的自組裝。在Fe3+促進(jìn)Fmoc保護(hù)的半胱氨酸(Fmoc-Cys)自組裝過(guò)程中加入鋅(Ⅱ)酞菁光敏劑(ZnPc)和缺氧誘導(dǎo)因子-1(HIF-1)抑制劑吖啶黃(ACF),制備了可在細(xì)胞內(nèi)分解的Fmoc-Cys/Fe@Pc和Fmoc-Cys/Fe@Pc/ACF納米微囊。2)釋放的Fe3+能有效地催化癌細(xì)胞中富集的H2O2轉(zhuǎn)化為氧氣,從而改善缺氧條件,提高釋放的ZnPc的光敏活性。3)添加治療組分后,F(xiàn)moc-Cys/Fe@Pc/ACF的體內(nèi)和體外光動(dòng)力活性均高于Fmoc-Cys/Fe@Pc,證明了ZnPc與ACF的協(xié)同作用。Pui-Chi Lo, et al. Fe3+‐Driven Assembly of Catalase‐Like Supramolecular Photosensitizing Nanozymes for Combating Hypoxic Tumor. Angew. Chem. Int. Ed., 2020.DOI: 10.1002/anie.202010005https://doi.org/10.1002/anie.2020100056. Advanced Science:帶有ROS響應(yīng)性前藥和鉑納米酶的聚合物納米顆粒可增強(qiáng)結(jié)腸癌的化學(xué)光動(dòng)力治療化學(xué)療法和光動(dòng)力療法(PDT)的結(jié)合在癌癥的協(xié)同治療中具有廣闊的前景。然而,化學(xué)療法和光動(dòng)力協(xié)同療法受制于不受控制的化學(xué)療法釋放行為,靶向缺陷以及與缺氧相關(guān)的實(shí)體瘤中PDT療效差的問(wèn)題。有鑒于此,四川大學(xué)華西醫(yī)院的錢志勇等研究人員,為了克服這些局限性,研究人員創(chuàng)建了負(fù)載有鉑納米酶(PtNP)的活性氧(ROS)響應(yīng)型前藥納米顆粒(CPT-TK-HPPH / Pt NP)。1)ROS響應(yīng)性前藥由與喜樹(shù)堿(CPT)和光敏劑-2-(1-己氧基氧基乙基)-2-癸二烯基焦脫鎂葉綠酸(HPPH)連接的硫縮酮鍵組成。2)CPT-TK-HPPH / Pt NP中的PtNP可以有效催化過(guò)氧化氫(H2O2)分解為氧氣,以緩解缺氧。氧氣的產(chǎn)生可以滿足660 nm激光照射下HPPH的消耗,從而實(shí)現(xiàn)CPT的按需釋放并確保增強(qiáng)的光動(dòng)力療法。3)作為腫瘤診斷劑,CPT-TK-HPPH / Pt NP的光聲成像和熒光成像結(jié)果顯示出理想的長(zhǎng)循環(huán)性和增強(qiáng)的體內(nèi)靶向性。4)CPT‐TK‐HPPH / Pt NP在體內(nèi)外均能有效抑制腫瘤的增殖和生長(zhǎng)。CPT-TK-HPPH / Pt NP具有出色的ROS響應(yīng)藥物釋放行為和增強(qiáng)的PDT效率,可以作為一種新型的癌癥治療劑,并將進(jìn)一步促進(jìn)化學(xué)光動(dòng)力協(xié)同治療癌癥的研究。Ying Hao, et al. Polymeric Nanoparticles with ROS‐Responsive Prodrug and Platinum Nanozyme for Enhanced Chemophotodynamic Therapy of Colon Cancer. Advanced Science, 2020.DOI:10.1002/advs.202001853https://onlinelibrary.wiley.com/doi/full/10.1002/advs.2020018537. Biomaterials:可被激活的超小納米酶發(fā)生器用于增強(qiáng)穿透和深層催化治療設(shè)計(jì)開(kāi)發(fā)可在腫瘤微環(huán)境中被激活的超小納米酶能夠有效克服傳統(tǒng)活性氧基納米試劑的腫瘤穿透深度,外部能量的組織穿透深度有限、對(duì)氧氣嚴(yán)重依賴以及非特異性毒性等缺陷。中科院長(zhǎng)春應(yīng)化所曲曉剛研究員將葡萄糖氧化酶(GOx)和超小的過(guò)氧化物納米酶嵌入酸解性的 ZIF-8中,構(gòu)建了一種具有級(jí)聯(lián)反應(yīng)能力的納米系統(tǒng),并將這種具有增強(qiáng)的腫瘤穿透深度的超小納米酶發(fā)生器用于深度催化治療。(1)在腫瘤的偏酸性微環(huán)境中,瘤內(nèi)的葡萄糖所產(chǎn)生的葡萄糖酸可逐漸誘導(dǎo)ZIF-8解離,進(jìn)而釋放超小的過(guò)氧化物酶納米酶,實(shí)現(xiàn)顯著的瘤內(nèi)穿透效果。另一方面,生成的壽命相對(duì)較長(zhǎng)的過(guò)氧化氫可在隨后被過(guò)氧化物納米酶催化生成高毒性的羥基自由基,從而實(shí)現(xiàn)深度催化治療。(2)研究結(jié)果表明,該納米平臺(tái)不僅可以極大地增強(qiáng)納米酶在腫瘤中的穿透能力,而且可以在不需要氧氣參與和外部能量輸入的情況下直接誘導(dǎo)產(chǎn)生ROS,從而徹底避免了傳統(tǒng)ROS基納米試劑在極度乏氧環(huán)境下的失活情況,最終實(shí)現(xiàn)了優(yōu)異的深度催化治療效果。Xinping Liu. et al. Tumor-activatable ultrasmall nanozyme generator for enhanced penetration and deep catalytic therapy. Biomaterials. 2020https://www.sciencedirect.com/science/article/pii/S01429612203050938. Nature Commun:超小銅基納米顆粒用于清除活性氧和治療炎癥相關(guān)疾病氧化應(yīng)激與許多種急性和慢性炎癥疾病有關(guān),目前臨床上的治療方法也很有限。開(kāi)發(fā)具有良好活性氧清除能力和生物相容性的模擬酶納米材料是治療活性氧相關(guān)炎癥的一條有效途徑。第三軍醫(yī)大學(xué)羅高興教授和鄧君教授、浙江大學(xué)毛崢偉教授和美國(guó)NIH陳小元研究員通過(guò)簡(jiǎn)單的一步法制備了超小Cu5.4O納米顆粒(Cu5.4O USNPs),它具有多重模擬酶活性和廣譜清除ROS的能力,可用于對(duì)ROS相關(guān)疾病進(jìn)行高效治療。(1)Cu5.4O USNPs具有過(guò)氧化氫酶、超氧化物歧化酶和谷胱甘肽過(guò)氧化物酶等酶活性,在極低劑量下對(duì)ROS介導(dǎo)的細(xì)胞損傷具有很好的保護(hù)作用,可顯著改善對(duì)急性腎損傷、急性肝損傷和傷口愈合的治療效果。(2)同時(shí),具有超小尺寸的Cu5.4O USNPs可以通過(guò)腎臟被快速清除,因此它也有著很好的生物相容性。綜上所述,這一研究工作開(kāi)發(fā)的Cu5.4O USNPs也為治療ROS相關(guān)疾病和下一代納米酶的開(kāi)發(fā)提供了新的參考和策略。Tengfei Liu. et al. Ultrasmall copper-based nanoparticles for reactive oxygen species scavenging and alleviation of inflammation related diseases. Nature Communications. 2020https://www.nature.com/articles/s41467-020-16544-79. Small:具有精細(xì)酶特異性和高效性,用于多種生物膜清除的工程無(wú)機(jī)納米耀斑納米酶作為一種多功能的納米催化劑,其催化效率和特異性限制了其在生物醫(yī)學(xué)領(lǐng)域的應(yīng)用。在此,武漢大學(xué)王富安等人通過(guò)將識(shí)別/轉(zhuǎn)導(dǎo)碳點(diǎn)(CDs)與鉑納米顆粒(PtNPs)有機(jī)結(jié)合在一起,構(gòu)建了一種精致的Cds@PtNPs(CPP)納米耀斑,作為一種高效的底物特異性過(guò)氧化物酶模擬納米酶應(yīng)用于高性能生物傳感和抗菌領(lǐng)域。1)智能CPP催化的過(guò)氧化氫(H2O2)產(chǎn)生的活性氧實(shí)現(xiàn)了靈敏診斷引導(dǎo)下的病原體增強(qiáng)消毒。2)值得注意的是,CPP納米酶通過(guò)酸性感染組織中的內(nèi)源性H2O2在體內(nèi)表現(xiàn)出顯著的生物膜清除和傷口愈合,基本上可以消除惱人的抗生素耐藥性。綜上所述,對(duì)目前CPP納米耀斑的基本認(rèn)識(shí)不僅有助于各種潛在生物催化劑的發(fā)展,而且為多功能的生物傳感和智能診斷應(yīng)用奠定基礎(chǔ)。Meijuan Liang, et al. Engineering Inorganic Nanoflares with Elaborate Enzymatic Specificity and Efficiency for Versatile Biofilm Eradication. Small, 2020.DOI: 10.1002/smll.202002348https://doi.org/10.1002/smll.20200234810. Theranostics:納米酶輔助的外泌體蛋白分析策略用于對(duì)癌癥進(jìn)行快速診斷外泌體上表達(dá)的蛋白已成為一種可用于癌癥診斷的液體活檢生物標(biāo)志物。然而,如何對(duì)外泌體蛋白的分子譜進(jìn)行分析仍然是一個(gè)具有很大挑戰(zhàn)性的難題。南開(kāi)大學(xué)高紅梅教授、劉定斌教授和中南大學(xué)榮鵬飛報(bào)告了一種納米酶輔助免疫吸附實(shí)驗(yàn) (NAISA),并將其用于對(duì)外泌體蛋白進(jìn)行靈敏、快速的多重分析。(1)實(shí)驗(yàn)將類過(guò)氧化物納米酶修飾到外泌體的磷脂膜上從而構(gòu)建了該NAISA系統(tǒng)。外泌體蛋白可由納米酶通過(guò)催化比色法進(jìn)行測(cè)定,測(cè)定時(shí)間小于3小時(shí),且不需要多步孵育和洗滌操作。通過(guò)利用NAISA分析不同細(xì)胞系和臨床樣本的外泌體蛋白,實(shí)驗(yàn)發(fā)現(xiàn)腫瘤相關(guān)的外泌體蛋白可以作為一種生物標(biāo)記物,以對(duì)癌癥進(jìn)行準(zhǔn)確診斷。(2)實(shí)驗(yàn)隨后利用外泌體蛋白CD63、CEA、GPC-3、PD-L1和HER2的表達(dá)水平對(duì)不同的癌細(xì)胞系進(jìn)行了分類。此外,該蛋白譜已可用于鑒別健康人群、乙型肝炎患者和肝細(xì)胞癌(HCC)患者。由此證明NAISA納米酶可以快速分析多種外泌體蛋白,因此其在早期HCC和其他類型癌癥的診斷領(lǐng)域中有著很好的應(yīng)用前景。Huixia Di. et al. Nanozyme-assisted sensitive profiling of exosomal proteins for rapid cancer diagnosis. Theranostics. 2020https://www.thno.org/v10p9303.htm