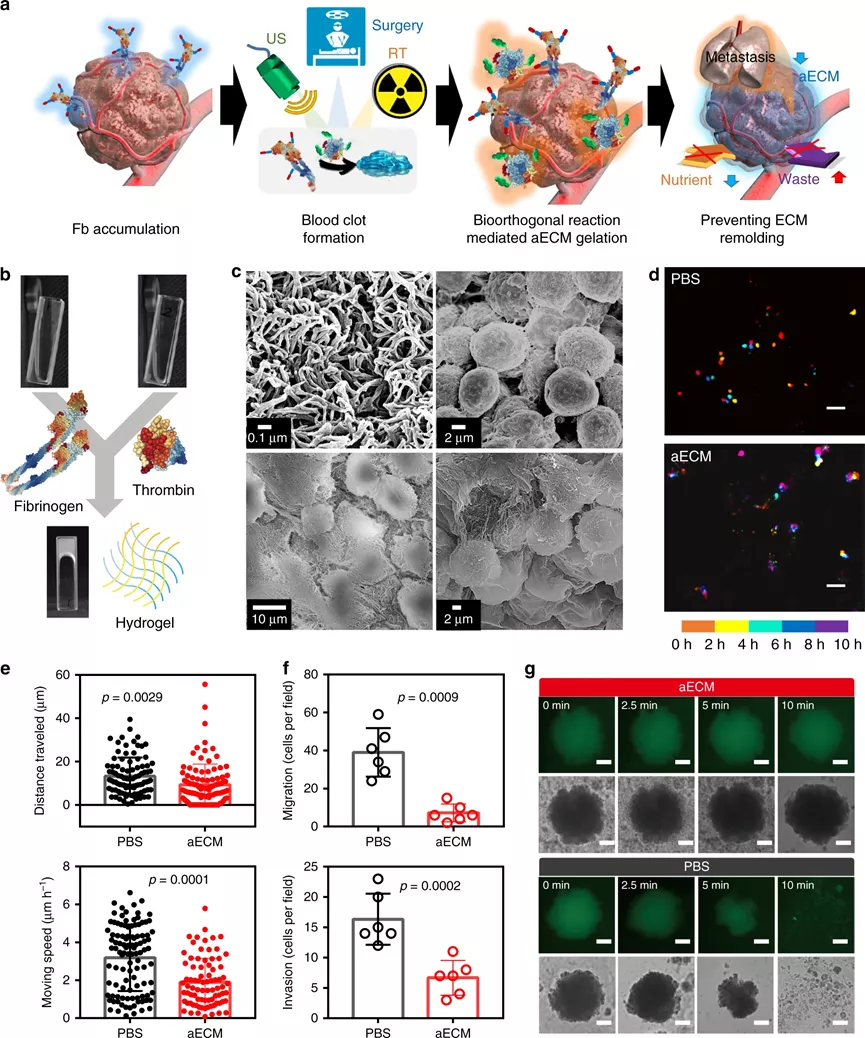
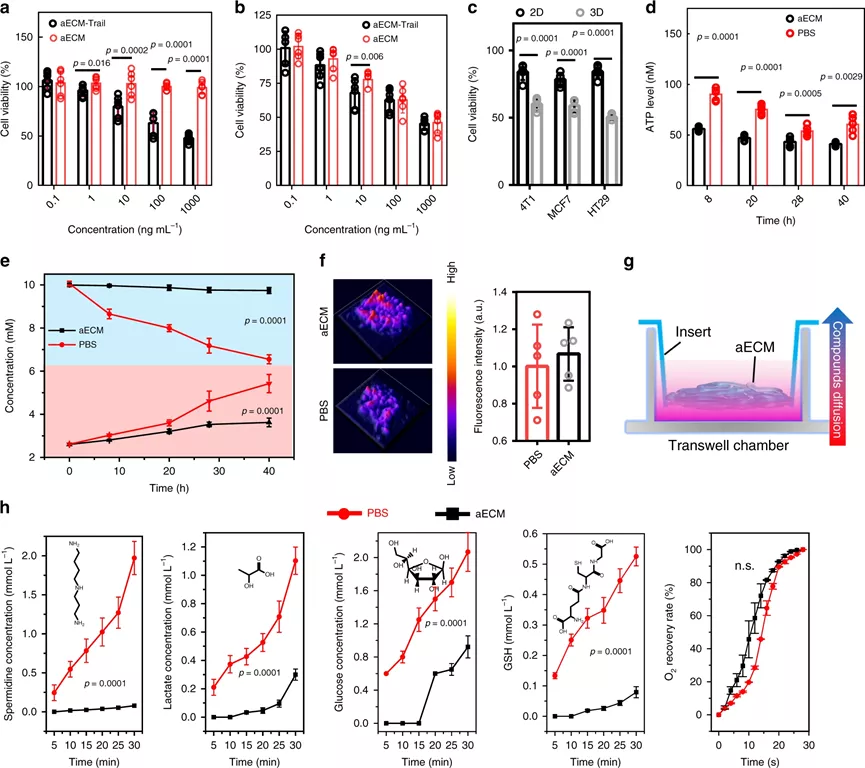
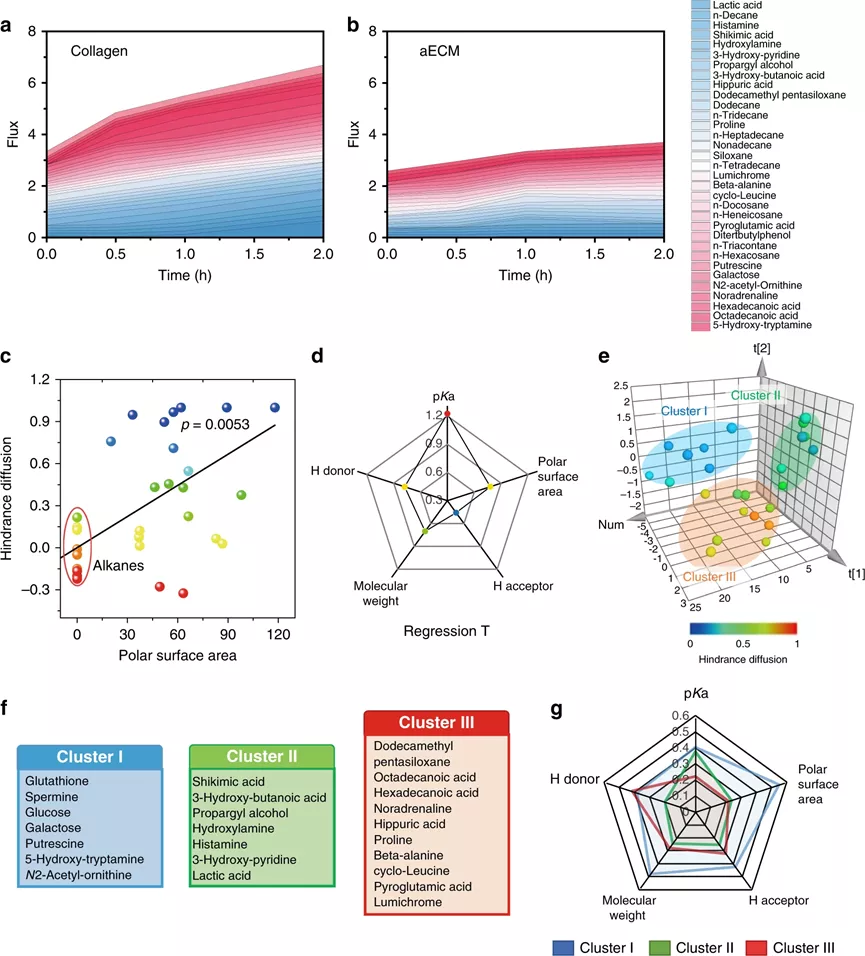
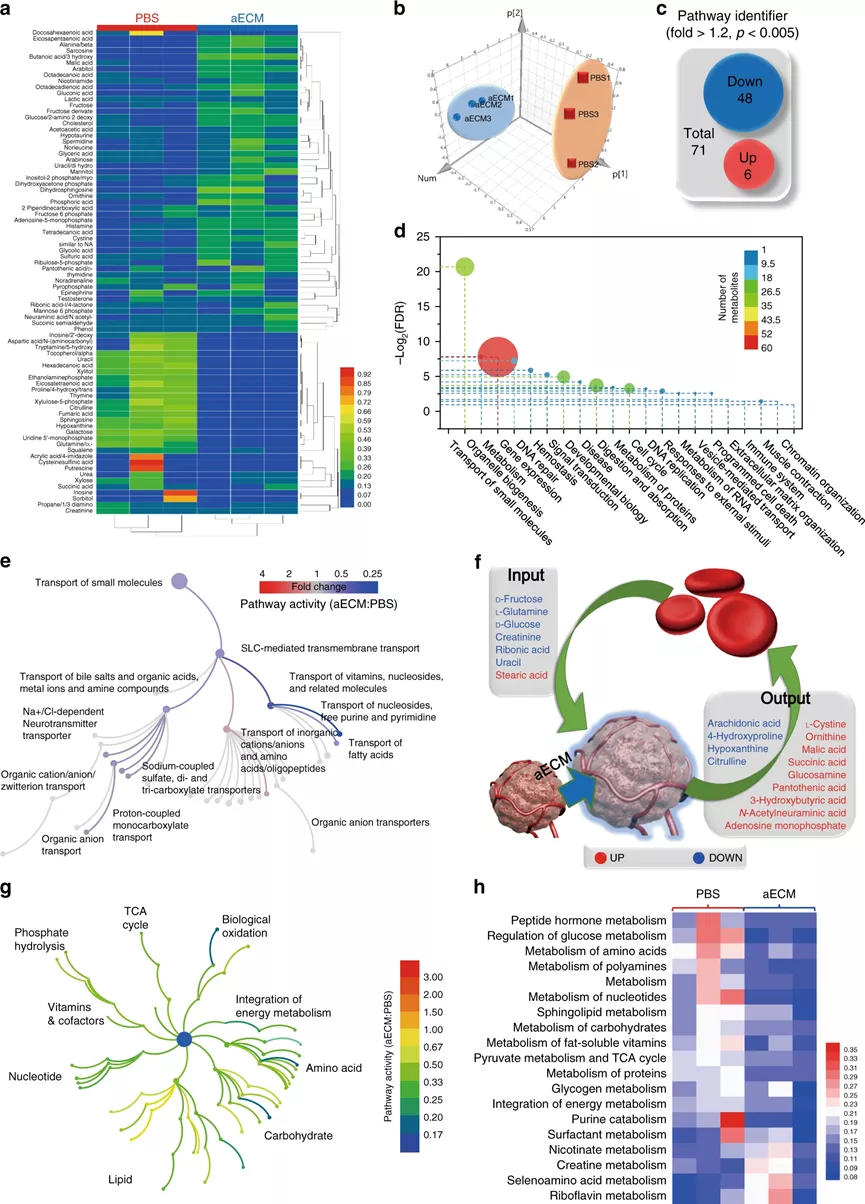
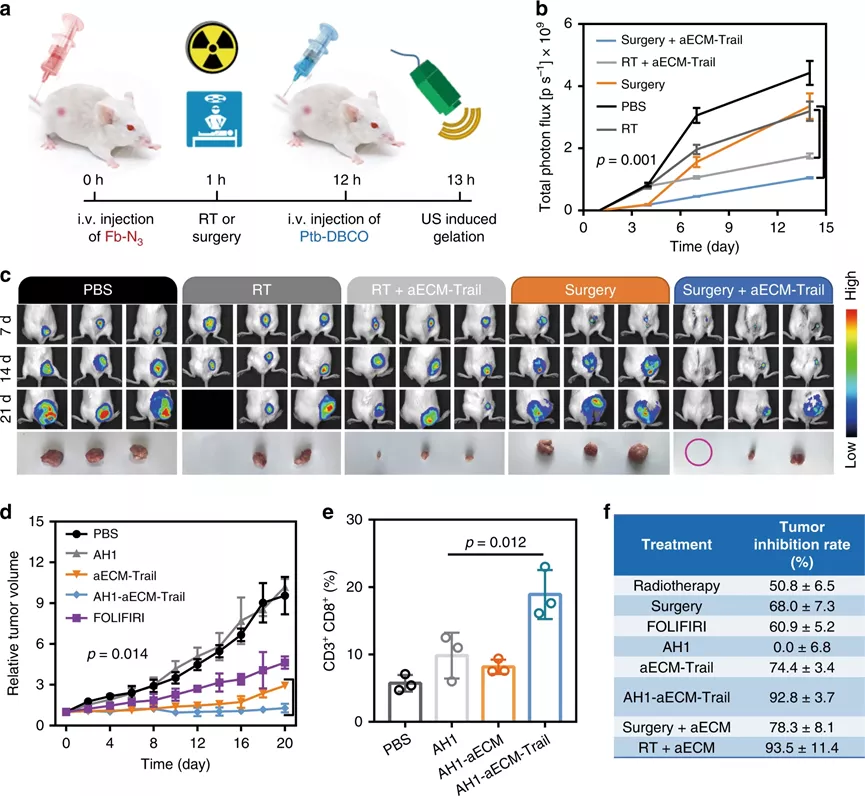
相對于正常組織,腫瘤的代謝是經過重編程的,代謝途徑包括有葡萄糖代謝,尿素循環代謝和脂質代謝,其主要目的是最大限度地利用氮/碳源進行大分子代謝合成。針對代謝途徑,科學家相對應地開發出抗癌策略,例如,使用L-天冬酰胺酶用于谷氨酰胺消耗,3-溴丙酮酸用于糖酵解抑制,這些都已經成功進入臨床試驗。但是,腫瘤代謝包含非常多的復雜過程,只關注單一的途徑很難達到很好的臨床效果。作為腫瘤微環境中最重要的非細胞成分之一,ECM對于滿足癌細胞維持快速生長和持續增殖的需求至關重要。據報道,ECM結構的變化會引起限制性的代謝反應,那么,能否通過在ECM中引起化學反應,以切斷營養供應并同時改善腫瘤灌注?鑒于此,啟發于凝血過程,武漢大學張先正教授課題組報告了基于纖維蛋白原和凝血酶的凝血系統,以構建用于選擇性切斷腫瘤代謝通量的人工ECM(aECM)。一旦誘導了微傷口,就可以觸發aECM的級聯凝膠化來圍攻腫瘤。最重要的是,aECM的凝膠化可以通過諸如超聲治療、手術或放射療法之類的臨床操作來誘導,這意味著該策略有可能被轉化為臨床聯合治療方案。成果以題為“Controllable gelation of artificial extracellular matrix for altering mass transport and improving cancer therapies”發表于Nature Communications期刊上。該課題組主要是利用兩種FDA認證的藥物(纖維蛋白原和凝血酶原),其中纖維蛋白原使用疊氮基修飾(Fb-N3),凝血酶原使用偶氮二苯并環辛炔(DBCO)接枝(Ptb-DBCO)。首先,尾靜脈注射Fb-N3后,通過手術、RT或超聲(US)處理形成的微傷口來觸發Fb-N3在腫瘤處特異性累積。然后,再注射Ptb-DBCO,并且利用DBCO和N3基團之間的生物正交反應使得Ptb-DBCO在腫瘤處累積。由于血管結構的改變,Ptb會輕易地轉化為凝血酶,并發生凝血過程。形成地網狀血凝塊圍住腫瘤,產生aECM纖維蛋白凝膠,用于阻斷營養物質交換并防止腫瘤細胞遷移。剛開始,該課題組為了增強aECM的抗癌能力,將腫瘤壞死因子相關的凋亡誘導配體(Trail)與aECM(aECM-Trail)偶聯。后來研究發現,在腫瘤細胞球模型,aECM和aECM-Trail均可以抑制CT26細胞的增殖。經研究發現,aECM處理可以顯著降低3D MTS模型中的細胞內ATP水平,且葡萄糖消耗和乳酸鹽產生顯著減少,因此,結論為:aECM處理可以抑制MTS中的細胞呼吸。此外,水凝膠中的致密結構會限制分子的擴散(對分子擴散有選擇性),從而通過切斷癌細胞的營養攝入而觸發細胞饑餓,但不會加劇細胞缺氧。經分析,具有強極性、低pKa和高分子量的分子更傾向于被aECM阻擋在外。然而,具有高pKa和弱極性的分子可以穿過。細胞行為和代謝組學研究表明,aECM對包括碳水化合物代謝,氨基酸代謝和核苷酸代謝在內的主要代謝過程進行了抑制,這說明aECM切斷了物質運輸并導致了腫瘤特異性饑餓,從而抑制了腫瘤的生長。在原位和自發的鼠類腫瘤模型中,作為腫瘤轉移的物理屏障,aECM還可以阻止癌細胞擴散進入循環系統。此外,該策略抑制了77%的腫瘤生長。最重要的是,aECM的凝膠化可以通過諸如超聲治療,手術或放射療法之類的臨床操作來誘導,這意味著該策略有可能被轉化為臨床聯合治療方案。因此,這種可控的凝膠化策略可以調節腫瘤的代謝,并與手術、逆轉錄、化學療法甚至免疫療法協同作用。綜上所述,這項研究開發了一種基于酶促反應的實體瘤圍捕療法。結合US、手術或RT,成功在多種癌癥類型中誘導了aECM凝膠化。這種能力還確立了將aECM凝膠引入標準治療方案的優勢,以用于大多數癌癥病例的一線治療。盡管目前這種基于酶促反應的療法目前仍處于起步階段,但研究人員認為該策略將為更新當前的癌癥療法和有益于個性化醫學提供一條嶄新的途徑。Zheng, D., et al. Controllable gelation of artificial extracellular matrix for altering mass transport and improving cancer therapies. Nat Commun 11, 4907 (2020).https://doi.org/10.1038/s41467-020-18493-7