人類使用銅及其合金已有數千年歷史了,如青銅器時代,到如今隨處可見的銅制品。同樣,銅在人體里面也是不可缺少的微量營養素,銅在人體內含量約100~150mg,對于人體健康有重要的影響。銅離子在細胞內以輔基的形式參與許多重要的代謝途徑,涉及細胞呼吸、神經遞質的傳遞和抵抗氧化應激等生理過程。
研究表明,乳腺癌患者體內顯示線粒體銅伴侶蛋白和伴侶蛋白COX17和SCO2上調,這表明與正常細胞相比,乳腺癌細胞對銅向線粒體的轉運的需求很高。如果對線粒體銅進行消耗,這將使新陳代謝從呼吸轉變為糖酵解,并降低了能量的產生,這可以有效地抵抗依賴于氧化磷酸化的癌癥類型。
(簡單點理解就是,抓住生物化學中細胞獲取能量的途徑:既然這個癌細胞喜歡通過氧化磷酸化獲取能量,那我就切斷這個途徑,只讓它通過產能較低的途徑進行活性,把供能切斷,那細胞自然而然就被K掉了)
針對細胞利用葡萄糖的幾個階段可看下下圖:
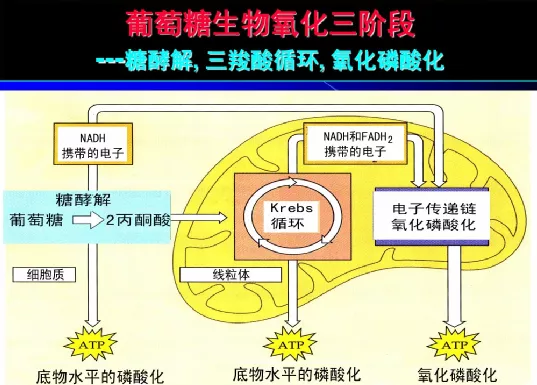
圖自網絡
而對于高轉移風險的三陰性乳腺癌(TNBC)就是其中的一種,TNBC細胞在代謝方面傾向于輸入和利用脂質作為能量,且脂肪酸氧化在TNBC細胞中Src途徑的激活中也至關重要。因此,氧化磷酸化和脂肪酸氧化是TNBC治療的有吸引力的目標。但是,現有的銅螯合劑對于癌癥治療而言過于有毒或無效。
成果簡介
在這里,美國斯坦福大學饒江宏教授等人開發了一種安全的、靶向線粒體的、消耗銅的納米顆粒(copper-depleting nanoparticle,CDN),而對健康組織的副作用降到最小,而且CDN的給藥可抑制腫瘤的生長并顯著提高生存率。其有效性和安全性提示了這種方法的潛在臨床意義。成果以題為“Mitochondrial copper depletion suppresses triple-negative breast cancer in mice”發表在Nature Biotechnology上。

載體設計
CDN結合了兩個組件:耗盡銅的部分(copper-depleting moiety,CDM)和半導體聚合物納米顆粒(SPN)。其中CDM 是由N,N-二(2-吡啶甲基)乙二胺和三碳菁組成。當銅結合時,來自三碳菁的近紅外熒光信號被猝滅,提供了螯合的實時反饋。值得注意的是,加入CDM后,CDN整體顯示正電荷,這有助于線粒體的靶向性。
使用兩個SPN生成具有不同光學特性的CDN。SPN在1100nm處是光聲的,并且可以通過光聲成像在體內無創地追蹤。當與來自CDM的熒光信號變化進行耦合時,系統的光信號可以報告CDN的數量以及目標器官中銅的結合狀態。fCDN是一種基于熒光共振能量轉移(FRET)的配方,其中聚合物充當FRET供體,CDM充當受體。fCDN通過熒光比例成像檢測銅結合,適用于細胞機制研究和離體定量。
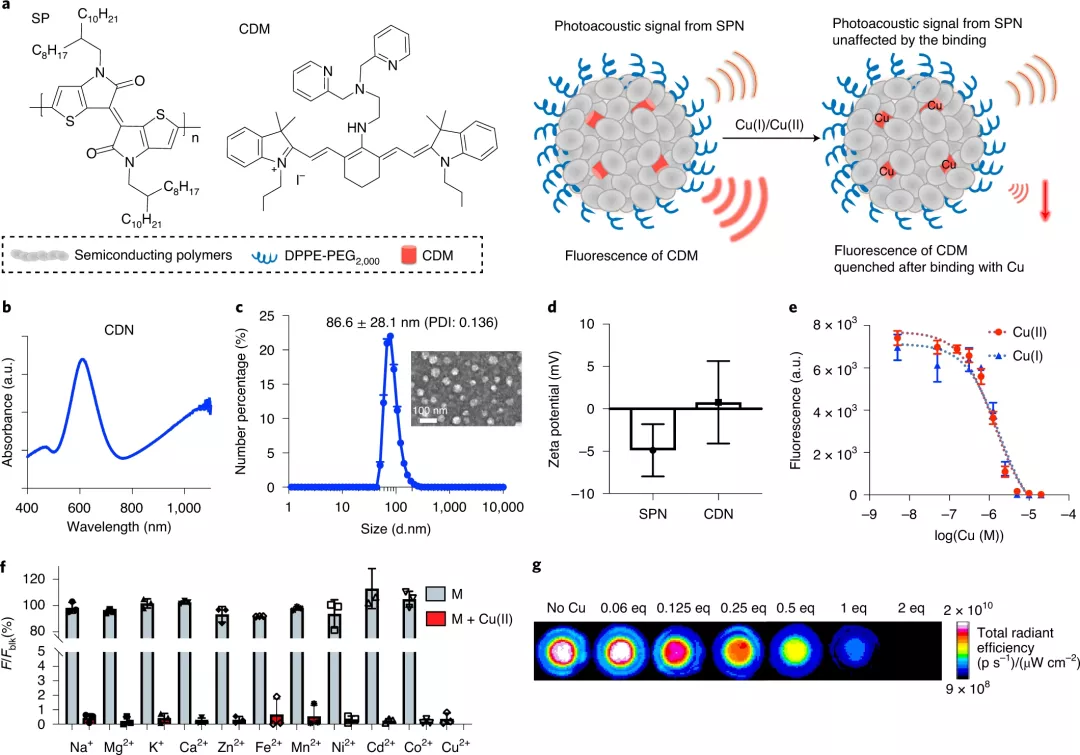
圖|CDN的設計和表征
整體作用過程:
1)首先,利用癌細胞線粒體高的負跨膜電位,偶聯的帶正電的熒光部分可將螯合劑直接導向癌細胞的線粒體,實現CDN在細胞內線粒體中的累積和線粒體膜電位受損,并有利于局部的銅消耗。
2)線粒體中的銅耗竭的直接結果COX活性下降,這隨后導致細胞氧化磷酸化(OXPHOS)的關閉,干擾了OXPHOS相關的細胞生物能。
3)CDNs減少耗氧量和氧化磷酸化后,這就引起細胞的代謝途徑的改變,使得TNBC細胞經歷了從OXPHOS到糖酵解的代謝轉換,并減少TNBC細胞中的ATP產生。這種能量缺乏以及線粒體膜電位受損和氧化應激升高會導致細胞凋亡。
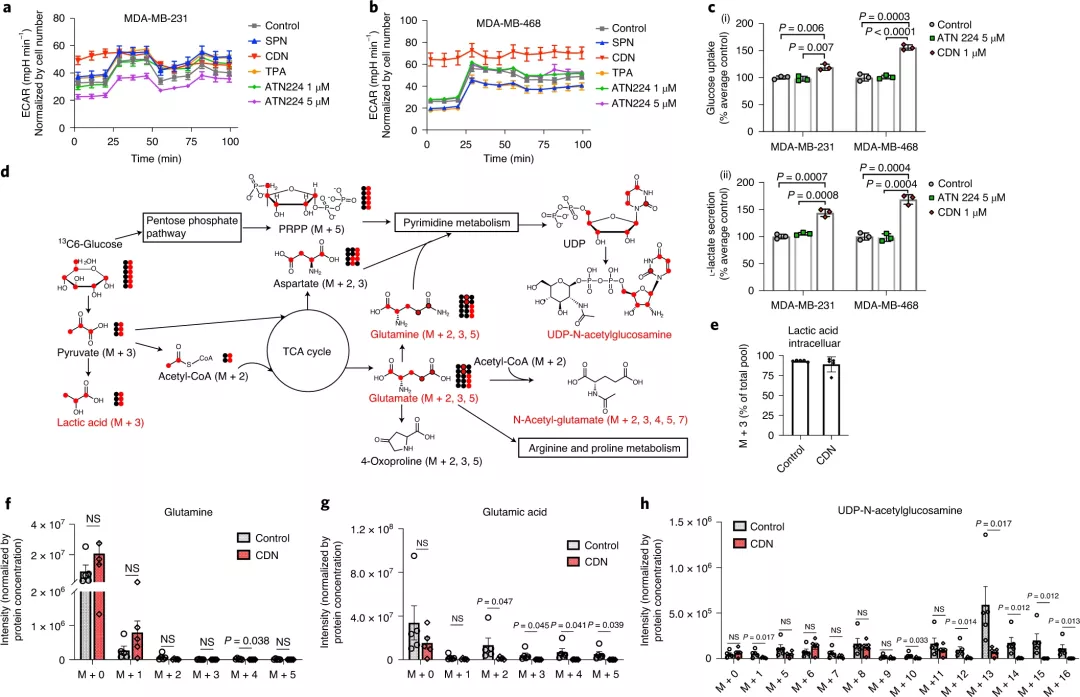
圖|CDN誘導的線粒體OXPHOS抑制作用改變TNBC細胞的代謝
維持低銅水平長達5天
為了研究體內的銅消耗動力學,研究人員縱向觀察了CDN給藥后MDA-MB-231luc腫瘤中CCL-1生物發光、CDM熒光和SPN光聲信號。結果表明,單次注射后,CDN可以在腫瘤區域積聚,局部消耗銅,并在腫瘤中維持低銅水平長達5 天。而且,CDN表現出更高的耗竭效率和更好的治療功效,并且損害了線粒體膜電位,從而促進了癌細胞的凋亡。
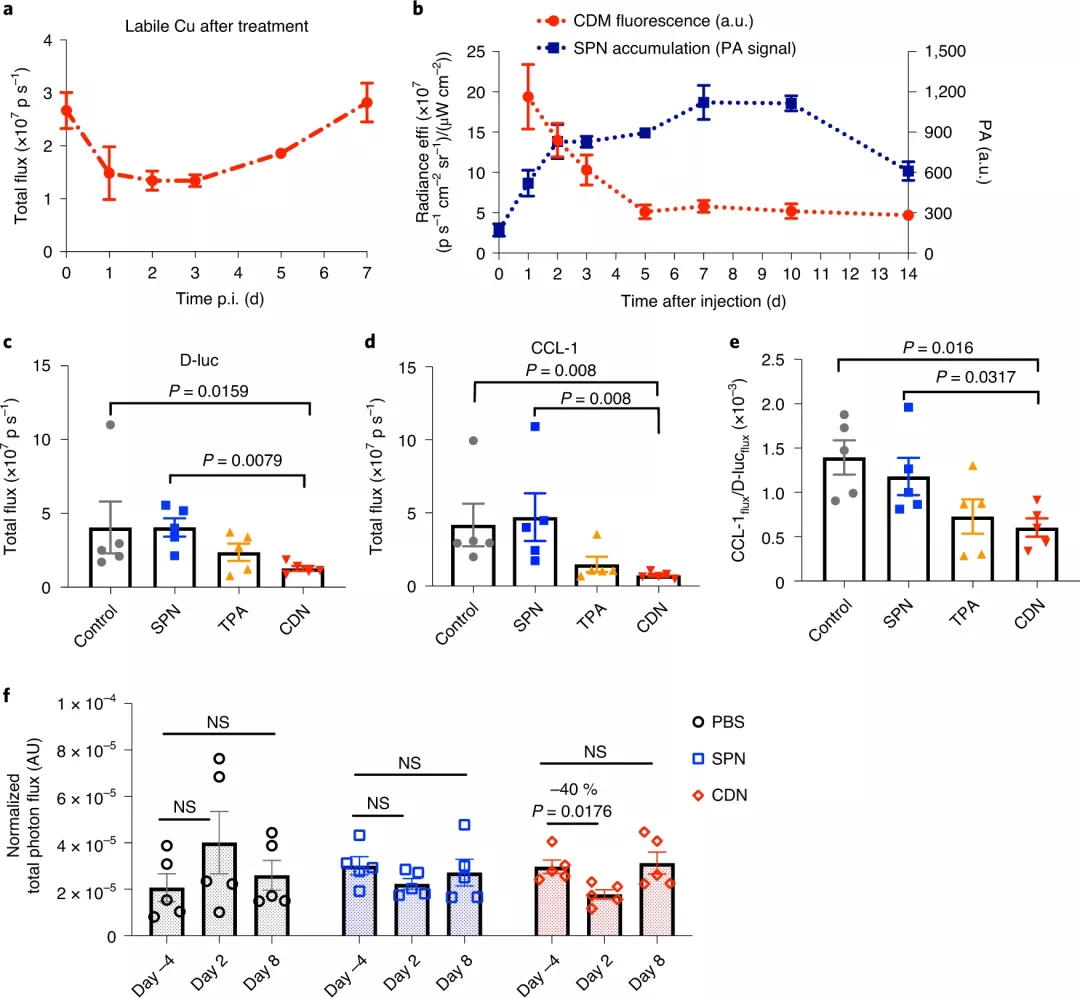
圖| CDN在體內有效消耗銅
CDN是TNBC的有效安全藥物
CDN的毒性應低于現有的銅螯合劑,因為它們優先剝奪了癌細胞線粒體中的銅,而不是全身消耗。實際上,研究人員證明了CDN在健康小鼠中的低毒性。在TNBC的三種小鼠模型中,CDN的給藥可抑制腫瘤的生長并顯著提高生存率。
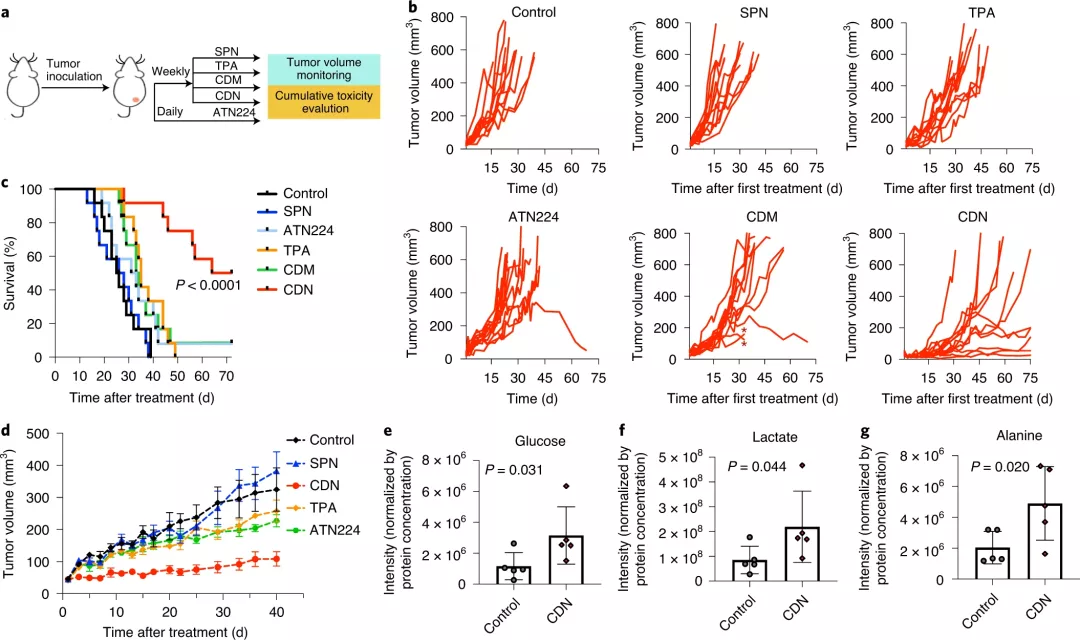
圖| CDN抑制TNBC腫瘤生長
小結:
總而言之,通過利用CDN導致的銅耗竭,導致能量和營養缺乏以及氧化應激和線粒體膜破裂的加劇,這些都導致TNBC細胞凋亡。CDN的設計和應用可能會為消耗銅的癌癥干預開辟新的途徑。
參考文獻:
1. Cui, L., et al. Mitochondrial copper depletion suppresses triple-negative breast cancer in mice. Nat Biotechnol (2020).
https://doi.org/10.1038/s41587-020-0707-9
2. 糖酵解與氧化磷酸化:https://wenku.baidu.com/view/454628b06ad97f192279168884868762caaebbaa.html











