2018年,諾貝爾生理學(xué)或醫(yī)學(xué)獎授予美國科學(xué)家James P. Allision和日本科學(xué)家Tasuku Honjo,以表彰他們在癌癥免疫治療方面所作出的開創(chuàng)性貢獻。這足以說明基于免疫的癌癥治療取得了顯著成功。盡管獲得如此成就,但是存在的問題還亟待解決,例如,并非所有人都對這些方法產(chǎn)生反應(yīng),而且經(jīng)治療后癌癥確實還會復(fù)發(fā)。世界各地的研究人員都在競相尋找提高免疫療法患者治療效果的方法。
目前,大多數(shù)現(xiàn)有的免疫治療方法,包括檢查點阻斷和CAR T療法,旨在促使免疫系統(tǒng)發(fā)現(xiàn)并殺死癌細(xì)胞,這是對該疾病的一種正面攻擊。
這里面存在一個問題,好像大家都集中把注意力放在正面攻擊上了,然而腫瘤地微環(huán)境非常復(fù)雜,它需要一個類似安全港地支持性環(huán)境以維持腫瘤在里面進行生長和繁衍,例如血管供應(yīng)。顯然正面戰(zhàn)場不是免疫系統(tǒng)保護我們免受威脅的唯一辦法,因為它還可以促進受損組織的愈合,從而使病原體無法在體內(nèi)扎根。
那么,既然現(xiàn)在正面戰(zhàn)場難以進攻,能否轉(zhuǎn)向敵后戰(zhàn)場?即能否對這些安全港進行破壞進而與內(nèi)部的癌癥敵人進行間接式對抗?
答案是肯定的!
新突破!背靠背發(fā)2篇Nature
近日,來自紀(jì)念斯隆-凱特琳癌癥中心的Ming O. Li(李銘)等人在Nature 期刊上同日發(fā)表兩篇論文來支持這一概念。他們現(xiàn)在把目標(biāo)轉(zhuǎn)向免疫系統(tǒng)修復(fù)組織受損過程,即鼓勵免疫細(xì)胞開始圍繞腫瘤的傷口修復(fù)過程,從而把滋養(yǎng)癌癥的血管剪掉,進而把癌細(xì)胞餓死并死亡。作者稱之為“癌癥環(huán)境免疫療法”。
這兩篇論文中,第一篇為闡釋作用機制研究,第二篇為利用該機制進行藥物開發(fā)和治療研究。

論文1

論文2
為什么傷口愈合過程可以遏制癌癥呢?
那就得從人受傷(例如用刀割傷)時候會發(fā)生什么說起。早期,該部位會發(fā)炎,如發(fā)紅、發(fā)燙和腫脹。在傷口愈合的這一階段,血管會擴張,免疫細(xì)胞涌入與可能引起感染的敵人作戰(zhàn),并清除碎片。到后來,傷口充滿了新的組織,炎癥就消退了。
傷口愈合過程中的重要角色是稱為TGF-β的分子,該分子的存在隨著炎癥周期的增加而減弱。在癌性“傷口”的背景下,TGF-β持續(xù)存在,并使癌癥的生長惡化。相反,阻斷其作用可抑制腫瘤的發(fā)展。先前的研究表明,后者的作用取決于免疫細(xì)胞——T細(xì)胞。
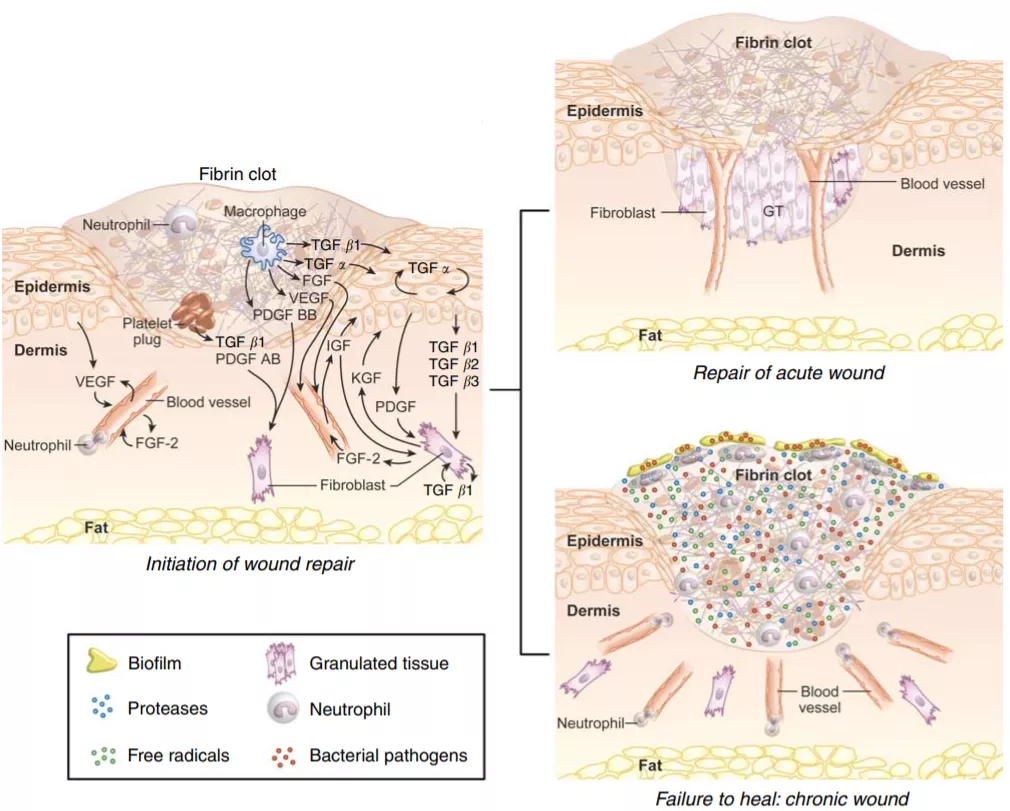
圖|急性傷口愈合反應(yīng)
那究竟是哪些T細(xì)胞起作用?
破除教條
該研究團隊在第一篇Nature論文上的研究表明,轉(zhuǎn)化生長因子β受體2(TGFBR2)的消耗存在于 CD4+ T 細(xì)胞,而非CD8+ T 細(xì)胞,實現(xiàn)以組織愈合和血管系統(tǒng)重塑而停止癌癥的發(fā)展,進而導(dǎo)致癌細(xì)胞缺氧和遠(yuǎn)處無血管區(qū)域的死亡。
我們知道, CD4+ T 細(xì)胞為輔助性T細(xì)胞,而CD8+ T 細(xì)胞為殺傷性T細(xì)胞。當(dāng)前如果涉及到T細(xì)胞介導(dǎo)的癌癥免疫治療的話,科學(xué)家們肯定會把焦點放在CD8毒性T細(xì)胞上,CD8殺傷性T細(xì)胞幾乎成了該領(lǐng)域的教條,作者最初也是從CD8T細(xì)胞進開始行研究的,但是發(fā)現(xiàn)并不能有效抑制腫瘤的生長,然后發(fā)現(xiàn)在該過程CD4輔助性T細(xì)胞才是關(guān)鍵參與者!
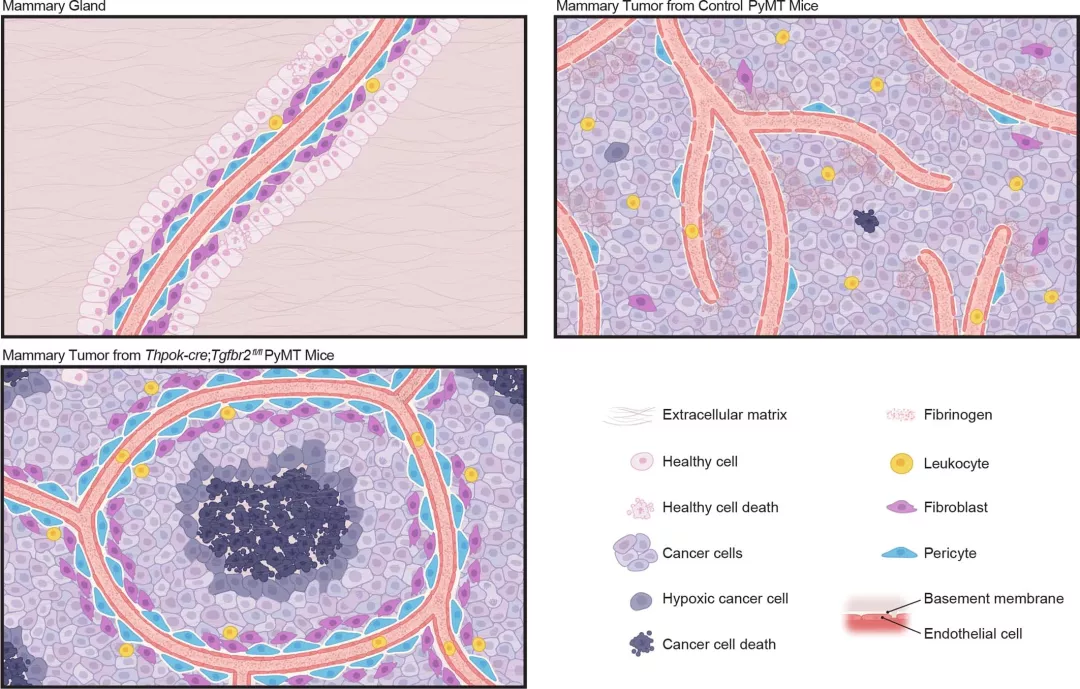
圖|CD4+ T細(xì)胞中TGF-β信號傳導(dǎo)的阻滯可重新編程腫瘤血管,并阻止癌癥進展
但是,已經(jīng)在生長的腫瘤又如何呢?僅是阻斷TGF-β可以抑制它們嗎?
下面該研究團隊在第二篇Nature論文中探討了這個問題。
他們設(shè)計了一種可以結(jié)合TGF-β和輔助T細(xì)胞的抗體基藥物。發(fā)現(xiàn)這種被稱為4T-Trap的藥物可以顯著減少小鼠的癌癥。
先前阻斷TGF-β作為癌癥治療的嘗試并未成功,可能是因為該分子在體內(nèi)具有多種作用,因此完全阻斷它會導(dǎo)致嚴(yán)重的副作用,例如心臟問題,甚至出現(xiàn)新的癌癥。但是4T-Trap可直接靶向CD4+ T細(xì)胞的TGF-β阻斷分子,因此減少了副作用。
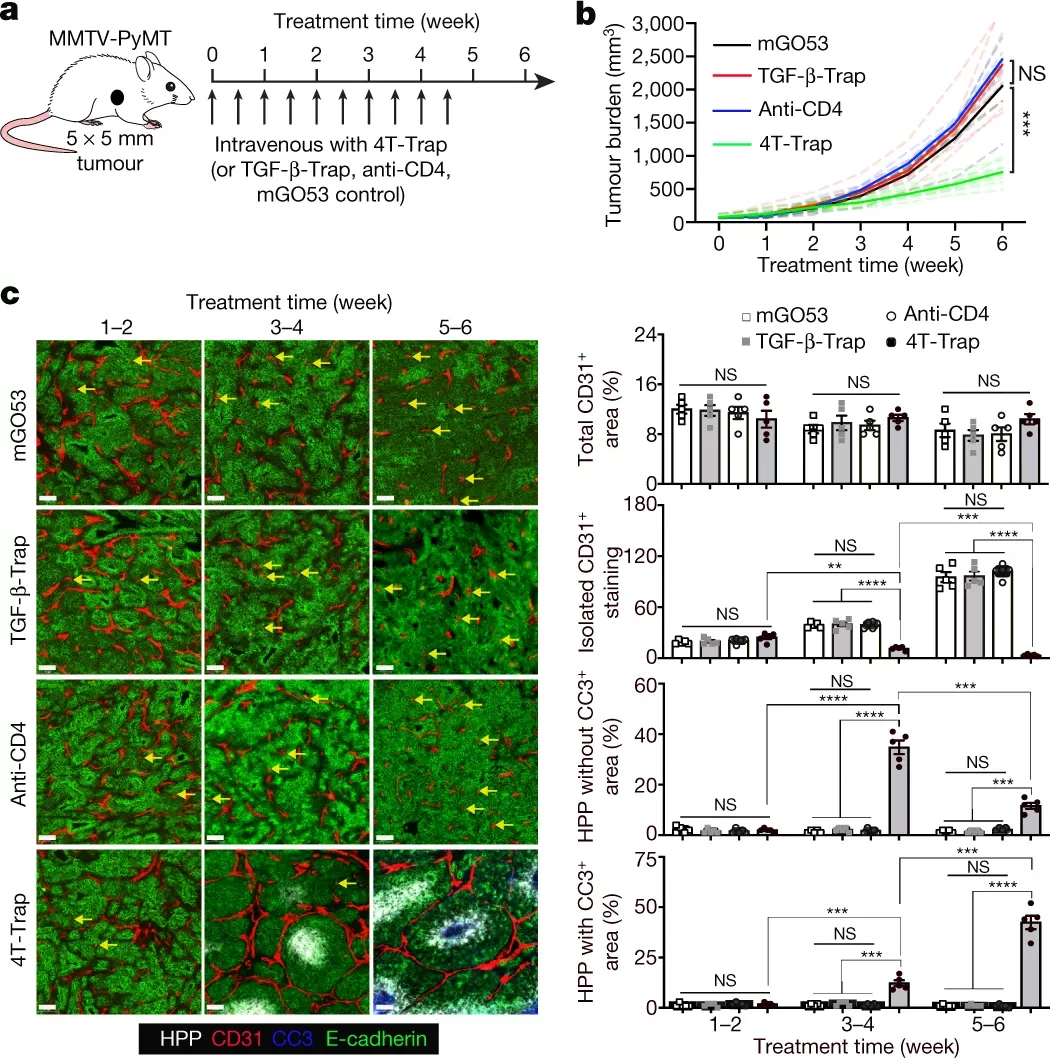
圖|4T-Trap重編程腫瘤血管以致癌細(xì)胞缺氧和癌細(xì)胞死亡
與30年前研究不謀而合!
然而,該發(fā)現(xiàn)并不完全是前所未有的。實際上,促進傷口愈合可以極大地抑制癌癥的進展的這一發(fā)現(xiàn)與1986年Harold F. Dvorak在NEJM雜志上發(fā)表的一篇著名論文相呼應(yīng),中心思想不謀而合。
Harold F. Dvorak在論文中指出,腫瘤本質(zhì)上是“無法治愈的傷口”。腫瘤需要正常的傷口愈合以幫助自身生長。他們通過爭取對組織損傷的免疫反應(yīng)的早期階段(例如,新血管的生長)而蓬勃發(fā)展,但是通常這些血管會被重新修剪,以至于它們再也不會進入傷口愈合的后期階段。

小結(jié):
綜上所述,該研究團隊發(fā)現(xiàn)了另一條癌癥免疫治療的新策略,即:通過阻斷輔助性T細(xì)胞中的TGF-β,然后把癌癥的傷口愈合上,進而殺死腫瘤。這種“癌癥環(huán)境免疫療法”可以成為當(dāng)前基于免疫的癌癥治療的有力補充。據(jù)悉,該研究團隊也正在與該中心的醫(yī)生合作,努力把該研究推進臨床!
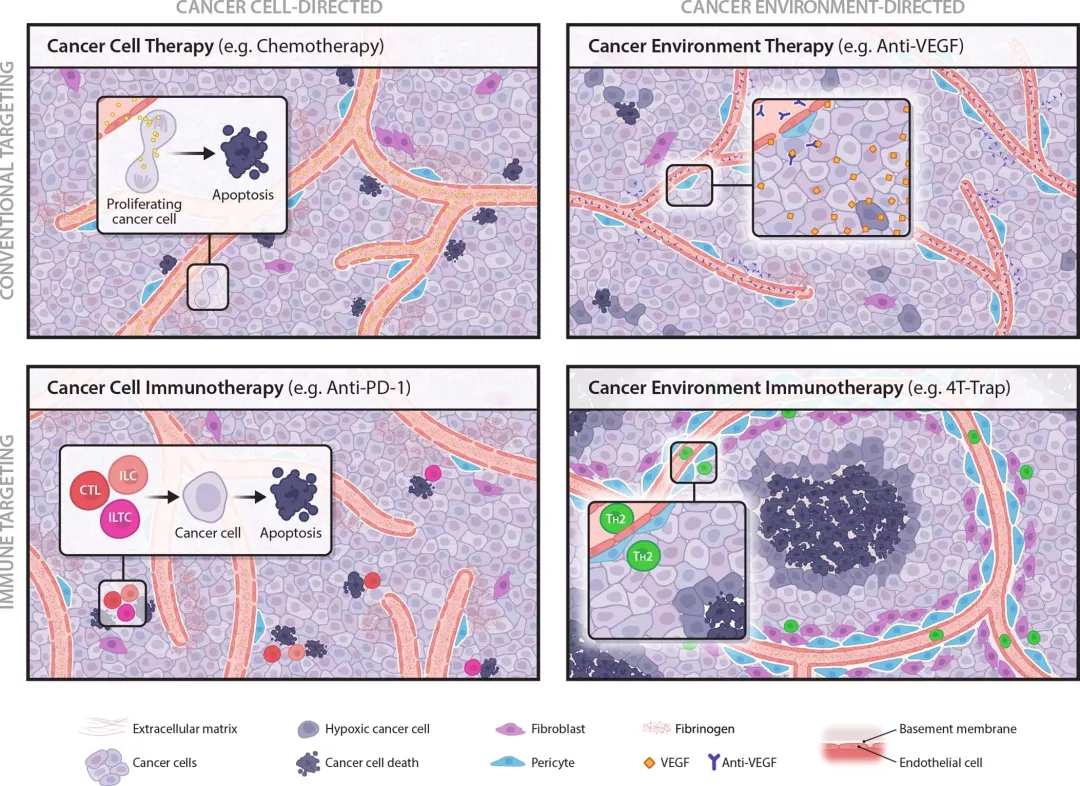
圖|癌癥治療的幾個領(lǐng)域
編者語:
這兩篇研究論文非常有意思,作者從人體自身免疫過程的另一角度出發(fā),把傷口愈合過程與腫瘤自身發(fā)展過程的聯(lián)系起來,針對該過程進行免疫治療的研究,并跳出慣性思維,然后針對此通路開發(fā)藥物,實現(xiàn)有效的腫瘤治療效果,為了癌癥免疫治療開辟了新途徑!
參考文獻及來源:
1. Liu, M., et al. TGF-β suppresses type 2 immunity to cancer. Nature (2020). https://doi.org/10.1038/s41586-020-2836-1
2. Li, S., et al. Cancer immunotherapy via targeted TGF-β signalling blockade in TH cells. Nature (2020). https://doi.org/10.1038/s41586-020-2850-3
3.https://www.mskcc.org/news/msk-led-studies-support-concept-cancer-environment-immunotherapy?_subsite=research-ski
4. Clark RA, et al., Tissue engineering for cutaneous wounds. J Invest Dermatol 127:1018-1029.
DOI: 10.1038/sj.jid.5700715
5. Harold F. Dvorak. Tumors: Wounds That Do Not Heal. N Engl J Med 1986; 315:1650-1659
DOI: 10.1056/NEJM198612253152606
作者簡介:

Ming O. Li(李銘),畢業(yè)于復(fù)旦大學(xué),哥倫比亞大學(xué)博士,免疫學(xué)家,2007年加入 Sloan Kettering Institute’s Immunology Program,致力于剖析T細(xì)胞調(diào)節(jié)的分子和細(xì)胞機制,重點是TGF-β途徑,以及腫瘤發(fā)展的免疫控制。多篇論文發(fā)表在Nature, Science, Cell頂級雜志上。











