作為血液系統(tǒng)惡性腫瘤之一,白血病嚴(yán)重威脅人類健康。急性髓細(xì)胞性白血病(AML)的5年總生存率僅約為27%。盡管對(duì)于急性淋巴細(xì)胞白血病(ALL),該值可以提高到約40%,但對(duì)于老年患者,預(yù)后總是不理想(5年總生存率通常低于20%)。這強(qiáng)調(diào)了迫切需要開發(fā)安全和高性能抗白血病治療方法的方法。
最近,免疫療法已成為白血病治療的突破。例如,眾所周知的CAR-T細(xì)胞療法。盡管該療法非常有前途,但是全身暴露于CAR-T細(xì)胞會(huì)導(dǎo)致一些副作用,包括細(xì)胞因子釋放綜合征(CRS),神經(jīng)毒性和腫瘤溶解綜合征,所以,仍需要采取其他措施以防止它們發(fā)生。除此之外,還有部分人使用該療法后會(huì)出現(xiàn)腫瘤復(fù)發(fā)。
解決該問題的一種可能途徑是使用佐劑。盡管在大多數(shù)方案中都進(jìn)行了重復(fù)疫苗接種,但其效果仍未達(dá)到預(yù)期。阻礙免疫反應(yīng)主要?dú)w因于兩個(gè)方面。
1)一方面,表位肽的快速清除縮小了新招募的APC在疫苗接種位點(diǎn)攝取的時(shí)間窗口,導(dǎo)致細(xì)胞內(nèi)呈遞的底物水平低。
2)另一方面,患者的T細(xì)胞和白血病細(xì)胞也上調(diào)抑制性表面分子(如PD-1/PD-L1),來介導(dǎo)T細(xì)胞無反應(yīng)性,這為針對(duì)白血病的治療性疫苗接種帶來了進(jìn)一步挑戰(zhàn)
那么,如何防止表面肽的快速清除和阻斷抑制性表面分子?
成果簡介
鑒于此,南方醫(yī)科大學(xué)珠江醫(yī)院李玉華和中國科學(xué)院過程工程研究所馬光輝、魏煒等人開發(fā)了一種治療性疫苗,可將表位肽和PD-1抗體共封裝在自愈性的微膠囊中,以治療白血病。相關(guān)成果以“Therapeutic vaccination against leukaemia via the sustained release of co-encapsulated anti-PD-1 and a leukaemia-associated antigen”為題,發(fā)表在Nature Biomedical Engineering上。

基于臨床病人發(fā)現(xiàn)兩種異常表達(dá)
通過分析來自11位ALL患者和7位AML患者的癌細(xì)胞發(fā)現(xiàn),白血病中也存在Eps8過表達(dá)(先前已確定存在于實(shí)體瘤中),而且PD-1/PD-L1在白血病患者中也存在高表達(dá)現(xiàn)象。因此,可以針對(duì)該兩種異常表達(dá)的現(xiàn)象設(shè)計(jì)出一種新策略。
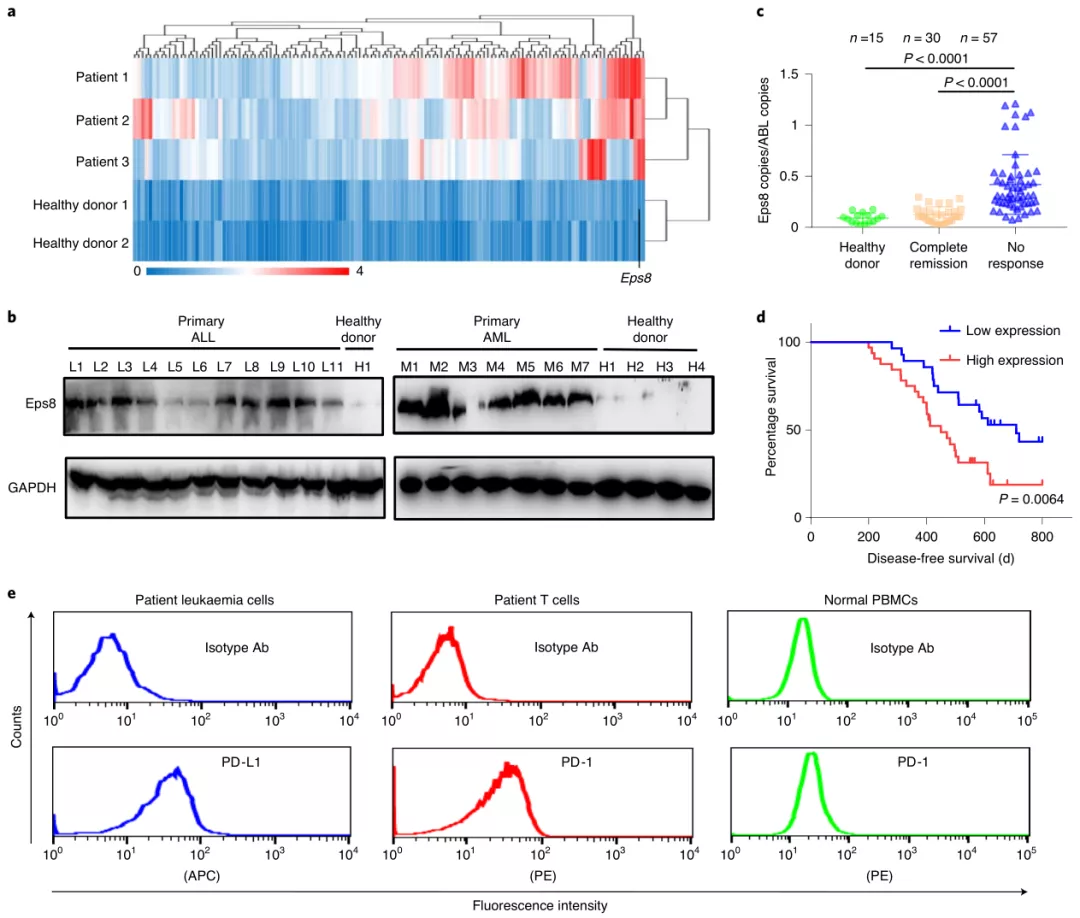
圖|Eps8和PD-1 / PD-L1在急性白血病中的高表達(dá)
如何構(gòu)建疫苗?
研究人員主材料使用的是FDA批準(zhǔn)的聚乳酸。
首先,利用雙乳化法形成具有非常多孔的巨型微球,然后把表位肽(pE)和PD-1抗體(aP)通過擴(kuò)散的方式進(jìn)行孵育。
接著,當(dāng)暴露于溫和的紅外輻射下,溫度略有升高(最高38°C)觸發(fā)了聚乳酸的玻璃化轉(zhuǎn)變(這歸因于聚合物鏈的重排)。在這種情況下,表面上的孔會(huì)愈合,從而導(dǎo)致微膠囊的形成(尺寸分布幾乎沒有變化)。相應(yīng)地,可以共包封大量pE和aP。
簡便的制備方法(產(chǎn)業(yè)化的前提)
要注意的是,這個(gè)包封藥物前后順序的過程也很重要,傳統(tǒng)的方式是通過涉及復(fù)雜的過程、機(jī)械攪拌和有機(jī)溶劑的預(yù)封裝方法,而該后封裝方式更有利,只需簡單混合、而且條件溫和以及無需有機(jī)溶劑的存在。而且通過改變pE和aP的比例來優(yōu)化配方。經(jīng)實(shí)驗(yàn)發(fā)現(xiàn),它們還以持續(xù)的方式在體外釋放超過1個(gè)月,這揭示了它們?cè)隗w內(nèi)的長期功效。

圖|自愈微膠囊的制備與表征
實(shí)質(zhì)性改善CTL的激活
單次給藥后,在疫苗接種部位產(chǎn)生的有利趨化因子和細(xì)胞因子募集了APC并使其活化。相應(yīng)地,表位肽可被募集的APC有效攝取,而PD-1抗體則被轉(zhuǎn)運(yùn)至淋巴結(jié)進(jìn)行T細(xì)胞調(diào)節(jié)。通過這些功能的配合,在特異性細(xì)胞毒性淋巴細(xì)胞(CTL)的激活方面取得了實(shí)質(zhì)性的改善。
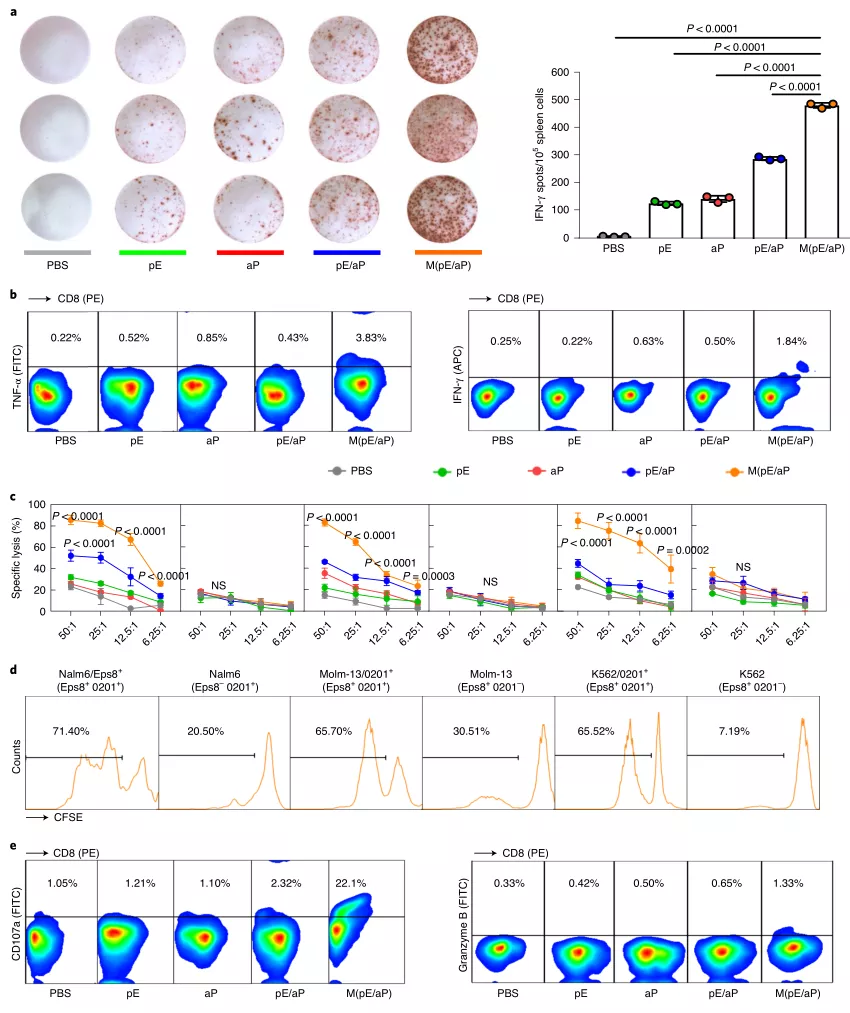
圖|對(duì)白血病細(xì)胞的有效CTL反應(yīng)
可針對(duì)臨床各種白血病
研究人員還驗(yàn)證了在不同模型中使用各種表位肽的新型疫苗的可用性,例如鼠類白血病,人源化細(xì)胞系白血病異種移植物(CDX)和患者源性白血病異種移植物(PDX)模型。在所有白血病治療模型中,基于微膠囊的制劑均表現(xiàn)出優(yōu)于ISA佐劑(商業(yè)化佐劑)的性能,這表明基于微膠囊的疫苗有望用于臨床中的各種白血病抗原。
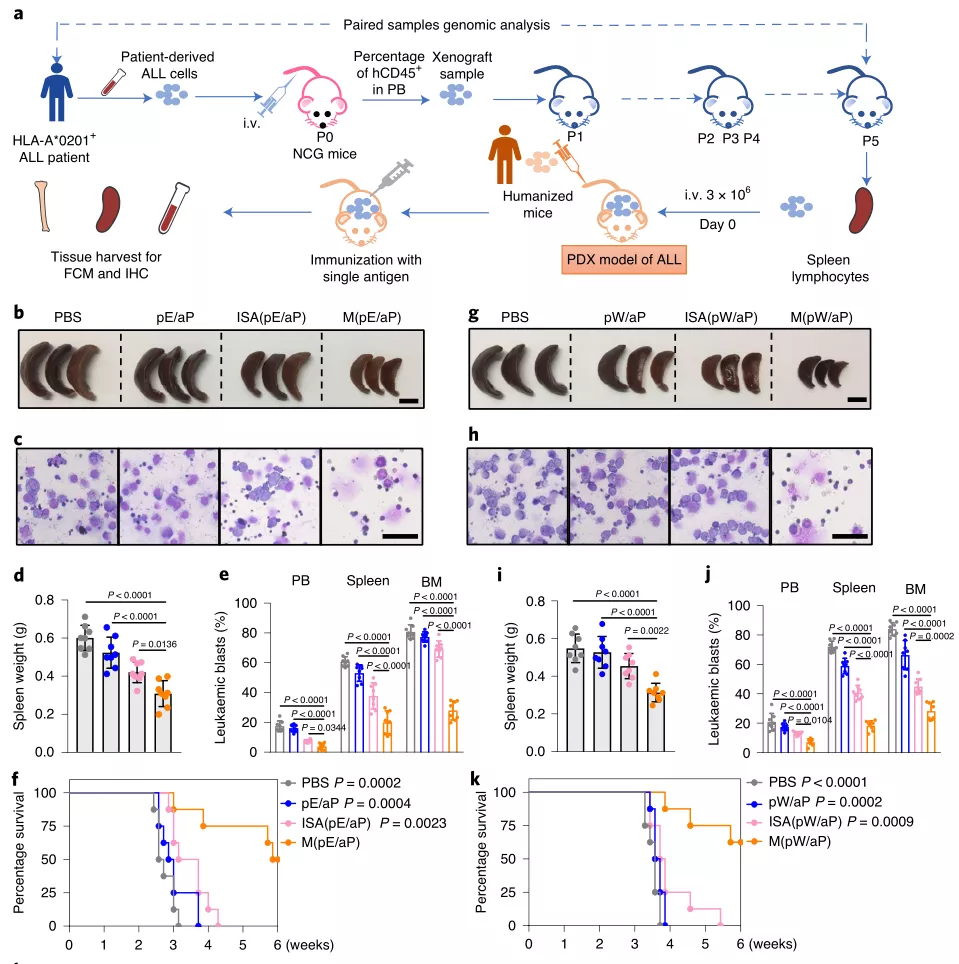
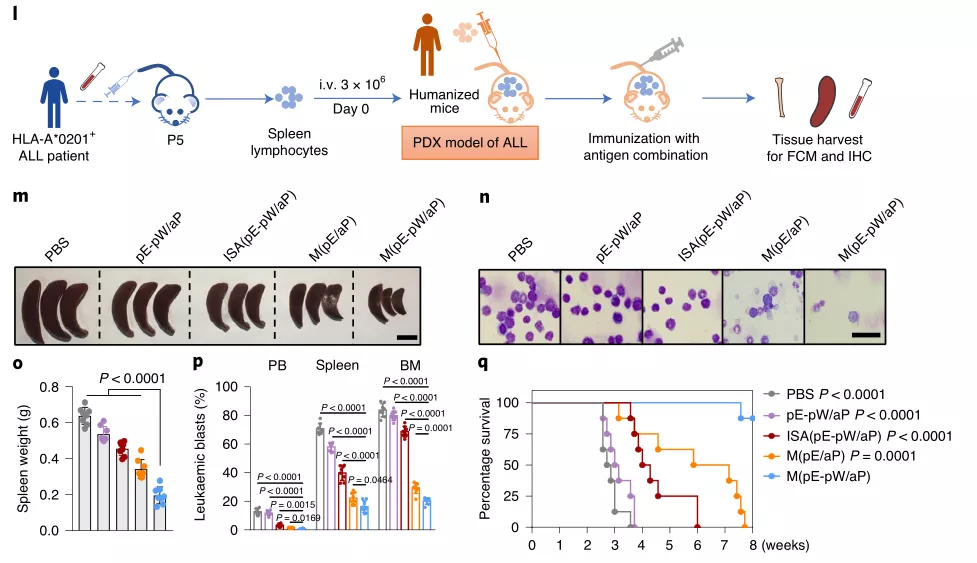
圖|PBMCs-PDX模型中有效的抗白血病活性
小結(jié):
根據(jù)臨床發(fā)現(xiàn)顯示白血病患者中Eps8和PD-1 / PD-L1的高表達(dá),研究人員開發(fā)了一種基于微囊的簡便系統(tǒng),用于高性能治療性疫苗接種。該疫苗的安全性和高性能,再加上使用FDA批準(zhǔn)的聚乳酸材料,以及針對(duì)多種白血病細(xì)胞和抗原的多功能性,強(qiáng)烈表明該疫苗可以作為一種有前景的免疫療法用于治療白血病。
參考文獻(xiàn):
Xie, X., et al. Therapeutic vaccination against leukaemia via the sustained release of co-encapsulated anti-PD-1 and a leukaemia-associated antigen. Nat Biomed Eng (2020).
https://doi.org/10.1038/s41551-020-00624-6











