骨質疏松癥是一種常見的骨病,每年導致900萬新骨折。除了給全世界數以百萬計的人造成嚴重的慢性疼痛外,它還對既定的醫療程序(尤其是骨骼和牙齒植入)提出了額外的挑戰,這有兩個主要原因。
1)首先,骨質疏松癥全身性地減少了骨量,減少了骨祖細胞的數量和活性,增加了骨折的風險,并延長了愈合過程。
2)其次,骨質疏松癥伴有持續性炎癥,這破壞了局部骨免疫平衡,進一步破壞了骨植入物的整合并阻礙了傷口的愈合。
因此,盡管現代植入物在正常情況下獲得較高的成功率,但仍難以建立理想的骨-植入物結構連接并在骨質疏松條件下遇到更多的失敗。
改善骨-植入物整合的新方法應解決炎癥的基本難題:在早期需要適當的炎癥,但應在以后加以抑制以更好地愈合,尤其是在骨質疏松癥下。然而,仍無法實現體內植入物周圍炎癥的精確開啟和關閉。
成果簡介:
為了應對這一挑戰,澳門大學王春明、南京大學董磊等人設計了一種“過河拆橋”涂層材料,該涂層材料包含可以活化巨噬細胞的聚糖(acBSP)和共價交聯了可以除去巨噬細胞的雙膦酸酯(ALN),并且覆蓋在鈦植入物表面,來改善骨質疏松癥下的骨植入物整合。成果發表在Advanced Functional Materials期刊上

各自成分的功能
聚糖acBSP具有刺激巨噬細胞產生成骨性(例如,抑瘤素M,OSM)和促血管生成性(例如,血管內皮生長因子,VEGF)細胞因子的獨特活性,這在該應用中是理想的。
雙膦酸酯是“ on-off”開關的“觸發器”,具有三個作用:
i)創新地充當交聯劑,以橋接聚糖和Ti表面;
ii)對堿性磷酸酶(ALP)產生反應,堿性磷酸酶是一種早期成骨標記,具有水解磷酸酯鍵的特定酶活性;
iii)誘導巨噬細胞凋亡;
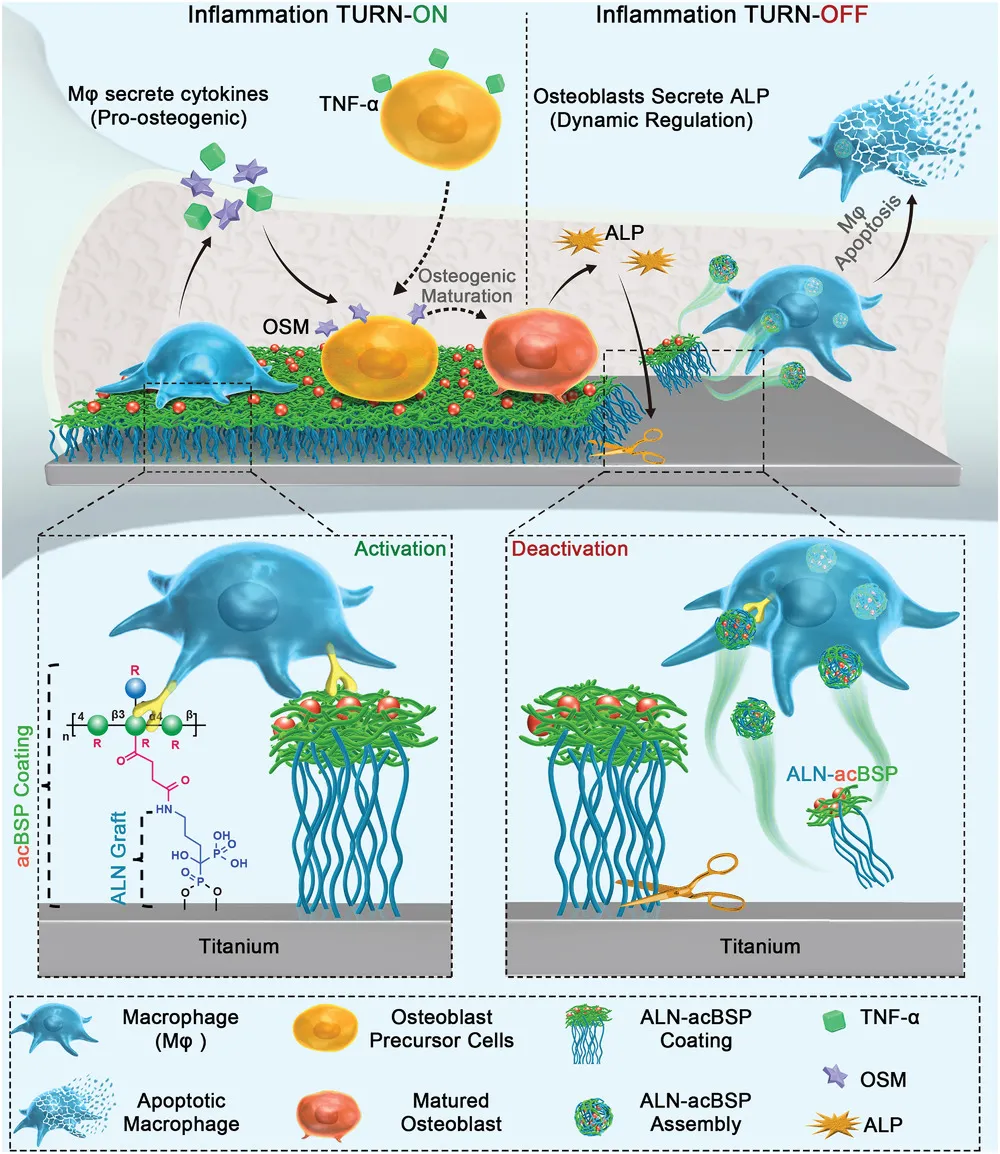
示意圖
過河拆橋的策略
植入后,acBSP將巨噬細胞刺激為理想的促炎和再生表型。同時,acBSP與Ti表面共價鍵合以覆蓋ALN。隨著愈合的進行,巨噬細胞分泌的成骨細胞因子誘導成骨細胞分化并產生ALP,ALP升高至一定水平以開始裂解ALN和Ti之間的磷酸酯鍵,從而從Ti表面釋放出ALN-acBSP復合物。乙酰基的疏水性和葡甘露聚糖糖鏈(和ALN)的親水性使復合物形成納米組件,巨噬細胞可通過碳水化合物受體將其進一步內化并觸發其凋亡,從而導致炎癥消退。
簡單點來講就是,植入后,聚糖指示宿主巨噬細胞釋放促成骨細胞因子(“開啟”),促進骨細胞分化。后來,越來越成熟的骨細胞分泌堿性磷酸酶以從植入物上裂解聚糖-雙膦酸酯復合物,從而選擇性地殺死已經完成其貢獻的促炎性巨噬細胞(“關閉”),因此以“過河拆橋”的方式促進康復。

圖|體外評估Ti-ALN-acBSP的“開啟”效應
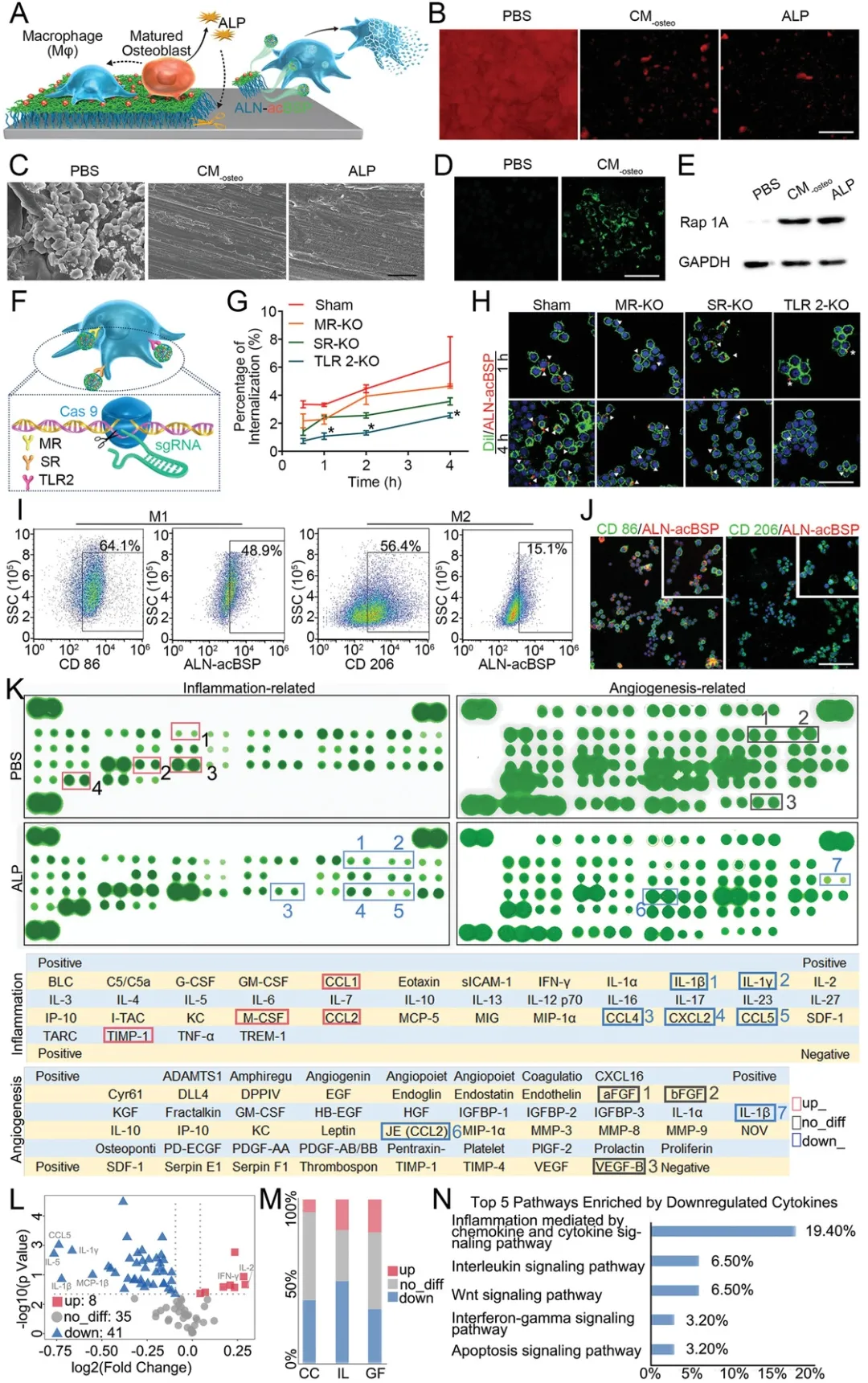
圖|體外評估Ti-ALN-acBSP的“關閉”效應
無需其他手段
通過生理上切換“開-關”炎癥,這種涂層增強了骨質疏松大鼠的骨植入物整合性,改善了植入物周圍的免疫微環境。在整個植入過程中和植入后,沒有使用其他促骨原性細胞因子、轉基因方法、手術程序或免疫抑制藥物來達到這種治療效果。在動物中未觀察到由涂層引起的不良影響。在骨質疏松大鼠模型中的體內檢測表明,該涂層通過調節局部炎癥灶顯著增強骨-種植體的整合(高達88.4%的接觸率)。
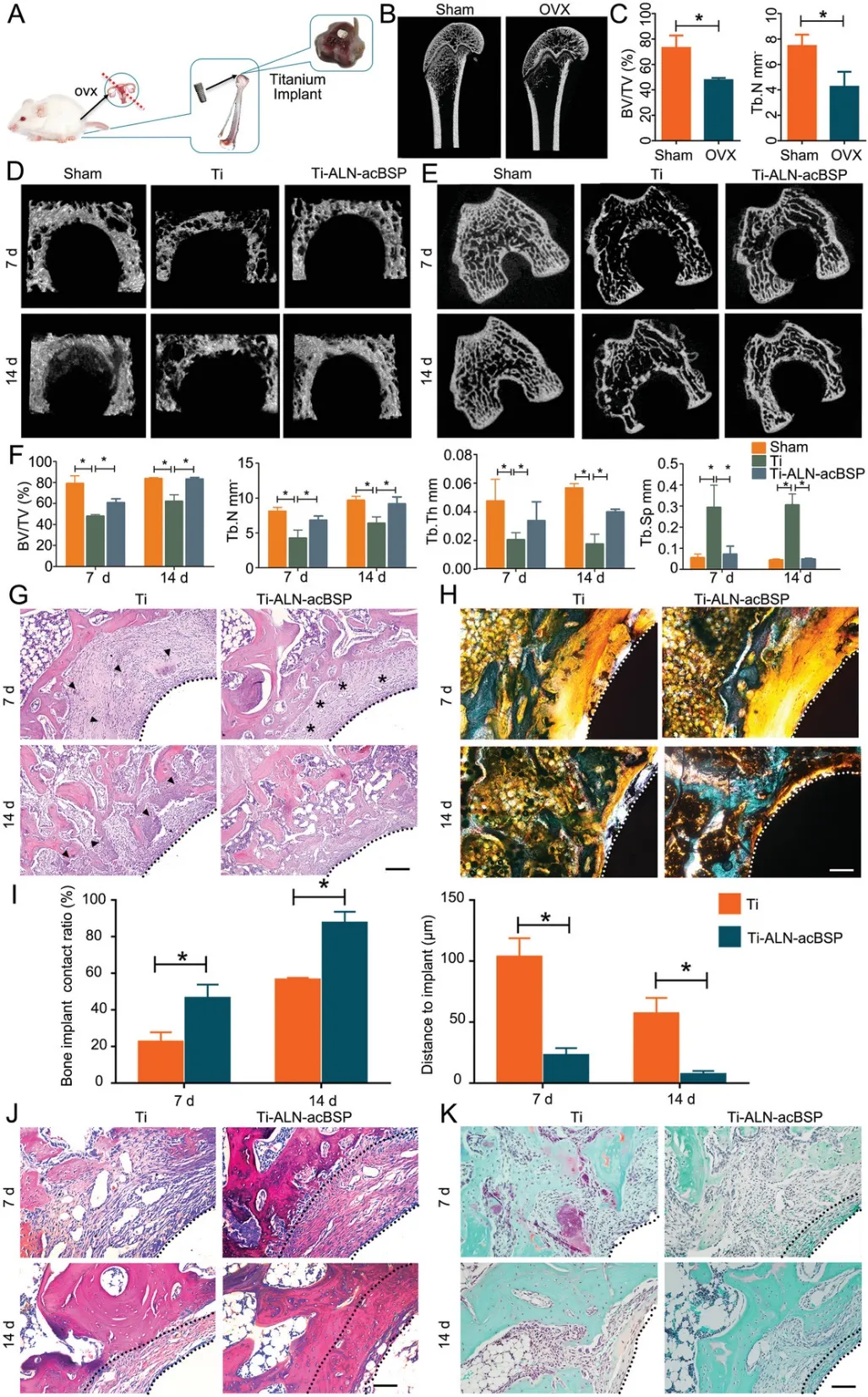
圖|體內評估Ti-ALN-acBSP在大鼠骨質疏松模型中增強的骨整合性能
小結:
綜上所述,本文為Ti植入物設計了一種智能、具有生物活性和生理響應性的聚糖涂層,以改善其在骨質疏松癥病理條件下的治療性能。與抑制宿主免疫反應或炎癥的傳統方法不同,這種涂層系統顯示出植入部位局部炎癥的愈合響應“開-關”調節,雙向利用宿主免疫反應的能力來促進骨植入物整合。
這種免疫調節聚糖涂層代表一種有效,安全,普遍適用的策略,可用于設計廣泛再生應用的新生物材料表面,尤其是為那些患有骨質疏松癥等疾病的患者提供服務的表面。
參考文獻:
Wang, Z., et al., Switching On and Off Macrophages by a “Bridge‐Burning” Coating Improves Bone‐Implant Integration under Osteoporosis. Adv. Funct. Mater. 2020, 2007408.
https://doi.org/10.1002/adfm.202007408











