Samir Mitragotri教授,美國工程院、醫學院院士/美國科學促進會會士/美國醫學生物工程學會會士;美國哈佛大學,工程和應用科學學院教授/Wyss研究所核心研究員;美國國立衛生研究院,基因和藥物傳遞研究部核心成員;美國輝瑞制藥、CTX、 Entrega 、巴黎歐萊雅,高級科學技術顧問;
研究領域:藥物靶向輸送,生物醫學材料,生物啟發工程他在Science, Nature Medicine, Nature Biotechnology, Nature Materials, PNAS, ACS Nano and Advanced Materials.期刊發表200多篇文章,申請100多項專利,多項成果實現臨床應用或實際轉化,并聯合創立7家生物材料科技公司。
奇物論編輯部針對Samir Mitragotri教授近期的研究進行總結,供大家學習和交流1. PNAS: 天然細胞背“鍋”!紅細胞呈遞顆粒再循環,驅動免疫應答!美國兩院院士、哈佛大學教授Samir Mitragotri等人利用紅細胞固有的獨特能力在脾臟中呈遞抗原,從而開發出仿生策略來產生針對抗原的細胞和體液免疫反應(圖1)。即研究人員設計了一個搭便車系統,誘導附著的納米顆粒主要輸送到脾臟而不是肺部,從而實現細胞免疫和體液免疫,這一過程稱之為紅細胞驅動的免疫靶向(EDIT)。相關成果發表在國際頂級期刊PNAS上。AnvayUkidve el al., Erythrocyte-driven immunization via biomimicry of their naturalantigen-presenting function, PNAS (2020).https://doi.org/10.1073/pnas.2002880117
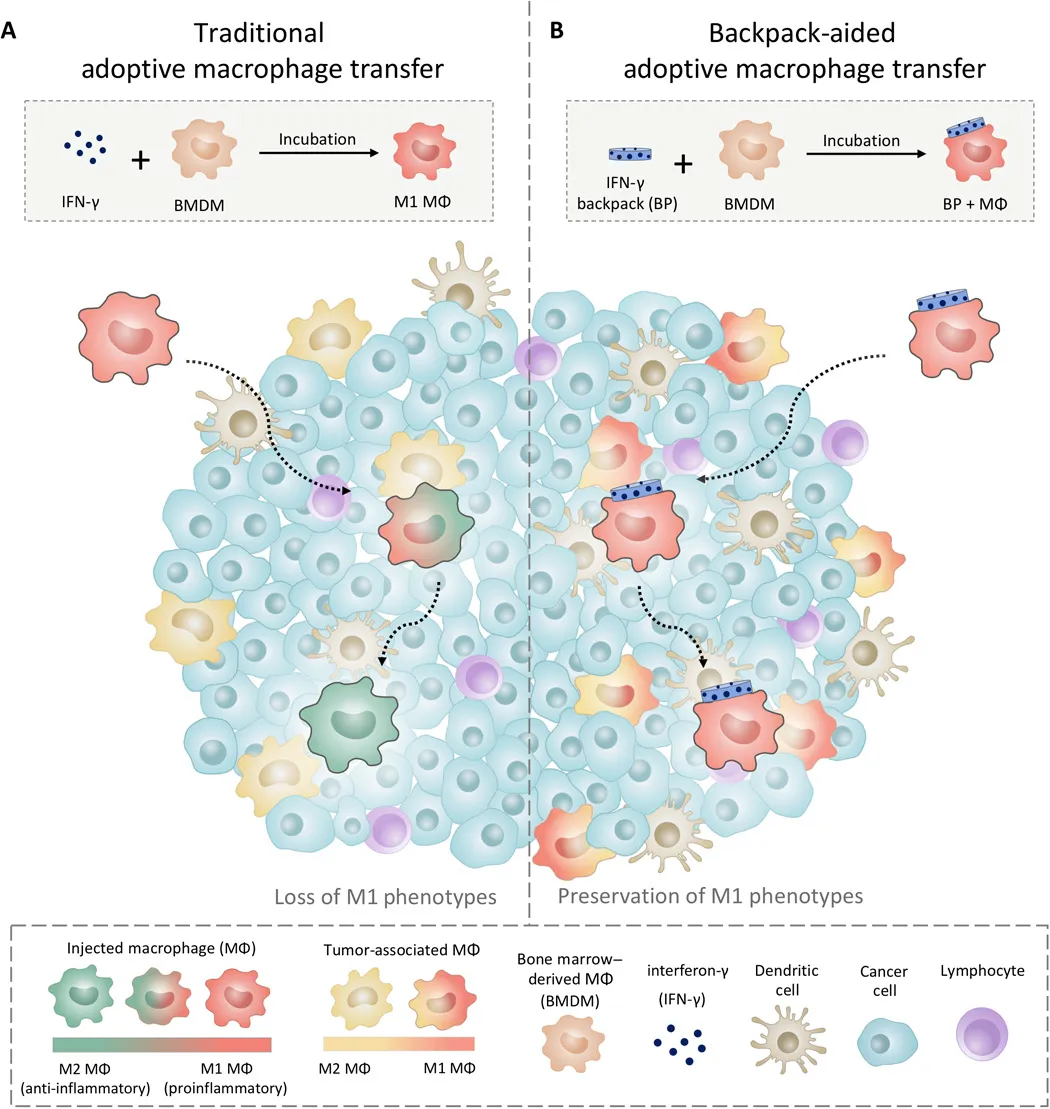
2.Science Advances: 背包上“戰場”,巨噬細胞武裝攻下腫瘤!
美國哈佛大學教授、美國工程院、醫學院雙院院士Samir Mitragotri等人為這個問題創造了一種新型解決方案:為巨噬細胞背著一個可以分泌細胞因子的“背包”顆粒,使得巨噬細胞在到達腫瘤部位后,可以保持殺死腫瘤的狀態長達5天,并已經發現在具有侵襲性乳腺癌的小鼠中可以減緩腫瘤生長和減少轉移,相關成果于發表在4月29日發表在Science Advances上。
Shields C W, et al. Cellular backpacks for macrophage immunotherapy. Science Advances.2020;6(18):eaaz6579.DOI:10.1126/sciadv.aaz6579https://advances.sciencemag.org/content/6/18/eaaz65793. Adv. Mater:利用多酚功能化的生物活性納米復合物對活細胞進行工程化如何在不損害細胞固有生物學特性的前提下安全有效地增強細胞的功能是目前研究的一大熱點。四川大學郭俊凌教授和哈佛大學Samir Mitragotri將具有生物活性的納米復合物(包括蛋白質、DNA、mRNA和病毒載體)組裝到細胞表面,構建了一種細胞雜交系統Cellnex。(1)這一策略可用于對多種細胞包括紅細胞、巨噬細胞、NK細胞和T細胞等進行工程化。體內實驗表明,,Erythrocytenex能夠有效地將蛋白遞送到肺部,其效率比游離的“貨物”增強了11倍。(2)該研究通過仿生微流體實驗和建模等方法對該系統的靶向機制進行詳細的討論。此外,實驗也發現Macrophagenex能夠提高抗Pd-L1檢查點抑制劑在體內的治療效率。綜上所述,這種簡單、適應性強的方法也為快速構建復雜的細胞系統提供一個通用的新策略。Zongmin Zhao. et al. Engineering of Living Cells with Polyphenol-Functionalized Biologically Active Nanocomplexes. Advanced Materials. 2020DOI: 10.1002/adma.202003492https://onlinelibrary.wiley.com/doi/10.1002/adma.202003492佐劑在新型疫苗的設計和開發中起著至關重要的作用。盡管進行了廣泛的研究,但只有少數疫苗佐劑被批準用于人類。目前使用的佐劑大多由人體非天然成分組成,如鋁鹽、細菌脂類或外來基因組材料。于此,哈佛大學Samir Mitragotri院士等人探索了一種新的離子液體基佐劑,它使用人體的兩種代謝物膽堿和乳酸(ChoLa)進行合成的。
1)ChoLa在注射時有效地分配抗原,保持抗原的完整性,增強注射部位的免疫浸潤,并導致對抗原的強有力的免疫反應。2)還探索了ChoLa與明礬和CpG等其他佐劑結合使用的能力。ChoLa吸附在明礬表面上,而不會影響配方的穩定性。ChoLa還可以與CpG混合,同時保持其結構完整性。這強調了離子液體佐劑平臺的多功能性,可以與其他可用的佐劑一起使用,以產生廣譜免疫力。總而言之,這項研究證明了使用ChoLa作為佐劑的可行性。通過對抵抗特定病毒威脅的安全性和功效進行額外的研究,ChoLa和離子液體通常可以顯著增加可用佐劑的種類,從而有助于預防流行病和未來的感染威脅。Ukidve, A., et al., Ionic‐Liquid‐Based Safe Adjuvants. Adv. Mater. 2020, 2002990.https://doi.org/10.1002/adma.2020029905. AFM:離子液體和深共晶溶劑增強抗體在胃腸道的傳遞單克隆抗體(mAbs)目前用于治療許多疾病,包括癌癥、銀屑病、關節炎和特應性皮炎等。目前,所有單克隆抗體都是通過靜脈注射或皮下注射進行的。有鑒于此,美國哈佛大學的Samir Mitragotri等研究人員,報道了一種新型離子液體和深共晶溶劑膽堿和乙醇酸鹽(CGLY)作為胃腸道給藥治療性抗體的平臺。1)CGLY維持了TNFα抗體的穩定性和結構。CGLY可顯著增強TNFα抗體的細胞外轉運。CGLY還降低了腸道粘液的粘度,這是抗體轉運的另一個關鍵屏障。
2)大鼠體內實驗結果表明,CGLY能有效地將TNFα抗體傳遞到腸黏膜和全身循環。一周重復給藥研究及組織學和血清生化分析表明大鼠對CGLY有良好的耐受性。總的來說,這項工作闡明了使用膽堿基離子液體和深共晶溶劑作為局部和系統性治療性抗體口服平臺的前景。Pavimol Angsantikul, et al. Ionic Liquids and Deep Eutectic Solvents for Enhanced Delivery of Antibodies in the Gastrointestinal Tract. Advanced Functional Materials, 2020.DOI:10.1002/adfm.202002912https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.2020029126. Science Advances:活用透明質酸,全身注射型材料為出血性搶救爭取黃金時間!聚合物結構由于其高水溶性、柔韌性和在分子水平上對其靶部分的多價親和力,為治療提供了一個誘人的平臺。以透明質酸(HA)為模型聚合物主鏈,美國工程院、醫學院雙院院士、哈佛大學教授Samir Mitragotri等人報道了一種止血劑,將HA與VBP(TRYLRIHPQSQVHQI)和CBP([GPO]7H)結合,并通過聚合物肽融合(HAPPI),實現高效、無全身毒性的止血效果。CBP介導HAPPI與血管損傷部位暴露的膠原的結合,而VBP是因子VIII蛋白的短序列,負責與vWF結合,VBP介導HAPPI與固定在活化血小板上的vWF結合,并在損傷部位破壞內皮。Yongsheng Gao, et al., A polymer-based systemic hemostatic agent. Science Advances 2020.DOI:10.1126/sciadv.aba0588https://advances.sciencemag.org/content/6/31/eaba0588