pH響應的功能材料可以通過感知腫瘤微環境的變化并做出響應,從而提高診斷或治療效果。然而,對于許多生物過程,pH值的變化非常小(< 0.5個pH單元),基于小分子或非協同型聚合物的傳統pH響應體系無法有效對這么細微的pH差異作出反應。
近十年來,美國德克薩斯大學西南醫學中心高金明教授課題組一直致力于開發可協調的pH超敏感(ultra-pH sensitive, UPS)聚合物,對特定的、及其微小的pH變化范圍具有敏銳響應。這些UPS納米顆粒已經在多種生物學應用中發揮重要作用。其中一種聚合物PC7A及其納米顆粒,可以結合并激活干擾素基因刺激物(STING),由它制備的納米疫苗顯著提高了抗腫瘤免疫力(詳情參考:Luo, M. et al. A STING-activating nanovaccine for cancer immunotherapy, Nat. Nanotech. 2017, 12, 648-654.)。可是,有些功能材料不可降解,多次注射會在生物體內大量積累而產生毒性,一定程度上限制了今后的臨床轉化。

走向降解
為了解決這一問題,該組在原先UPS理念的基礎上開發出一系列可降解的pH超敏感(degradable ultra-pH sensitive, dUPS)聚合物。具有水解活性聚碳酸酯作為聚合物骨架,最終分解產生無毒的小分子醇和二氧化碳,易于排出體外;側鏈則結合不同烷基鏈長或不同結構的質子化叔胺(R?HCl),賦予聚合物的pH超敏感性和可調節的pH轉變點。
研究發現,這一系列dUPS聚合物保留了pH超敏感的性質,能夠對極其微小的pH變化作出敏銳反應,其中代表性聚合物PSC7A在抗原呈遞和抗腫瘤能力方面與“明星”PC7A納米疫苗相當,并且顯示出更低的系統毒性。更重要的是,dUPS聚合物具有水解活性,其降解動力學具有pH依賴性。長期安全性評估表明,與不可降解的PC7A相比,可降解的PSC7A在最大程度降低宿主反應和異物反應方面具有巨大優勢:不可降解的PC7A會引起肉芽腫性炎癥,并在注射部位持續數月不會消失,而可降解的PSC7A在引發短暫的急性炎癥反應之后,聚合物降解使得組織完全愈合。相關成果發表在最近的Nature Communications上,題為“Polycarbonate-based ultra-pH sensitive nanoparticles improve therapeutic window”。

研究亮點:
1.開發出新型可降解的pH超敏感聚合物及其納米顆粒體系,能夠對不同pH轉變點附近的微小pH變化作出敏銳反應,同時具有水解活性。
2.其中代表性聚合物PSC7A與腫瘤抗原制備的納米疫苗可以有效呈遞腫瘤抗原并具有強大的抗腫瘤免疫力。
3. PSC7A顯著改善納米疫苗的安全性和生物相容性。
pH超敏感性是由膠束化相變過程驅動的
研究人員通過開環聚合、點擊化學等方法開發出一系列具有相同聚碳酸酯主鏈,不同結構叔胺側鏈的聚合物(圖1a)。其中藍色部分為親水的PEG,起到穩定作用;綠色部分為聚碳酸酯骨架,具有水解活性;紅色部分為不同碳鏈鏈長或結構的質子化叔胺,用以調節不同的pH轉變點(圖1b),從5.2到7.7不等,廣泛覆蓋一般生理學pH范圍。
研究表明,這一系列聚合物的pH超敏感性是由膠束化相變過程驅動的。dUPS聚合物的表觀pH轉變點與其側鏈叔胺的疏水性呈反線性相關關系(圖1c),具有較高疏水性的側鏈的dUPS聚合物表現出較低的pH轉變值。其中代表性聚合物PSC7A的動態光散射結果顯示(圖1d),當該聚合物的質子化程度高于90%時,聚合物鏈以單鏈形式存在,平均流體動力學直徑低于10 nm,而當質子化程度降低到90%以下時,聚合物鏈立即自組裝形成膠束。研究人員引入臨界膠束質子化程度(CMPD)的概念,當質子化程度低于CMPD時,聚合物鏈開始自組裝形成膠束。對于這些dUPS聚合物而言,CMPD值可高達90%。透射電子顯微鏡和動態光散射的結果都很明顯的顯示,當PSC7A 的質子化程度為95%(高于CMPD)時,聚合物只有單鏈,而當質子化程度降低到85%(低于CMPD)時,膠束形成。這一相變的過程是非常迅速和靈敏的。這些結果都進一步證明在這種獨特的pH敏感納米材料中,膠束化相變是協同pH響應的驅動力。
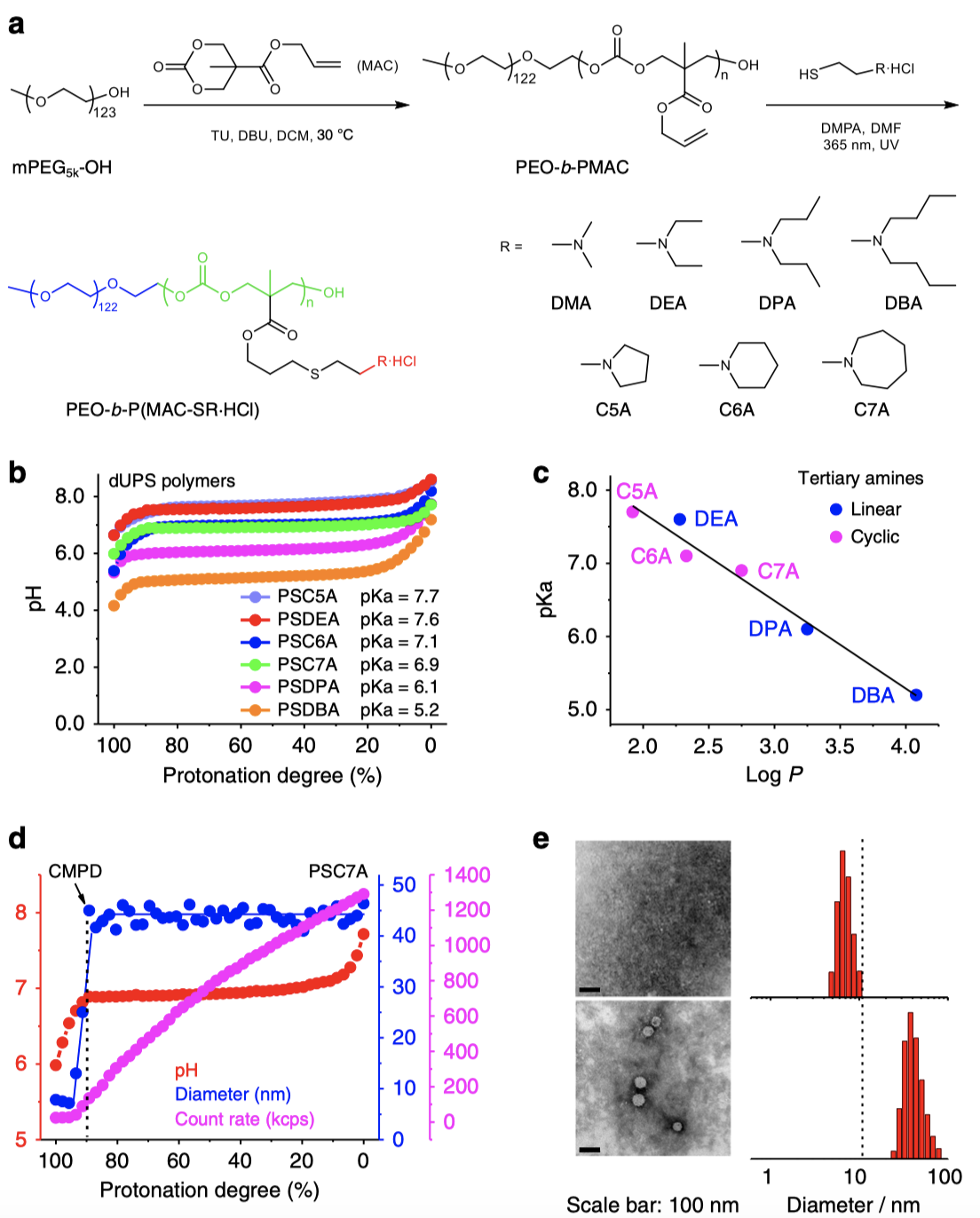
圖1 | dUPS聚合物的pH超敏感性是由膠束化相變過程驅動的
PSC7A納米疫苗可以有效遞送腫瘤抗原并具有強大的抗腫瘤免疫力
等溫量熱滴定法(ITC)結果表明,側鏈為環形叔胺的dUPS聚合物比側鏈為線形叔胺的聚合物表現出更強的STING結合能力和干擾素誘導能力,其中以PSC7A最佳。由PSC7A和腫瘤抗原物理混合制備的納米疫苗,pH超敏感的特性在其藥理特性中發揮重要作用,因為聚合物以膠束形式通過物理引流輸送至在淋巴結駐留的抗原呈遞細胞。聚合物一旦被內吞,pH超敏感性使得納米顆粒在早期的內體成熟過程中解體,破壞內體膜,使PSC7A聚合物能夠活化STING,并將負載的抗原呈遞到MHC I。
健康小鼠的流式結果表明,載有抗原的PSC7A 納米顆粒可以增加CD80+樹突狀細胞和細胞毒性CD8+T細胞的百分比。小鼠體內實驗結果表明,PSC7A納米疫苗可以在TC-1和B16F10兩種腫瘤模型中有效誘導強大的抗腫瘤免疫力,顯著提高小鼠的存活率(圖2)。PSC7A納米疫苗與“明星”PC7A納米疫苗具有相當的抗腫瘤能力。
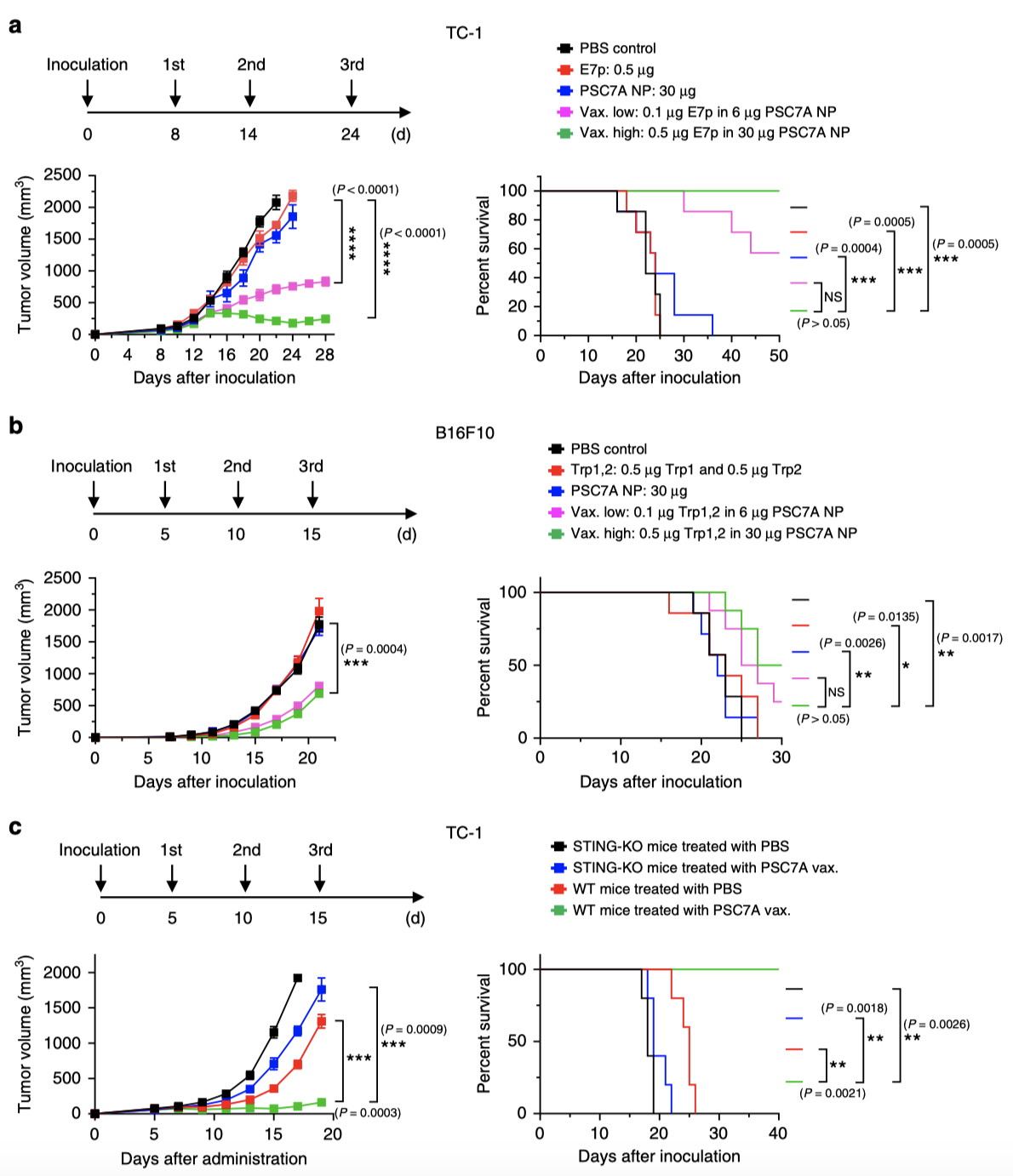
圖2 | PSC7A納米疫苗可抑制荷瘤小鼠的腫瘤生長并延長其存活時間
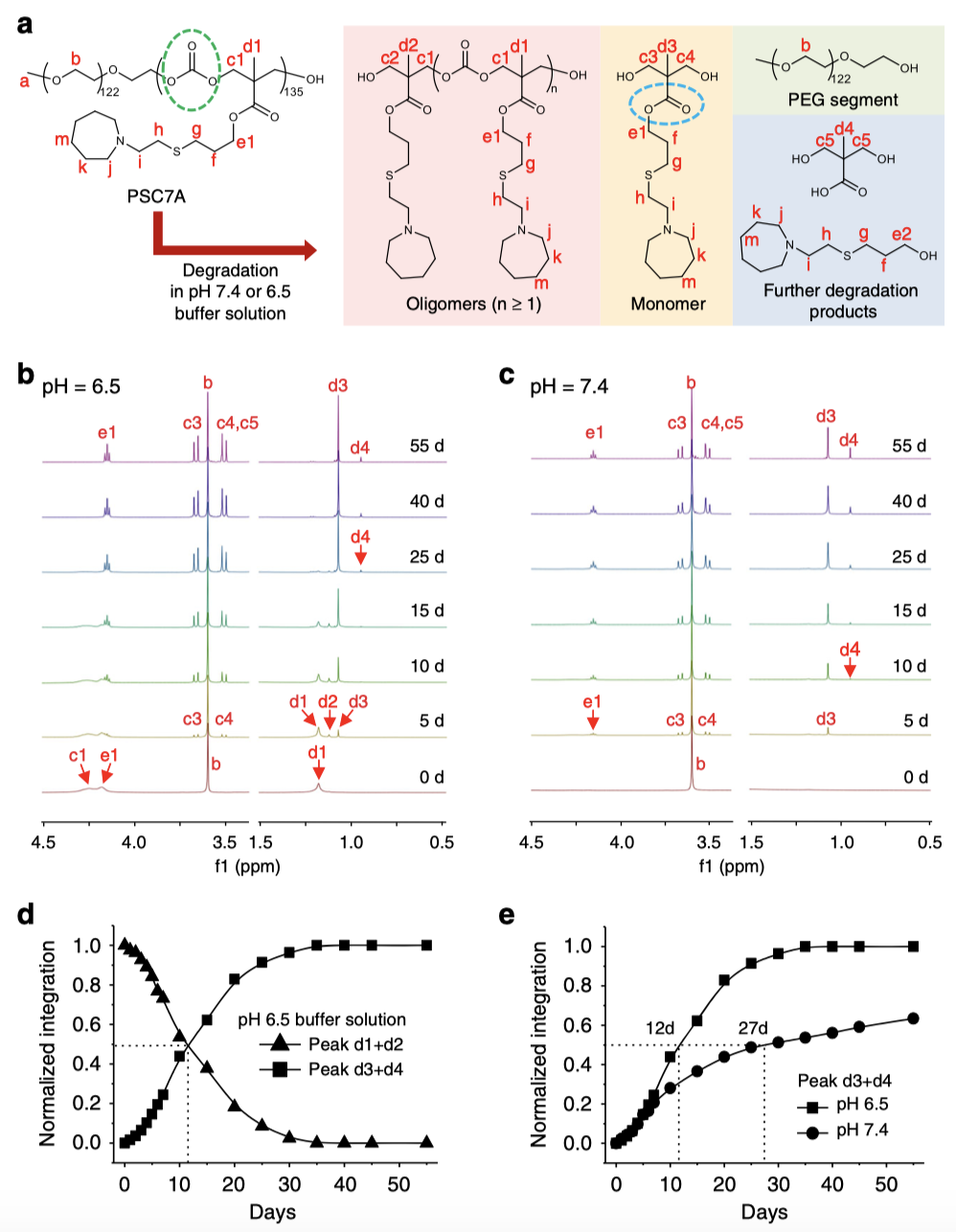
圖3 | PSC7A的降解動力學。
PSC7A聚合物顯著改善安全性和生物相容性
與不可降解的UPS聚合物相比,dUPS的主要優勢在于其可降解體系的安全性。聚碳酸酯的主鏈賦予dUPS聚合物水解活性,使得聚合物在水性環境中自發降解為生物相容性PEO鏈段和無毒小分子。
研究人員用水相核磁進行降解動力學研究(圖3),結果表明,在pH 7.4下水解發生的速率比在6.5時慢(t1/2分別為27和12 天),這是由于PSC7A聚合物鏈在pH 7.4時膠束化,限制了水分子進入碳酸酯基團,而在pH 6.5時聚合物為單鏈,可降解的碳酸酯基團暴露在水環境中。體內短期安全性研究表明,PSC7A和PC7A均能在短期內誘導快速的先天炎癥反應,PSC7A 納米顆粒的系統細胞風暴水平低于PC7A 納米顆粒。在長期安全性研究中,可降解的PSC7A對于不可降解的PC7A的優勢更為突出。
研究人員對小鼠皮下注射PBS,大劑量的PSC7A 納米顆粒或PC7A納米顆粒,并連續觀察60天(圖4a)。給藥后1天,研究人員在注射部位觀察到PC7A和PSC7A都產生了大量急性炎癥反應,可能是由于先天免疫刺激引起。研究人員通過橢圓模型計算得到的皮下結節的表面積,反映形成結節的大小(圖4b)。最初的急性炎癥反應后,皮下結節變小變堅硬,并逐漸轉變為慢性肉芽腫性炎癥反應。PSC7A誘導的結節比PC7A誘導的結節減小的速度更快,表明PSC7A聚合物正在降解并從注射部位排出。最終,PSC7A誘導的結節完全消失,注射部位的組織完全愈合。有趣的是,PSC7A誘導的結節,尺寸減小到一半的時間約為13天,與降解動力學結果一致(圖4b)。相比之下,由PC7A誘導的結節大小減小直到給藥后第45天,此后結節大小和外觀保持恒定,在觀察的60天內都沒有消失。組織學分析表明,與用PBS處理的小鼠相比,用PSC7A處理的小鼠,其皮膚組織在結節完全消失后已經恢復到健康狀態。這些結果都反映了PSC7A聚合物顯著改善的安全性和生物相容性。

圖4 | 可降解的PSC7A 納米顆粒和不可降解的PC7A納米顆粒長期安全性評估
小結:
這項研究報告了一系列可降解的pH超敏感(dUPS)聚合物的設計、合成、表征以及應用。該聚合物同時具有pH超敏感性和可降解性。其中一種代表聚合物PSC7A可以激活STING并傳遞抗原,顯著產生T細胞介導的抗腫瘤免疫力。與不可降解的PC7A聚合物相比,PSC7A產生的系統毒性更低。大劑量皮下注射之后,不可降解的PC7A引起的肉芽腫狀結節會在注射部位持續數月不能消失,而可降解的PSC7A誘導的結節會隨著聚合物降解完全消失,注射部位組織完全愈合。這種可降解的pH超敏感聚合物及其納米顆粒能夠提高安全性和腫瘤治療功效,為相關藥物和蛋白質免疫治療提供了新的機遇。
本研究的第一作者為美國德克薩斯大學西南醫學中心的博士后Xu Wang,通訊作者為高金明教授
參考文獻及原文鏈接:
Wang, X., Wilhelm, J., Li, W. et al. Polycarbonate-based ultra-pH sensitive nanoparticles improve therapeutic window. Nat. Commun. 11, 5828 (2020).
https://doi.org/10.1038/s41467-020-19651-7
通訊作者:

高金明,美國德克薩斯大學西南醫學中心的教授。他帶領的課題組的一項杰出成就是發明了“proton transistor” 技術,該技術可以數字化分析生物學和醫學領域的酸信號。高教授與他的長期合作者,頭頸癌外科醫師Baran Sumer博士共同創立了OncoNano Medicine。熒光納米顆粒傳感器ONM-100已成功完成了對30位癌癥患者的I期臨床試驗,并獲得了FDA的快速批準,從而開始了全癌手術的II期試驗。
近年來,研究團隊已進入免疫腫瘤學領域。STING納米顆粒疫苗(ONM-500)是其另一項發明,已從CPRIT獲得1540萬美元,用于HPV誘導的癌癥的T細胞免疫療法。作為美國國家癌癥研究所癌癥月球計劃的一部分,高教授及其團隊最近獲得了U54納米免疫工程中心獎,以開發創新的納米療法來促進癌癥免疫療法。











