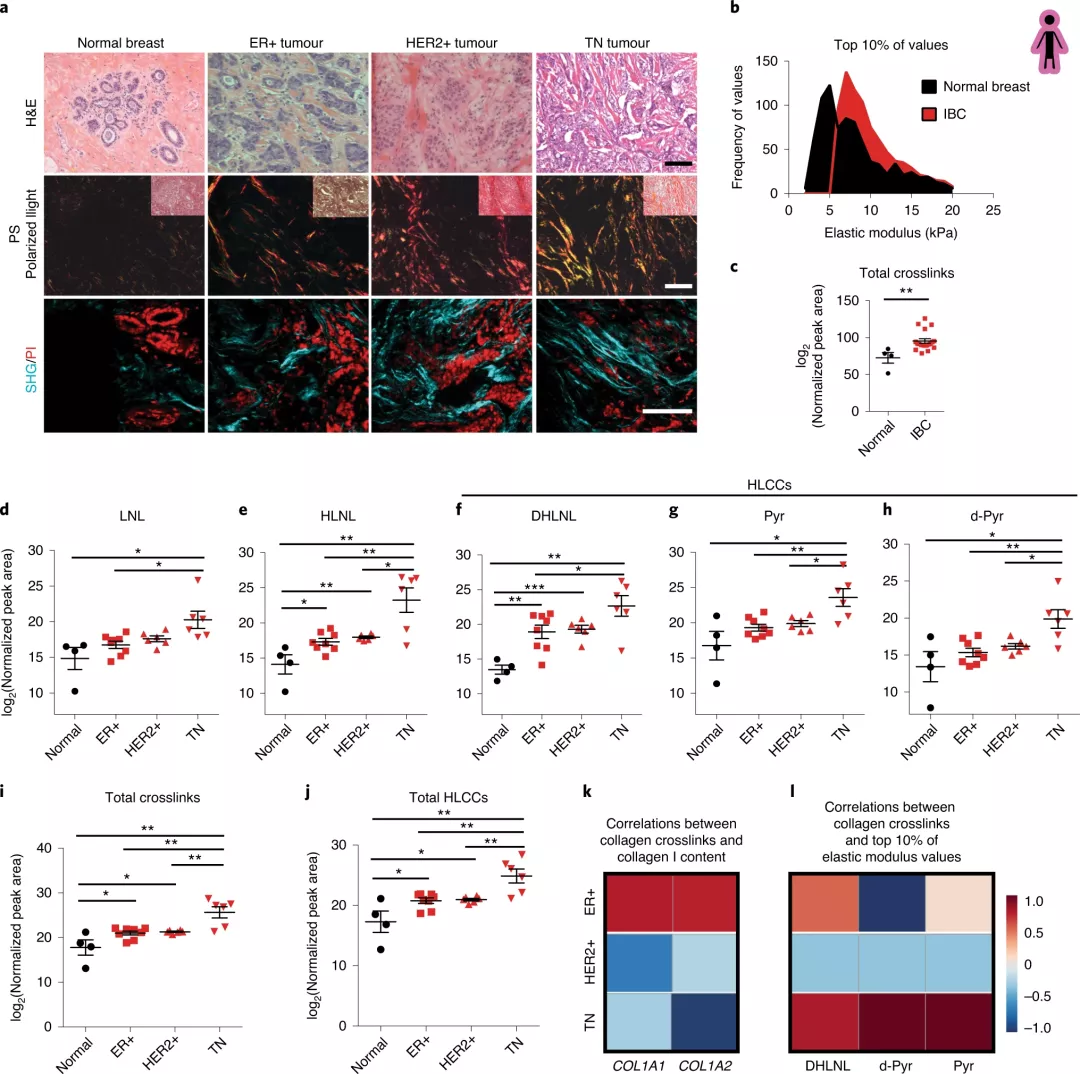
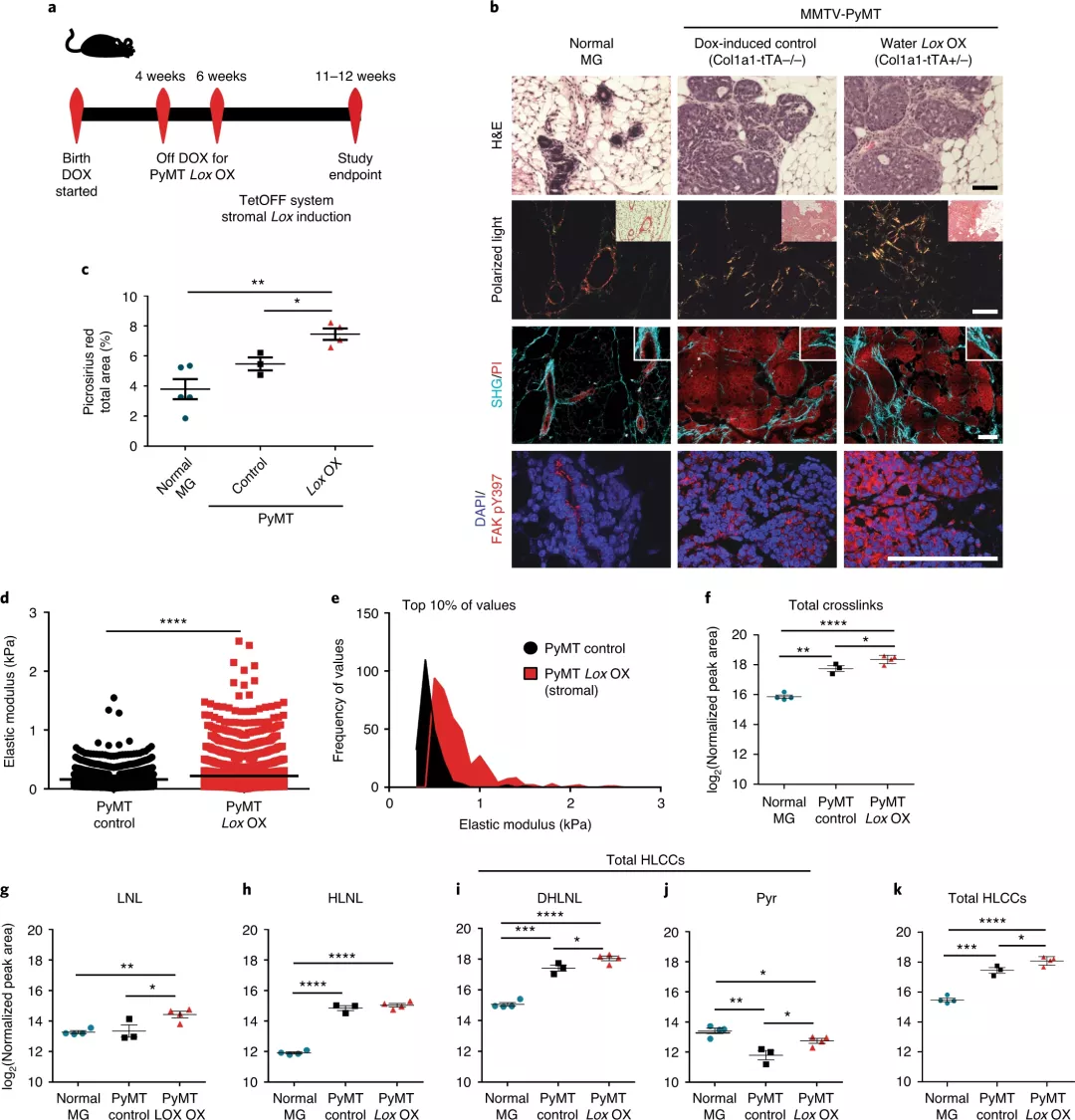
我們知道,細胞外基質是細胞的土壤,其拓撲結構和組成都會影響細胞的增殖與分化。目前研究最多的是關于基質的硬度對于干細胞和腫瘤細胞的影響。對于干細胞而言大部分集中在基質硬度影響其分化的能力,這也是非常有意思的研究方向,前幾年再生醫學方向也進行了許多的研究,如今年發表在Nature上的綜述,就回顧了組織和ECM的復雜機械行為,討論了ECM粘彈性對細胞的影響的最新工作,并描述了在再生醫學中使用粘彈性生物材料的潛力。(五位生物材料大牛Nature綜述 | 材料基質的粘彈性對細胞有何影響?)而近年來,對于腫瘤組織處的細胞外基質的軟硬度對于腫瘤細胞的侵襲性的影響的研究,很是熱門。例如今年9月份Nature雜志上發表的研究論文,研究表明基底膜的軟化和增強的重塑促進腫瘤出芽,而基底膜的變硬則促進折疊(進而進行入侵體內)。再前些時候,2月份,Nature上還發表了一篇關于機械調節細胞骨架與細胞糖酵解之間的關系。加州大學舊金山分校Valerie M. Weaver等人對此進行點評,說明腫瘤通常比正常組織僵硬,并且顯示出異常快速的葡萄糖代謝。結果表明,這兩個特征之間的聯系涉及細胞中蛋白絲網絡中的張力。此外,Nature Materials上也發表了關于ECM剛度的研究論文,研究發現致癌驅動因素(例如受體酪氨酸激酶(RTK)和Ras)與ECM剛性有關。因此,先前的研究表明,細胞外基質(ECM)積累伴隨實體瘤的形成,而腫瘤ECM由逐漸重組和硬化的間質膠原組成。腫瘤纖維化會減弱治療效果,并伴有不良的患者預后。分化程度較低的腫瘤更具纖維化性,并且腫瘤纖維化預示著患者的生存狀況較差。其中,胰腺導管腺癌患者被堅硬的、較厚的膠原蛋白包圍,生存期較短,而基質最堅硬的浸潤性乳腺癌最具有侵略性。細胞培養和體內研究為膠原組織、基質硬度和腫瘤進展之間的因果關系提供了證據。這些數據也強調了我們需要弄清腫瘤相關膠原蛋白的分子性質和基質硬度,以鑒定生物標志物和抗癌治療劑。I型間質纖維膠原蛋白是ECM成分,可調節組織的抗拉強度。膠原蛋白的抗拉強度受兩種酶的調節:1)賴氨酰氧化酶(LOXs),它們通過分子間共價交聯來調節新合成的膠原蛋白分子的原纖維形成;2)賴氨酰羥化酶(LHs),它們催化賴氨酸殘基的翻譯后修飾,從而指定了交聯反應產物的特征。人腫瘤表達高水平的LOX和LH。而且,有研究表明調節這兩種酶可以調節腫瘤的生長和轉移,這意味著靶向膠原蛋白交聯酶具有臨床價值。但是臨床試驗還存在脫靶效應的影響。此外,纖維化組織會發炎,而炎癥則促進纖維化。腫瘤炎癥會促進癌癥的侵襲,而預防炎癥會減少轉移并改善抗腫瘤治療。然而,目前炎癥是否通過誘導基質硬化來促進這些表型尚不清楚。于此, 為了探索膠原蛋白交聯在惡性腫瘤中的作用,加州大學舊金山分校Valerie M. Weaver等人開發了一種交聯氨基酸分析(xAAA)方法,該方法能夠表征各種膠原蛋白水平范圍內組織中特定的膠原蛋白交聯。他們分析了賴氨酰羥化酶介導和賴氨酰氧化酶介導的膠原蛋白交聯,并量化了具有最硬基質的侵襲性人類乳腺癌亞型中總膠原蛋白和復雜膠原蛋白交聯的最大豐度。而且,該技術揭示了在膠原蛋白濃度非常低或非常高的臨床標本中,膠原蛋白交聯與豐度之間呈正相關。該方法確定了依賴LH2的羥賴氨酸醛(Hylald)衍生的膠原交聯子集(HLCC)對于組織的機械強度至關重要。成果發表在Nature Materials上。具有最硬基質的侵襲性人類乳腺癌具有最大數量的腫瘤相關巨噬細胞,在實驗模型中,這些巨噬細胞的治療性削弱能減少了轉移,還能減少膠原交聯和間質硬化。交聯酶賴氨酰氧化酶的上皮靶向表達對PyMT乳腺腫瘤中的膠原交聯沒有影響,而靶向基質細胞則有影響。數據顯示,在惡性腫瘤的早期,膠原交聯酶和膠原交聯的表達增加,同時腫瘤細胞浸潤和浸潤性巨噬細胞積聚。這可以解釋為什么迄今為止針對晚期腫瘤中的LOX和LOXL2的治療藥物未能延長乳腺癌患者的生存期。此外,對一組乳腺癌患者進行活檢的免疫組織化學分析表明,賴氨酰羥化酶2的基質表達與疾病特異性死亡率顯著相關。圖|羥賴氨酸膠原蛋白交聯的豐度與人類乳腺癌的侵襲有關在已建立的浸潤性腫瘤中,基質可能含有高水平的交聯膠原蛋白,因此盡管這些試劑可防止進一步的膠原蛋白交聯活性,但它們無法逆轉已經存在于組織中的交聯鍵或膠原蛋白修飾。取而代之的是,基質LH2的可檢測增加可能提供疾病侵襲的早期預后標志物,可以為干預措施和治療策略提供依據。總而言之,研究表明,基質LH2是乳腺癌生存率的有力預測指標,這些發現將組織炎癥、基質細胞介導的膠原交聯和硬化與腫瘤侵襲性聯系起來,并確定賴氨酰羥化酶2作為基質生物標志物。確實,結果表明,LH2衍生的膠原交聯不僅是TN乳腺癌基質硬度的獨特特征,而且可以預測DMFS。未來需要使用實驗模型進行研究,以確認基質LH2,腫瘤侵襲性和轉移之間是否存在因果關系。無論如何,這些發現暗示著膠原蛋白交聯的特征而不僅僅是交聯的豐度,可能會在調節腫瘤的侵襲性起關鍵作用。Maller, O., et al. Tumour-associated macrophages drive stromal cell-dependent collagen crosslinking and stiffening to promote breast cancer aggression. Nat. Mater. (2020).https://doi.org/10.1038/s41563-020-00849-5