工程納米材料具有改善疾病診斷和治療特異性的重大前景。2000年時(shí)候,美國國家科學(xué)技術(shù)委員會(huì)就啟動(dòng)了國家納米技術(shù)計(jì)劃,這推動(dòng)了廣泛的研究,但可用于患者的納米藥物的數(shù)量仍大大低于該領(lǐng)域的預(yù)測,部分原因是動(dòng)物與人類研究之間存在轉(zhuǎn)化鴻溝,還有患者之間的異質(zhì)性也可能限制納米藥物的成功,并且目前關(guān)于納米藥物之間以及分層患者群體中相互作用的研究還很有限。因此,在已獲批準(zhǔn)的納米藥物中,很少被推薦作為一線治療選擇。
許多早期的NP無法克服傳遞過程中的生物學(xué)障礙,但是最近的NP設(shè)計(jì)已經(jīng)利用受控合成策略的進(jìn)步來整合復(fù)雜的結(jié)構(gòu)、生物響應(yīng)部分和靶向劑以增強(qiáng)傳遞。因此,這些NP可用作更復(fù)雜的系統(tǒng),以改變多種途徑,最大化治療功效,靶向細(xì)胞周期的特定階段或克服耐藥性機(jī)制。
目前,許多科學(xué)家想要通過精準(zhǔn)醫(yī)學(xué)和個(gè)性化醫(yī)學(xué)來克服NP的生物學(xué)障礙。基于在患者數(shù)據(jù)的基礎(chǔ)上進(jìn)行新的NP設(shè)計(jì),可以大大改善精密藥物治療的遞送和響應(yīng)。
鑒于此,麻省理工學(xué)院Robert Langer院士、德州大學(xué)奧斯汀分校Nicholas A. Peppas院士和賓夕法尼亞大學(xué)Michael J. Mitchell等人在Nature ReviewsDrug Discovery上發(fā)表了用于藥物遞送的工程精準(zhǔn)納米顆粒的綜述。他們集中于納米醫(yī)學(xué)的進(jìn)展,這些進(jìn)展可以促進(jìn)精確藥物的臨床轉(zhuǎn)化,并改善患者的治療反應(yīng),重點(diǎn)是利用生物材料和生物醫(yī)學(xué)工程創(chuàng)新來克服生物障礙和患者的異質(zhì)性。
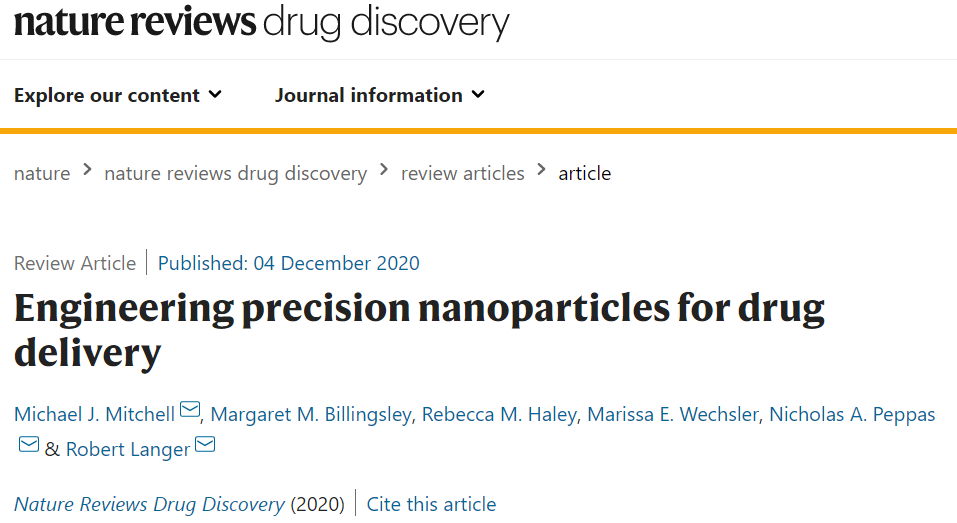

圖|精確醫(yī)學(xué)應(yīng)用的生物障礙
首先,作者對(duì)目前的納米粒子進(jìn)行分類,如下:
1)基于脂質(zhì)的NPs
作為一種給藥系統(tǒng),脂質(zhì)納米粒具有許多優(yōu)點(diǎn),包括配方簡單、自組裝、生物相容性、高生物利用度、攜帶大有效載荷的能力以及一系列可以控制以調(diào)節(jié)其生物學(xué)特性的物理化學(xué)性質(zhì)。基于這些原因,脂質(zhì)納米粒是FDA批準(zhǔn)的納米藥物中最常見的一類。
另外,基于脂質(zhì)的NP的另一個(gè)重要子集通常稱為脂質(zhì)納米顆粒(LNP),被廣泛用于核酸的遞送。它們與傳統(tǒng)脂質(zhì)體的不同之處主要在于,它們?cè)陬w粒核心內(nèi)形成膠束結(jié)構(gòu),這種形態(tài)可根據(jù)配方和合成參數(shù)進(jìn)行更改。但LNP系統(tǒng)會(huì)受到藥物載量低和生物分布低的限制,從而導(dǎo)致肝臟和脾臟的高攝取
2)基于聚合物的NPs
聚合NP是藥物遞送的理想候選者,因?yàn)樗鼈兛缮锝到猓苄裕锵嗳菪裕律圆⑶以趦?chǔ)存過程中穩(wěn)定。它們的表面可以很容易地進(jìn)行修飾以實(shí)現(xiàn)額外的靶向作用,從而使它們能夠?qū)⑺幬铮鞍踪|(zhì)和遺傳物質(zhì)輸送到目標(biāo)組織,這使其在癌癥醫(yī)學(xué),基因療法和診斷學(xué)中非常有用。然而,聚合物NP的缺點(diǎn)包括增加顆粒聚集和毒性的風(fēng)險(xiǎn)。目前只有少量的聚合納米藥物已獲得FDA批準(zhǔn)并用于臨床,但是聚合納米載體目前正在眾多臨床試驗(yàn)中進(jìn)行測試。
3)無機(jī)NPs
由于其磁性、放射性或等離子性質(zhì),無機(jī)納米粒子在診斷、成像和光熱療法等應(yīng)用方面具有獨(dú)特的優(yōu)勢。大多數(shù)具有良好的生物相容性和穩(wěn)定性,并填補(bǔ)了有機(jī)材料無法達(dá)到的特性的生態(tài)位應(yīng)用。然而,由于低溶解度和毒性問題,特別是在使用重金屬的制劑中,它們的臨床應(yīng)用受到限制。
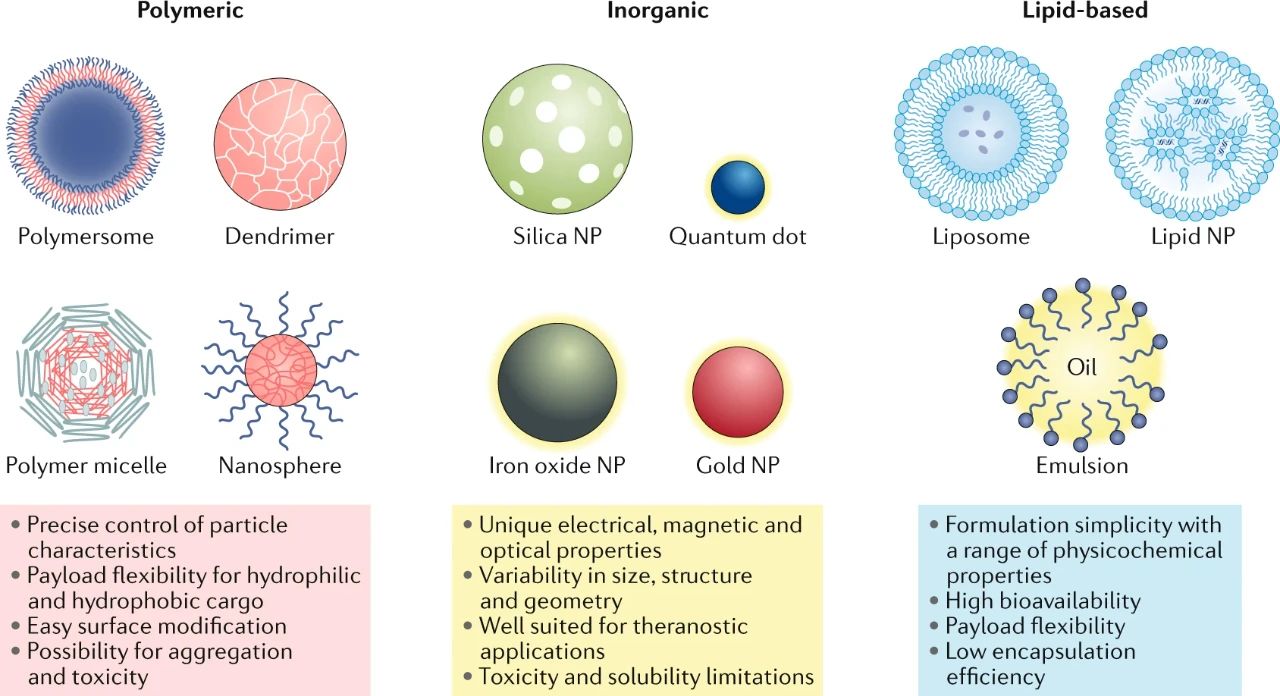
圖|納米粒子的種類
然后,作者討論了下精準(zhǔn)醫(yī)學(xué)結(jié)合NPs的必要性
精準(zhǔn)醫(yī)學(xué)推動(dòng)了針對(duì)患者的臨床治療的發(fā)展,以克服傳統(tǒng)“一刀切”方法的諸多局限性,提高治療效果。在腫瘤學(xué)中,通過生物標(biāo)記物和輔助診斷對(duì)患者進(jìn)行分層已成為藥物開發(fā)的規(guī)范,因?yàn)榇蠖鄶?shù)癌癥納米藥物在未經(jīng)分層的研究中未能產(chǎn)生積極的結(jié)果。
盡管患者分層在多種癌癥精密藥物的臨床開發(fā)中至關(guān)重要,但目前基于NP的臨床試驗(yàn)仍在未分層的患者群體中進(jìn)行。但是,隨著分層的重要性越來越明顯,并且開始考慮到特定患者人群的NPs,這種情況在不久的將來可能會(huì)改變。
總而言之,將NP和精密醫(yī)學(xué)相結(jié)合具有推動(dòng)這兩個(gè)領(lǐng)域發(fā)展的潛力。精確醫(yī)學(xué)的成功依賴于嚴(yán)格分層的患者人群,而使用NP來改善跨異質(zhì)性生物屏障的遞送可以提高精確醫(yī)學(xué)的功效,從而使更多的患者包括在分層人群中,并增加成功轉(zhuǎn)化到診所的可能性。用于精密醫(yī)學(xué)的納米生物材料的開發(fā)是高度可定制的過程。這種精心設(shè)計(jì)的方法可以調(diào)整治療劑的藥代動(dòng)力學(xué),以適應(yīng)溶解性、給藥或生物分布的要求,并且在研究環(huán)境中取得了成功。
生物學(xué)障礙
即使在正常的生理?xiàng)l件下,由于NP都面臨物理和生物障礙(包括剪切力,蛋白質(zhì)吸附和快速清除),這也限制了到達(dá)目標(biāo)治療部位的NP比例,因此難以實(shí)現(xiàn)有效的生物分布和藥物輸送。而且這些障礙隨疾病的生長而改變,還因人而異。
下面,作者將討論NP在全身、局部和細(xì)胞范圍內(nèi)克服生物學(xué)障礙的策略。
全身循環(huán)
大小、形狀、電荷和表面涂層等因素決定了血液循環(huán)中納米顆粒(NPs)的情況,包括清除率,以及NPs與局部屏障(如腫瘤微環(huán)境或粘液層)的相互作用。總體而言,球形和較大的NP在循環(huán)過程中更容易著邊,表面修飾(如PEG和血小板)會(huì)降低納米粒在循環(huán)中的被巨噬細(xì)胞的清除。另外,而桿狀NP則更容易從血管中滲出到腫瘤。巨噬細(xì)胞可以更快地清除未包被的或帶正電荷的NP。
局部分布
就局部分布而言,通常,桿狀、中性和靶向NPs更容易穿透腫瘤,而帶正電荷的、更小且有涂層的NPs更容易穿越粘膜屏障。
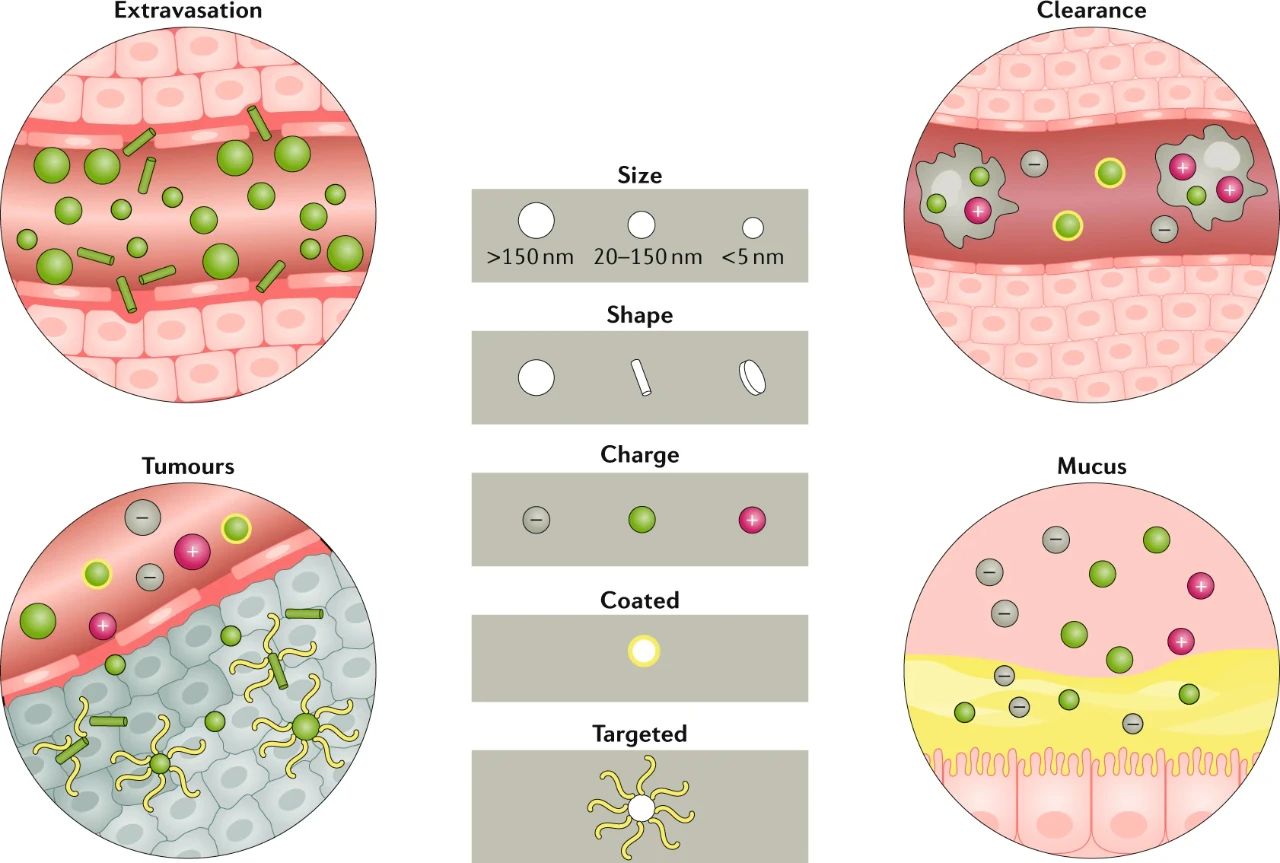
圖|NP特性影響其分布
細(xì)胞和細(xì)胞內(nèi)屏障
此外,與細(xì)胞表面相互作用后,NPs的表面,大小,形狀和電荷也會(huì)通過非特異性相互作用(例如膜包裹或特異性相互作用)被各種類型的內(nèi)吞作用或胞飲作用攝取,
進(jìn)入細(xì)胞后,NPs仍被困在具有各種特征(例如內(nèi)部或外部受體)的囊泡區(qū)室或內(nèi)體中。為了實(shí)現(xiàn)功能性輸送,大多數(shù)NP在酸化之前必須從這些區(qū)室中逸出,因此,響應(yīng)性NP(例如在低pH環(huán)境中帶電的可電離的NP)有助于內(nèi)體逃逸并允許細(xì)胞內(nèi)遞送,而無響應(yīng)的NP通常仍被困住并被溶酶體酸度和蛋白水解酶破壞。
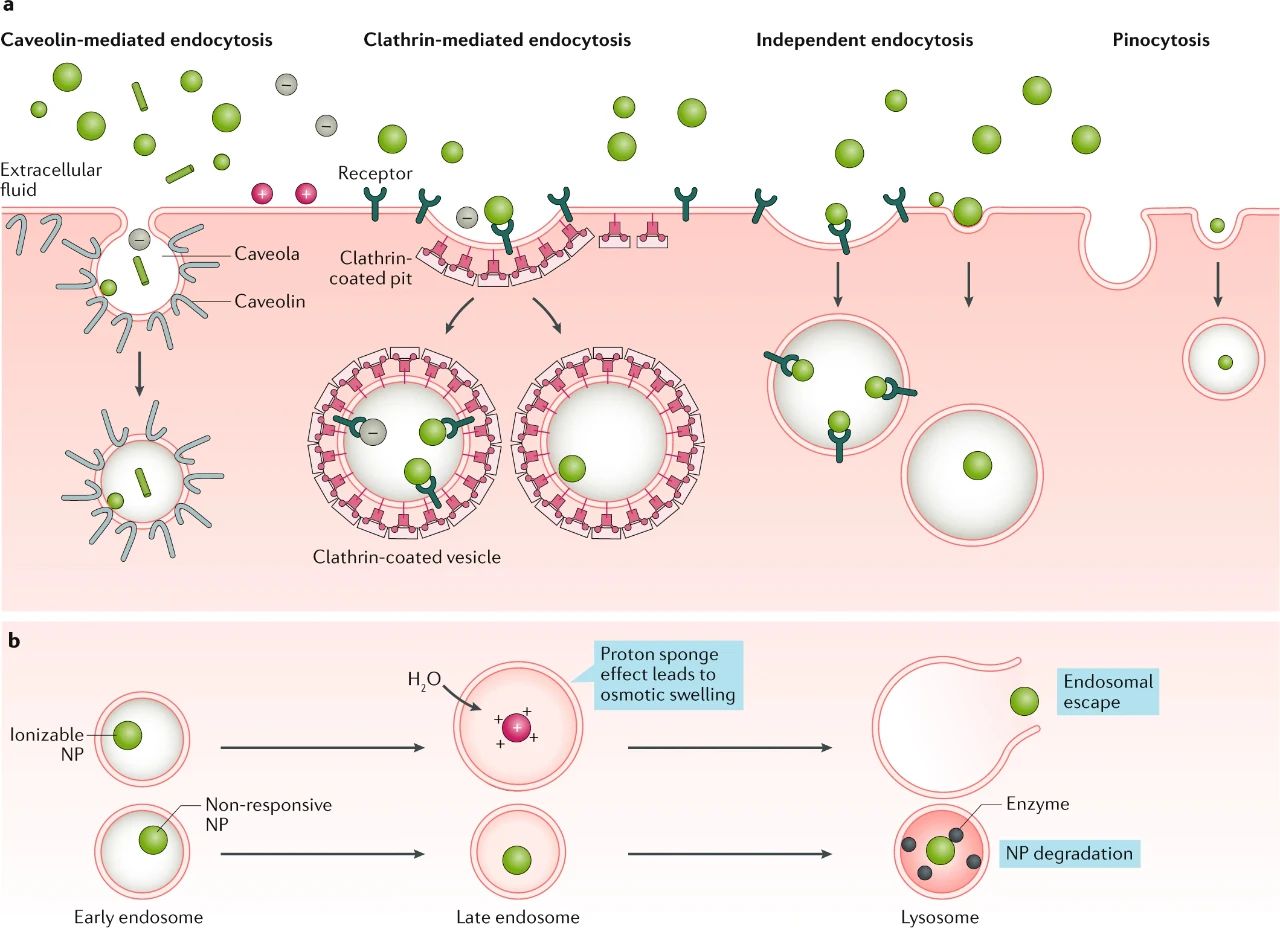
圖|最終決定細(xì)胞內(nèi)NP命運(yùn)的常見攝取途徑
精準(zhǔn)醫(yī)學(xué)的策略
為了解決患者人群內(nèi)部和人群之間生物屏障和疾病狀態(tài)的巨大異質(zhì)性,必須開發(fā)出以高度模塊化和可定制的方式提供治療方法的方法。下面介紹了各種NP特性對(duì)遞送的影響,重點(diǎn)是單個(gè)NP設(shè)計(jì)選擇(例如架構(gòu),材料特性,靶向性和響應(yīng)性)如何克服特定疾病和患者特有的障礙。
首先是針對(duì)癌癥治療,作者給出以下建議:
1)適應(yīng)腫瘤的微環(huán)境
腫瘤微環(huán)境會(huì)嚴(yán)重影響患者的預(yù)后,因?yàn)樗鼤?huì)影響化療效果。可以利用癌細(xì)胞膜包裹以實(shí)現(xiàn)腫瘤微環(huán)境靶向性,且雜交膜(如紅細(xì)胞-癌細(xì)胞混合體)可進(jìn)一步提高特異性。還可以設(shè)計(jì)響應(yīng)于微環(huán)境的納米藥物,例如iCluster,在血液為100 nm,到腫瘤處降解為5nm等等,均可依據(jù)腫瘤微環(huán)境進(jìn)行設(shè)計(jì)。
2)主動(dòng)靶向癌細(xì)胞
通過添加靶向或設(shè)計(jì)成可分離的隱形暈系統(tǒng)和電荷反轉(zhuǎn)系統(tǒng),可以開發(fā)出可以更改給定屬性以針對(duì)其當(dāng)前面臨的遞送障礙進(jìn)行優(yōu)化的系統(tǒng)。
下面,作者繼續(xù)介紹納米用于免疫療法的策略
盡管免疫檢查點(diǎn)抑制劑已顯示出對(duì)癌癥治療的巨大希望,但使用免疫調(diào)節(jié)劑仍存在功效、患者變異性和脫靶效應(yīng)的挑戰(zhàn)。某些免疫療法(例如蛋白質(zhì))在自由給藥時(shí)具有有限的傳遞潛力,因此NP具有通過保護(hù)免疫療法并增強(qiáng)其與免疫細(xì)胞的相互作用來顯著改善傳遞的潛力。
免疫激活
巨噬細(xì)胞,B細(xì)胞和樹突狀細(xì)胞都是APC,并且可以被NP靶向以提高免疫激活的特異性。被動(dòng)靶向包括優(yōu)化尺寸、形狀以及使用帶正電的粒子與帶負(fù)電的細(xì)胞膜相互作用。APCs還表達(dá)許多用于內(nèi)吞作用的可識(shí)別碳水化合物的凝集素受體,這些已被用于細(xì)胞特異性主動(dòng)靶向。所有這些方法旨在增加抗原與APC相互作用的可能性,提高基于抗原的療法的功效,并降低達(dá)到治療水平所需的劑量。
免疫抑制
類風(fēng)濕關(guān)節(jié)炎和系統(tǒng)性紅斑狼瘡等疾病也源于不正確的免疫調(diào)節(jié):過度激活。在這些自身免疫性疾病中,T細(xì)胞和B細(xì)胞對(duì)自身抗原敏感。自身免疫性疾病通常用一般的免疫抑制劑治療,這可能會(huì)導(dǎo)致嚴(yán)重的副作用。免疫過度激活引起的疾病可以受益于更有針對(duì)性的免疫療法。同樣,可以利用納米粒子靶向這些細(xì)胞,來抑制免疫的過度激活,從而改善自身免疫情況。
最后,作者還介紹了關(guān)于納米粒子用于基因編輯的應(yīng)用的優(yōu)勢。
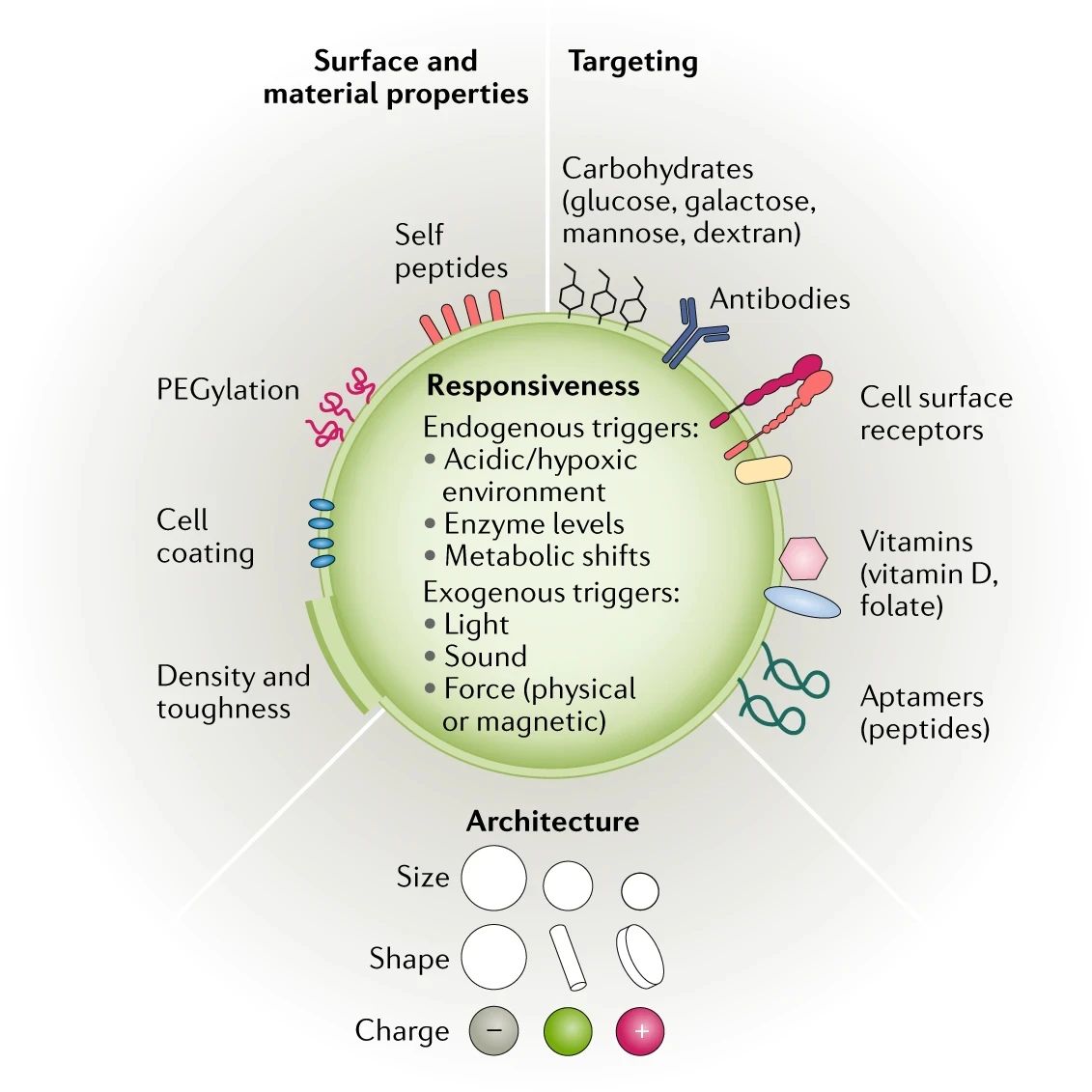
圖|通用設(shè)計(jì)的NP表面特性,可增強(qiáng)輸送能力
小結(jié):
該綜述系統(tǒng)討論了可用于改進(jìn)精準(zhǔn)療法的非個(gè)性化和精準(zhǔn)應(yīng)用中使用的先進(jìn)納米顆粒設(shè)計(jì)。專注于克服分娩障礙的納米顆粒設(shè)計(jì)方面的進(jìn)展,認(rèn)為智能納米顆粒設(shè)計(jì)可以提高常規(guī)給藥應(yīng)用中的功效,同時(shí)為精確應(yīng)用量身定制設(shè)計(jì),從而最終改善患者的總體治療效果。
參考文獻(xiàn):
Mitchell, M.J., et al.Engineering precision nanoparticles for drug delivery. Nat Rev Drug Discov(2020).
https://doi.org/10.1038/s41573-020-0090-8











